- Alcaloïde
-
Les alcaloïdes sont des molécules organiques hétérocycliques azotées basiques pouvant avoir une activité pharmacologique.
À l'origine, le terme a été employé pour décrire n'importe quelle base de Lewis contenant un hétérocycle azoté (ou improprement une amine). À cause du doublet électronique non liant de l'azote les alcaloïdes sont considérés comme des bases de Lewis.
On trouve des alcaloïdes, en tant que métabolites secondaires, principalement chez les végétaux, les champignons et quelques groupes animaux peu nombreux. Habituellement les alcaloïdes sont des dérivés des acides aminés.
Bien que beaucoup d'alcaloïdes soient toxiques (comme la strychnine ou l'aconitine), certains sont employés dans la médecine pour, par exemple, leurs propriétés analgésiques (comme la morphine, la codéine), dans le cadre de protocoles de sédation (anesthésie) souvent accompagnés d'hypnotiques, ou comme agent antipaludéen (quinine, chloroquinine) ou agent anticancéreux (taxol, vinblastine, vincristine).
Il existe un type d'alcaloïdes contenant deux atomes d'azote dans le noyau aromatique et qui n'est pas d'origine naturelle, c'est le groupe des pyrazoles.
Étymologie : le terme 'alcaloïde' dérive de alcali* "base" et du suffixe -oïde* "comme, semblable à". Il vient du latin du Moyen Age alkali, emprunté lui-même à l'arabe al qate, al qaly القالي "la soude", plante du genre Salsola dont on a extrait pendant longtemps du carbonate de sodium.
Tous les alcaloïdes portent une terminaison en « -ine », comme l'atropine, l'ergine ou la morphine.
Sommaire
Historique
La connaissance et l'usage des plantes à alcaloïdes, comme le pavot à opium ou l'aconit, sont très anciens, mais la connaissance de leurs substances actives ne date que du début du XIXe siècle. En 1803, Charles Derosne, pharmacien et industriel français, est le premier à isoler un alcali végétal[1]en extrayant de l'opium un mélange de narcotine et de morphine, mais il attribue la nature alcaline de son extrait à des résidus de préparation. L'année suivante, en 1804, Armand Seguin rapporte avoir trouvé un procédé de préparation de la morphine, mais il ne publie ses résultats qu'en 1814. Enfin, en 1805 en Westphalie, un assistant en pharmacie, Friedrich Sertürner, reconnaît la nature alcaline du principe somnifère de l'opium. Une dizaine d'années plus tard, il le nommera morphium en référence à Morphée, divinité des rêves dans la Grèce antique[2]. Passées inaperçues à l'époque, ces découvertes faites en France et en Allemagne ne sont reconnues qu'en 1817, avec la preuve apportée par Sertürner que la morphine réagit avec l'acide pour former un sel.
La rivalité franco-allemande continue à être féconde puisque, entre 1817 et 1820, deux pharmaciens français, Pelletier et Caventou, découvrent une impressionnante série de composés actifs : caféine, émétine (de l'ipéca), strychnine (de la noix vomique), quinine et cinchonine (de l'écorce de quinquina).
Le terme « alcaloïde » est créé en 1819 par un pharmacien de Halle, Wilhelm Meissner (1792-1853) .
L'élucidation des structures chimiques des alcaloïdes ne débute qu'en 1870 avec celle de la plus simple, la coniine, par Schiff, et certains ne révéleront leur structure qu'à la fin du XXe siècle, au long duquel Maurice-Marie Janot et ses élèves en auront isolé, analysé et synthétisé plus d’une centaine, établissant, en 1953, la structure de la corynanthéine, étape majeure dans le progrès de la chimie des alcaloïdes.
Détection des alcaloïdes
Les alcaloïdes ont la propriété de former des sels et d'avoir un goût amer.
La caractérisation de la présence d'alcaloïde peut se faire par précipitation à l'aide de :
- Réactif silicotungstique : réactif de Bertrand
- Réactif phosphotungstique : réactif de Scheibler
- Réactif phosphomolybdique : réactif de Try-Sonenschein
- Réactif phosphoantimonique : réactif Schulze
- Iodure de potassium : réactif de Bouchardat
- Tétraiodomercurate de potassium : réactif de Valser-Mayer
- Iodobismuthate de potassium : réactif de Dragendorff
- Iodoplatinate de potassium.
- Acide picrique.
- Tanins.
De nombreuses autres méthodes comme la chromatographie sont également employées pour identifier et doser la molécule.
Extraction des alcaloïdes
Comme les alcaloïdes se trouvent le plus souvent sous forme de sels d’acides minéraux ou organiques, et parfois leur combinaison (dont les tanins en particulier), on pulvérise les plantes avec un alcalin. Leur mode d'extraction est très variable selon la nature de l'alcaloïde, mais on trouve typiquement deux schémas d'extraction : par un solvant apolaire en milieu alcalin ou par un solvant polaire en milieu acide (de Brönsted).
Solvant non polaire en milieu alcalin
- la plante sèche est pulvérisée et humectée avec une solution aqueuse alcaline (chaux, l'ammoniaque NH4+OH-, soude pour déplacer les bases fortes)
- Extraction avec un solvant organique non polaire
- Le marc est éliminé
- La solution organique (alcaloïdes, lipides, pigments..) est conservée
- On concentre par un chauffage doux, ou par un évaporateur rotatif
- On effectue sur le concentré un épuisement par un acide dilué (généralement on utilise l’acide sulfurique 0.5 N), puis on procède à une extraction (liquide – liquide)
- La solution aqueuse acide est alcanisée
- On procède à un nouvel épuisement par un solvant organique non miscible (éther, chloroforme, xyléne)
- On obtient une solution organique alcaloïde, qu’il faut alors concentrer par évaporation
- On obtient alors un résidu d’alcaloïdes bruts
Alcool acide
- la plante sèche est pulvérisée en présence d'alcool acide
- on procède à une lixiviation
- le marc est rejeté
- la solution extraite (alcaloïdes, amines, résines, pigments) est évaporée
- cette solution est reprise par un acide dilué (la solution aqueuse acide obtenue contient des sels d’alcaloïdes impurs)
- la solution aqueuse acide est alors alcalinisée pour saponifier les sels d'alcaloïdes
- on procède ensuite à l'épuisement par un solvant non miscible (ether, xyléne, chloroforme)
- on sépare la solution organique d’alcaloïdes
- on évapore cette solution pour obtenir un résidu d’alcaloïdes bruts
On procède enfin aux réactions de précipitation des alcaloïdes pour vérification.
Classifications
On estime actuellement que plus de 8 000 composés naturels ont été identifiés comme alcaloïdes[3]. Tous les ans, une centaine de nouvelles molécules seraient ajoutées par les scientifiques du monde entier. Afin de pouvoir mieux maitriser cette grande liste, trois types de classification des alcaloïdes ont été proposées suivant :
- leurs activités biologiques et écologiques,
- leurs structures chimiques,
- leurs voies de biosynthèse.
Classification structurale
Ils ont longtemps été catégorisés et nommés en fonction du végétal ou de l'animal dont ils étaient isolés.
À partir du XXIe siècle, ils sont catégorisés en fonction de leur structure chimique :
- Groupe des Azolidines (pyrrolidines) : Aniracetam, Anisomycin, CX614, Dextromoramide, Diphenyl prolinol, Acide Domoic, Histapyrrodine, Acide Kainic, Methdilazine, Oxaceprol, Prolintane, Pyrrobutamine, hygrine, cuscohygrine.
- Groupe des Azines : pipéridine, conicine, trigonelline, arecaidine, guvacine, pilocarpine, cytisine, nicotine, spartéine, pelletierine.
- Groupe des Tropanes : atropine, hyoscyamine, cocaïne, ecgonine, scopolamine.
- Groupe des Quinoléines : Acridine, Acide bicinchoninique, Broxyquinoline, Chlorquinaldol, Cinchophen, Clioquinol, Dequalinium, Dihydroquinine, Dihydroquinidine, Hydroxychloroquine, 8-Hydroxyquinoline, Iodoquinol, Acide Kynurenique, Méfloquine, Nitroxoline, Oxycinchophen, Primaquine, Quinine, Quinidine, TSQ, Topotecan, Acide Xanthurenic, Strychnine, Brucine, Veratrine, Cevadine, Echinopsine
- Aminoquinolines : Chloroquine, Hydroxychloroquine, Primaquine
- 8-Aminoquinolines : Primaquine, Tafenoquine, Rhodoquine, Pamaquine
- Groupe des Isoquinolines : dimethisoquine, quinapril, quinapirilat, debrisoquine, 2,2'Hexadecamethylenediisoquinolinium dichloride, N-laurylisoquinolinium bromide, narcéine, hydrastine, berbérine
- Les alcaloïdes de l'opium :
- Naturels : Morphine, Codéine, Thébaïne, Papavérine, Narcotine, Noscapine
- Semi-synthetiques : Hydromorphone, Hydrocodone, héroïne,
- Synthétiques : Fentanyl, Pethidine, Methadone, Propoxyphène
- Les alcaloïdes de l'opium :
- Groupe des Phényléthylamines (ce ne sont pas des alcaloïdes au sens propre, même si régulièrement classés comme tels) : MDMA, méthamphétamine, mescaline, éphédrine
- Groupe des Indoles :
- Tryptamines : DMT, NMT (monométhyltryptamine), psilocybine, sérotonine
- Ergolines : Les alcaloïdes de l'ergot de seigle (ergométrine, ergotamine, ergosine, ergovaline, ergokryptine, ergocornine, ergocristine, acide lysergique, etc.), ergine, LSD ...
- Bêta-carbolines : harmine, yohimbine, réserpine, émétine
- Groupe des Purines :
- Groupe des Terpénoïdes :
- Les alcaloïdes de l'aconit napel : aconitine
- Solanidine, Solasodine, Batrachotoxine, Delphinine
- Stéroïdes : solanine, samandarin
- Groupe des Bétaïnes (composés d'ammonium quaternaire, ce ne sont pas des alcaloïdes au sens propre, même si régulièrement classés comme tels) : muscarine, choline, neurine.
- Groupes des Pyrazoles
Classification biogénétique
Les alcaloïdes peuvent être classés en fonction de leur précurseur avant leur synthèse dans une voie biologique. On distingue alors trois grandes classes[3]selon qu'ils possèdent ou non un acide aminé comme précurseur direct, et qu'ils comportent ou non un atome d'azote dans un hétérocycle.
Dérivé d'acide aminé Hétérocycle azoté Alcaloïdes vrais oui oui Proto-alcaloïdes oui non Pseudo-alcaloïdes non Les alcaloïdes vrais dérivent d'acides aminés et comportent un atome d'azote dans un système hétérocyclique. Ce sont des substances douées d'une grande activité biologique, même à faibles doses. Ils apparaissent dans les plantes, soit sous forme libre, soit sous forme d'un sel, soit comme N-oxide.
Les proto-alcaloïdes sont des amines simples, dont l'azote n'est pas inclus dans un hétérocycle. Ils dérivent aussi d'acides aminés.
Les pseudo-alcaloïdes ne sont pas dérivés d'acides aminés. Ils peuvent cependant être indirectement liés à la voie des acides aminés par l'intermédiaire d'un de leurs précurseurs, ou d'un de leurs postcurseurs (dérivés). Ils peuvent aussi résulter d'amination, ou de réaction de transamination dans une voie connectée avec les précurseurs ou les postcurseurs d'acides aminés.
Tadeusz Aniszewski[3] propose la classification suivante, basée sur les précurseurs dans la voie biologique de synthèse.
ALCALOIDES VRAIS Précurseur Groupe d'alcaloïdes Noyau caractéristique Exemples L-ornithine 
Alcaloïdes pyrrolidiniques Pyrrolidine 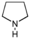
Cuscohygrine, Hygrine Alcaloïdes tropaniques Tropane 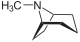
Atropine, Cocaïne, Hyoscyamine, Scopolamine Alcaloïdes pyrrolizidiniques Pyrrolizidine 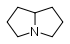
Acétyl-lycopsamine, Europine, Homospermidine,
Ilamine, Mételoidine, RétronécineL-lysine 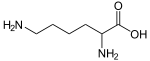
Alcaloïdes pipéridiniques Pipéridine 
Anaférine, conine, Lobélanine, Lobéline,
Pelletiérine,Pipéridine, Pipérine, SédamineAlcaloïdes quinolizidiniques Quinolizidine 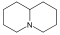
Cytisine, Lupinine, Spartéine Alcaloïdes indolizidiniques Indolizidine 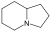
Castanospermine, Swansonine L-tyrosine 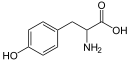
Alcaloïdes phényléthylaminés Phényléthylamine 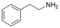
Adrénaline, Anhalamine, Dopamine, Noradrénaline Alcaloïdes tétrahydroisoquinoliniques
simplesBenzyltétrahydroisoquinoline Codéine, Morphine, Norcoclaurine, Papavérine,
Tétrandine, Thébaïne, TubocurarineL-tyrosine ou L-phénylalanine Alcaloïdes phényléthylisoquinoliniques Alcaloïdes des Amaryllidacées Crinine, Floramultine, Galantamine, Lycorine L-tryptophane
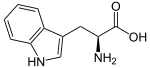
Alcaloïdes indoliques Indole 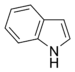
- Arundacine, Psilocine, Sérotonine, Tryptamine, Zolmitriptan
- Elaeagnine, Harmine
- Ajmalicine, Catharantine, TabersonineAlcaloïdes quinoléiniques Quinoléine 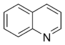
Chloroquinine, Cinchonidine, Quinine, Quinidine Alcaloïdes pyrroloindoliques Indole A-yohimbine, Chimonanthéine, Corynanthéidine Alcaloïdes de l'ergot de seigle Ergoline 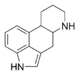
Ergotamine, Ergokryptine L-histidine 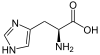
Alcaloïdes imidazoliques Imidazole 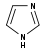
Histamine, Pilocarpine, Pilosine Alcaloïdes manzaminiques Xestomanzamine Xestomanzamine A et B L-arginine 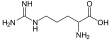
Alcaloïdes marins β-carboline 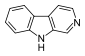
Saxitoxine, Tétrodotoxine Acide anthranilique 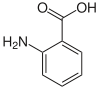
Alcaloïdes quinazoliniques Quinazoline Péganine Alcaloïdes quinoléiniques Quinoléine 
Acutine, Bucharine, Dictamine, Foliodine,
Perforine, SkimmianineAlcaloïdes acridoniques Acridine 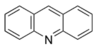
Acronycine, Rutacridone Acide nicotinique 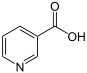
Alcaloïdes pyridiniques Pyridine 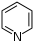
Pyrrolidine
Anabasine, Cassinine, Evoline, Nicotine, Wilforine Les proto-alcaloïdes sont des composés dans lesquels l'atome d'azote N dérivé d'un acide aminé ne fait pas partie d'un hétérocycle.
PROTO-ALCALOIDES Précurseur Groupe d'alcaloïdes Noyau caractéristique Exemples L-tyrosine

Alcaloïdes phényléthylaminés Phényléthylamine
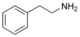
hordenine,
mescaline :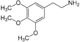
L-tryptophane
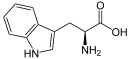
Alcaloïdes indoloterpéniques Indole 
yohimbine L-ornithine

Alcaloïdes pyrrolizidiniques Pyrrolizidine 
4-hydroxy-stachydrine, stachydrine
Les pseudo-alcaloïdes sont des composés dont le squelette carboné de base ne dérive pas d'acides aminés.
PSEUDO-ALCALOIDES Précurseur Groupe d'alcaloïdes Noyau caractéristique Exemples acétate 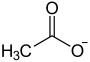
Alcaloïdes pipéridiniques pipéridine 
coniine, conicéine, pinidine Alcaloïdes sesquiterpéniques sesquiterpène cassinine, évonine,
maymyrsine, wilforineacide pyruvique 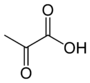
Alcaloïdes de l'Ephédra phényle C cathine, cathinone,
éphédrine, noréphédrineacide férulique 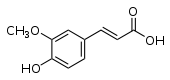
Alcaloïdes aromatiques phényle 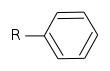
capsaicine géraniol 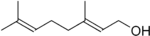
Alcaloïdes terpéniques terpénoïdes aconine, aconitine, méthyllycaconitine,
actinidine, atisine, gentianinesaponines Alcaloïdes stéroïdiques cholestane, conessine, jervine,
etioline, pregnenolone, soladinineRéférences
- Bruneton, J., Pharmacognosie - Phytochimie, plantes médicinales, 4e éd., revue et augmentée, Paris, Tec & Doc - Éditions médicales internationales, 2009, 1288 p. (ISBN 978-2-7430-1188-8)
- (en) Paul Bernard Foley, Beans, roots, and leaves : a history of the chemical therapy of Parkinsonism, Tectum Verlag, 2003
- (en) Tadeusz Aniszewski, Alkaloids - Secrets of Life, Alkaloid Chemistry, Biological significance, Applications and Ecological Role, Elsevier, 2007
Voir aussi
Wikimedia Foundation. 2010.
