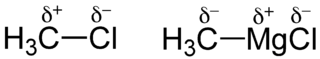- Polarité (chimie)
-
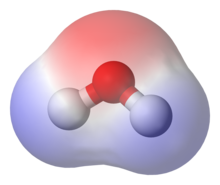 Un exemple courant de composé polaire est l'eau (H2O). Les électrons des atomes d'hydrogène de l'eau sont fortement attirés par l'atome d'oxygène et sont en réalité plus proche du noyau de l'oxygène que de ceux de l'hydrogène. C'est pourquoi l'eau a une charge négative en son centre (teinte rouge) et une charge positive à ses extrémités (teinte bleue).
Un exemple courant de composé polaire est l'eau (H2O). Les électrons des atomes d'hydrogène de l'eau sont fortement attirés par l'atome d'oxygène et sont en réalité plus proche du noyau de l'oxygène que de ceux de l'hydrogène. C'est pourquoi l'eau a une charge négative en son centre (teinte rouge) et une charge positive à ses extrémités (teinte bleue).
En chimie, la polarité est une caractéristique décrivant la répartition des charges négatives et positives dans un dipôle. La polarité d'une liaison ou d'une molécule est due à la différence d'électronégativité entre les éléments chimiques qui la composent, des différences de charge qu'elle induit, et à leur répartition dans l'espace. Plus les charges sont réparties de façon asymétrique, plus une liaison ou molécule sera polaire, et a contrario, si les charges sont réparties de façon totalement symétrique, elle sera apolaire, c'est-à-dire non polaire.
La polarité et ses conséquences (forces de van der Waals, liaison hydrogène) influent sur un certain nombre de caractéristiques physiques (tension superficielle, températures de fusion et d'ébullition, solubilité) ou chimiques (réactivité).
Sommaire
Théorie
Polarité d'une liaison
Dans une liaison, le doublet électronique peut ne pas être partagé équitablement entre les deux atomes : l'un des deux atomes peut avoir une force d'attraction sur le nuage électronique plus grande que l'autre. On appelle électronégativité cette capacité pour les atomes à attirer le nuage électronique. Ce partage inéquitable de la charge électronique transforme alors le couple atomique en dipôle. Tout se passe alors comme s'il y avait un transfert électronique partiel de l'atome le moins électronégatif vers l'atome le plus électronégatif. On introduit ce transfert fictif par des charges partielles : à l'atome le plus électronégatif qui attire à lui le doublet électronique, sera attribué une charge partielle négative, notée -δe (δ-), à l'autre une charge partielle positive, notée +δe (δ+) (cette notation a été introduite en 1926 par Christopher Ingold et sa femme[1]). La liaison covalente prend alors un caractère ionique partiel.
En fonction de la différence d'électronégativité entre les atomes, la liaison interatomique varie entre deux extrêmes :
- lorsque la différence d'électronégativité est très faible[2], voire nulle, les charges partielles sont nulles (δe=0) et la liaison est complètement apolaire : le doublet électronique est réparti équitablement entre les atomes ;
- lorsqu'au contraire la différence d'électronégativité est très grande[3], les charges partielles deviennent formelles (δe=1), la liaison perd alors de son caractère covalent pour tendre vers une liaison ionique pure : les atomes ne partagent plus un doublet, mais s'ionisent pour prendre une configuration de gaz rare, le moins électronégatif cédant un ou plusieurs électrons au plus électronégatif.
Entre ces deux extrêmes (différence d'électronégativité entre 0,4 et 1,7 en échelle de Pauling), la liaison est qualifiée de covalente polaire.
Polarité d'une molécule
Une molécule est un assemblage chimique constitué d'une ou plusieurs liaisons covalentes résultant de la combinaison des orbitales atomiques des atomes qui la composent. Dans cette molécule, en fonction de la nature et donc de l'électronégativité des atomes qui la composent, peuvent apparaitre des charges partielles. La répartition de ces charges dans l'espace donne son caractère polaire ou non à la molécule.
- Si le barycentre des charges positives et celui des charges négatives coïncident, la répartition des charges est symétrique dans la molécule et celle-ci est qualifiée d'apolaire.
- En revanche, si les deux barycentres ne coïncident pas, il y a dans la molécule deux pôles distincts, de charges opposées. La séparation de ces pôles induit un moment dipolaire
 , dans la molécule, dont la norme est le produit de la distance entre les pôles par la charge. Plus la valeur du moment dipolaire est grande, plus la molécule est polaire.
, dans la molécule, dont la norme est le produit de la distance entre les pôles par la charge. Plus la valeur du moment dipolaire est grande, plus la molécule est polaire.
Notes et références
- (en) The Origin of the "Delta" Symbol for Fractional Charges Jensen, William B. J. Chem. Educ. 2009, 86, 545. Lien
- on donne typiquement le chiffre de 0,4 en échelle de Pauling comme borne
- on donne typiquement le chiffre de 1,7 en échelle de Pauling comme borne
Voir aussi
Catégories :- Propriété chimique
- Biophysique
Wikimedia Foundation. 2010.