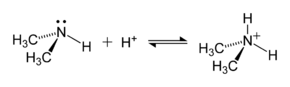- Ammonium
-
Ion ammonium 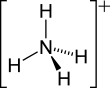
Représentation de l'ion ammonium Général No CAS PubChem SMILES InChI Propriétés chimiques Formule brute NH4+ Masse molaire[2] 18,0385 ± 0,0005 g·mol-1
H 22,35 %, N 77,65 %,pKa 9,25 à 25 °C [1] Unités du SI & CNTP, sauf indication contraire. L'ion ammonium (de formule NH4+) est un ion polyatomique de charge électrique positive (c'est donc plus précisément un cation polyatomique).
Il est obtenu par protonation de l'ammoniac (NH3) ; il est parfois présenté comme une molécule d'ammoniac ionisée.
Il est présent dans de nombreux produits nettoyants et désinfectants.
Sommaire
Cas des solutions aqueuses
La mise en solution de NH4+ dans l'eau correspond à l'équation suivante :
 .
.
Alors que la préparation d'une solution aqueuse d'hydroxyde d'ammonium (ammoniaque) est :
 .
.
Ce sont des réactions acido-basiques, d'où le couple acide/base suivant : NH4 + / NH3.
Ce couple a une constante d'acidité Ka = 6,3.10-10.
On dit donc que la constante de dissociation acide de NH4+ pKa = 9,25.
Dans l'eau, l'ammoniac se dissocie partiellement et forme une solution ionique qui conduit l'électricité.Cas général
Dans le cas général, on a :
 .
.
Il s'agit d'une réaction réversible, qui forme l'acide très faible de Brönsted ammonium.
Le taux d'ammonium formé dépend du pH si on travaille en solution.
Si on travaille avec de la vapeur d'ammoniac, elle peut réagir avec HCl pour former le complexe .
.L'ammonium forme souvent un sel avec un anion. La plupart des sels d'ammonium sont solubles dans l'eau.
Liens avec les amines
Chaque atome d'hydrogène de l'ion ammonium peut être remplacé « substitué » par un groupe alkyle ou par un autre groupe organique constitué de chaînes carbonées ou d'autres substituants pour former un ion dit ammonium substitué, « ion amminium » ou ions ammonium « primaire », « secondaire », « tertiaire » ou « quaternaire » (selon le nombre d'atomes d'hydrogène substitués).
Ces ions sont les acides conjugués d'amines, sauf pour les ammoniums quaternaires qui ne peuvent pas céder de proton. Hormis l'ammonium quaternaire, ils existent en équilibre avec leurs amines remplacées, selon le pH.La formule est de type N+R4, où un ou plusieurs atomes d'hydrogène sont remplacés par un radical organique (groupe représenté par le symbole R).
Un exemple d'une réaction de formation d'un ion ammonium est celle entre la diméthylamine, (CH3)2 NH, et un acide, pour donner le cation diméthylammonium, (CH4)2 NH2+ :
Le cation ammonium quaternaire présente quatre groupes organiques liés à l'atome d'azote.
Ils n'ont plus d'atome d'hydrogène lié à l'atome d'azote pouvant jouer le rôle de base, et sont donc chargés de manière permanente.
Ces cations, tels que le cation tétra-n-butylammonium, sont parfois utilisés pour remplacer les ions de sodium ou de potassium pour augmenter la solubilité d'un composé dans l'ensemble des solvants organiques, selon le principe HSAB. Pour la même raison, ils sont aussi utilisés comme catalyseurs de transfert de phase.L'ammonium quaternaire ne devrait pas être utilisé en piscine car pouvant se recombiner avec le chlore (formation de NCl3).
Couples Acide-Base
En résumé, les principaux couples Acide-Base sont :
Couple acide-base Acide Base ion ammonium / ammoniac NH4+ NH3 ion méthylammonium / méthylamine CH3NH3+ CH3NH2 ion diméthylammonium / diméthylamine (CH3)2NH2+ (CH3)2NH ion triméthylammonium / triméthylamine (CH3)3NH+ (CH3)3N ion ammonium substitué / amine substitué N+R4 NR3 Demi-équation Acide-Base
Le couple Acide-Base concerné est :
- ion ammonium substitué / amine substituée ;
- N+R3H/NR3.
La demi-équation Acide-Base est donc :
- N+R3H
 H+ + NR3.
H+ + NR3.
Équation Acide/Base de solvatation
Les demi-équations Acide-Base sont :
- (CH3)nNH4-n+
 H+ + (CH3)nNH3-n
H+ + (CH3)nNH3-n - H2O + H+
 H3O+.
H3O+.
L'équation Acide-Base de dilution est donc :
- (CH3)nNH4-n+ + H2O
 H3O+ + (CH3)nNH3-n.
H3O+ + (CH3)nNH3-n.
Plus simplement :
- N+R4
 H+ + NR3
H+ + NR3 - H2O + H+
 H3O+.
H3O+.
D'où l'équation Acide-Base de solvatation :
- N+R4 + H2O
 H3O+ + NR3.
H3O+ + NR3.
Chimie
 Fumée blanche (chlorure d'ammonium, toxique) produite par la réaction dans l'air d'acide chlorhydrique et d'ammoniac
Fumée blanche (chlorure d'ammonium, toxique) produite par la réaction dans l'air d'acide chlorhydrique et d'ammoniac
L'ion ammonium est généré par la réaction de l'ammoniaque (une base faible) avec un acide de Brønsted (donneurs de protons) :
- H+ + :NH3 → NH4+.
La paire libre d'électrons de l'atome d'azote (N) dans l'ammoniac est représentée comme une paire de points. Cette paire d'électrons forme la liaison avec un proton (H+).
L'ion ammonium est un acide conjugué relativement fort, qui réagit avec les bases de Brønsted pour revenir à l'état de molécule d'ammoniac non chargé :
- NH4+ + :B → HB+ + NH3.
Lorsque l'ammoniac est dissous dans de l'eau, une quantité importante de celui-ci réagit avec l'ion hydronium de l'eau pour donner des ions ammonium :
- H3O+ + NH3 → H2O + NH4+.
Le taux d'ammoniac converti en ion ammonium dépend du pH de la solution. Si le pH est bas (c'est-à-dire il y a une forte concentration en ions hydronium), les changements s'équilibrent en produisant une plus grande conversion d'ammoniac (par protonation) en ions ammonium. Si au contraire le pH est élevé (la concentration en ions hydronium est faible), l'équilibre est obtenu avec captage de protons de l'ion ammonium par les ions hydroxyde, générant de l'ammoniac.
La formation de composés d'ammonium peut également se produire en phase vapeur, par exemple, lorsque la vapeur d'ammoniac entre en contact avec la vapeur de chlorure d'hydrogène (HCl) un nuage blanc de forme de chlorure d'ammonium qui se déposera éventuellement en une fine couche blanche sur les surfaces.
Les cations ammonium ressemblent à des ions de métal alcalin tels que ceux du sodium, Na+, ou du potassium, K+, et peuvent être trouvés dans des sels comme le bicarbonate d'ammonium, chlorure d'ammonium ou nitrate d'ammonium.
La plupart des sels d'ammonium simples sont très solubles dans l'eau.
Ces ions ammoniums ont une grande importance en chimie car :
- ils sont des porteurs de charges positives à l'intérieur de molécules organiques et sont utiles dans des applications comme les résines échangeuses d'ions ;
- le sulfate d'ammonium est un des engrais chimiques qui ont permis l'agriculture industrielle ;
- les ions ammonium peuvent se dissoudre dans le mercure pour former un amalgame. En pratique, on peut en fabriquer par l'électrolyse d'une solution d'ammonium avec une électrode de mercure[3]. Mais cet amalgame se décompose spontanément pour donner de l'ammoniac et de l'hydrogène[4].
Liaisons
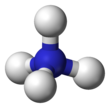
Dans l'ion ammonium, l'atome d'azote forme quatre liaisons covalentes (dont une liaison covalente de coordination), au lieu de trois comme dans l'ammoniaque, formant une structure qui est isoélectronique (électroniquement semblable) à celle d'une molécule de méthane.
Voir aussi
Articles connexes
Bibliographie
Liens externes
Notes et références
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, CRC Press, 2009, 90e éd., relié, 2804 p. (ISBN 978-1-420-09084-0)
- Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
- (en) Pseudo-binary compounds
- (en) VIAS Encyclopedia: Ammonium Salts
Wikimedia Foundation. 2010.