- Glucose
-
Glucose 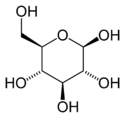
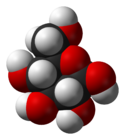
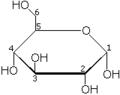
β-D-glucopyranose : représentations hexagonale et 3D
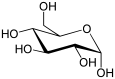
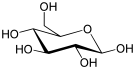
α-D-glucopyranose et β-D-glucopyranose

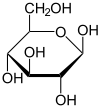
Projection de Fischer et projection de HaworthGénéral Nom IUPAC D-Glucose et β-D-Glucopyranose Synonymes (2R,3S,4R,5R)-2,3,4,5,6-pentahydroxyhexanal et forme cyclique : (2R,3R,4S,5R,6R)-6-(hydroxyméthyl)oxane-2,3,4,5-tétrol
D-Glc et β-D-Glcp
Dextrose
CereloseNo CAS (DL-Glucose)
(D(+)-Glucose)
(L-Glc)
(α-D-Glucopyranose)
(β-D-Glucopyranose)
(α-D-Glucofuranose)
(β-D-Glucofuranose)
(α/β-L-Glcp)No EINECS (D-Glc)
(L-Glc)
(D-Glc)PubChem (D-Glc)
(α/β-D-Glcp)
(α-D-Glcp)SMILES InChI Apparence poudre blanche au goût sucré[1]. Propriétés chimiques Formule brute C6H12O6 [Isomères] Masse molaire[2] 180,1559 ± 0,0074 g·mol-1
C 40 %, H 6,71 %, O 53,29 %,Propriétés physiques T° fusion 146 °C (α,D), 150 °C (β,D) Solubilité Dans l'eau : 900 g·l-1[3]. Masse volumique 1,544 g·ml-1 (25 °C)[4] Thermochimie ΔfH0solide -1273,3 kJ.mol-1 Précautions SIMDUT[5] Produit non contrôlé Inhalation Toux. Yeux Rougeur. Écotoxicologie LogP -3,3[1] Unités du SI & CNTP, sauf indication contraire. Le glucose est un aldohexose, principal représentant des oses (sucres). Par convention, il est symbolisé par Glc. Il est directement assimilable par l'organisme.
Il se présente sous forme d'une poudre blanche, d'une saveur sucrée caramélisant à partir de 150 °C. Il est soluble dans l'eau, l'éthanol et la pyridine mais insoluble dans l'éther diéthylique et les solvants organiques.
Sommaire
Étymologie
En 1838, un comité de l'Académie des sciences décide d'appeler le sucre se trouvant dans le raisin, dans l'amidon, et dans le miel du nom de glucose, en fournissant comme étymologie le grec gleukos, vin doux. Émile Littré, ayant donné une autre étymologie, l'adjectif glukus (de saveur douce), avec deux upsilons (i grecs), le préfixe habituel est devenu glyc, comme dans glycémie, glycogène etc.
Structure
Le glucose (synonyme dextrose lorsqu'il s'agit de D-glucose) est un ose simple et plus particulièrement un aldohexose. C'est un isomère d'autres sucres, en particulier le mannose ou le fructose, de formule C6H12O6.
-
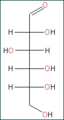
Figure 1 : D-glucose en projection de Fischer
Sa formule développée est présentée à la figure 1. Puisqu'il contient une fonction aldéhyde, il s'agit d'un glucide réducteur. Le glucose est une molécule polaire (grâce à ses groupements alcools), c'est pourquoi il est soluble dans l'eau. Il est thermodégradable et dialysable (voir dialyse).
Le glucose cristallise sous forme pyranique. Il est appelé glucopyranose (figure 2 et 3).
Hétérosides
Le glucose est souvent présent dans la nature sous forme de composés, liés à d'autres molécules qui ne sont pas des sucres. On appelle ces composés glucosides, composés faisant partie des hétérosides.
Métabolisme
Contrairement au saccharose, il est directement assimilable par l'organisme, dont c'est un carburant essentiel, notamment pour le cerveau. L'énergie contenue dans une mole de glucose est de 2 871 kJ (ou 685,2 kcal, 1 cal = 4,19 J).
Les nouvelles techniques d'imagerie médicale permettent une appréciation de la topologie du métabolisme cellulaire. En tomographie par émission de positons, on utilise pour cela un composé dérivé du glucose : le fluorodésoxyglucose (18F), ou 18F-FDG qui, du point de vue structural, est suffisamment proche du glucose pour être capté par les cellules mais inutilisable dans leurs métabolismes. Ce composé étant radioactif, les rayonnements émis sont alors captés et, suivant leur répartition dans l'organisme, produisent une image d'hyperfixation dans les lieux de haut métabolisme (par exemple : le cerveau, le cœur, les tumeurs...).
Pouvoir sucrant
Le glucose a un faible pouvoir sucrant, de 0,70 à 0,75. En comparaison, celui du saccharose vaut 1 (par convention), le glucose est donc bien moins utilisé que ce dernier dans l'industrie alimentaire pour ses qualités organoleptiques. Il est plutôt utilisé en tant qu'agent de charge (sous forme cristalline monohydratée ou de sirop concentré) et est également présent dans les sirops de glucose et de glucose-fructose. Il est aussi ajouté dans certains produits que l'on trouve sur le marché (par exemple dans le dextro energy). Le glucose (dextrose) est utilisé dans l'industrie alimentaire pour son pouvoir antioxydant (conservateur donc).
Propriétés optiques
Tautomères du D-Glucose Forme linéaire Projection de Haworth 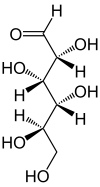
0,5 %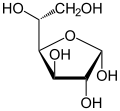
α-D-Glucofuranose
<0,5%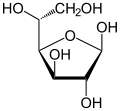
β-D-Glucofuranose
<0,5%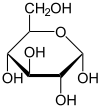
α-D-Glucopyranose
35 %
β-D-Glucopyranose
65 %Comme tous les oses, le glucose possède des carbones asymétriques. Ils sont au nombre de 4 (carbones numéros 2, 3, 4 et 5)[6] et lui confèrent un pouvoir rotatoire (le glucose est dit optiquement actif), c'est-à-dire qu'il est capable de dévier le plan d'une lumière polarisée incidente. Le stéréo-isomère naturel du glucose est le D-Glucose (voir chiralité).
Les solutions pures de α-D-glucopyrannose et de β-D-glucopyrannose ont respectivement un pouvoir rotatoire de 112,2 ° et de 18,7 ° (en solution dans l'eau à 20 °C). Toutefois ces solutions ne sont pas stables et un équilibre tautomère se fait rapidement avec la composition suivante :
- 35 % d'α-D-glucopyranose
- 65 % de β-D-glucopyranose
- 0,5 % de D-glucose linéaire
Le pouvoir rotatoire vaut dès lors 52,7 °. Ce dernier étant positif, le D-glucose est dextrogyre.
Propriétés chimiques
Cristallisation
Les solutions concentrées de glucose ( > 30% ) cristallisent spontanément à température ambiante. Le glucose sous forme cristalline, est vendu sous l'appellation de "dextrose" pour éviter toute confusion avec les sirops de glucose, et se trouve sous forme monohydratée. Les solutions de dextrose sont produites industriellement par une hydrolyse totale d'empois d'amidon. L'hydrolyse est réalisée à chaud par des systèmes enzymatiques combinant alpha et bêta amylases.
Réactions en milieu acide
En présence d'un acide dilué, le glucose ne réagit pas, c'est un ose, il n'est pas hydrolysable.
En milieu acide concentré et chaud, le glucose subit une déshydratation et condensation avec l'α-naphtol (réactif de Molisch), ce qui le colore. Le glucose se cristallise.
En milieu alcalin
L'ammoniaque accélère la mutarotation.
En présence de soude diluée, il y a formation d'un ènediol (instable) qui produit (figure 5) :
 Figure 5 : réaction d'isomérisation/épimérisation du glucose.
Figure 5 : réaction d'isomérisation/épimérisation du glucose.En milieu basique concentré, le glucose est oxydé. Ces réactions sont complexes et non stoechiométriques (dosage par la méthode de Bertrand).
Propriétés de la fonction aldéhyde
- La réduction du glucose donne du sorbitol ;
- L'oxydation du glucose donne de l'acide gluconique.
Le glucose est un glucide réducteur, il est capable de réduire
- les ions métalliques :
- L'ion mercure II (réaction de Baudoin-Lewin) : Hg2+ + Glc → Hg + produits d'oxydation ;
- L'ion fer III (réaction d'Hagedorn-Jensen) : Fe3+ + Glc → Fe2+ + produits d'oxydation ;
- L'ion argent (réaction de Tollens) : Ag+ + Glc → Ag + produits d'oxydation ;
- L'ion cuivre II (réaction de Fehling) : Cu2+ + Glc → Cu2O + produits d'oxydation.
- Les composés organiques :
- le 3,5-dinitrosalicylate (composé jaune) est réduit en 3-amino-5-nitrosalicylate (composé rouge) permet le dosage du glucose et des autres glucides réducteurs.
La réaction de Fehling est utilisée dans la méthode de Bertrand. Le précipité d'oxyde de cuivre II est redissous puis dosé.
Propriétés de la fonction alcool primaire
Cette fonction est portée par le carbone 6, son oxydation donne de l'acide glucuronique si la fonction aldéhyde a été protégée en la combinant à autre chose.
L'acide nitrique à chaud oxyde les deux fonctions terminales du glucose des carbones 1 et 6 et forme un acide aldarique (diacide carboxylique) : l'acide glucarique.
Dosages du glucose
Polarimétrie
Le glucose ayant un pouvoir rotatoire, il peut être dosé par polarimétrie. Le pouvoir rotatoire d'une solution est proportionnel à la concentration en glucose. Cette méthode est utilisée en médecine, les diabétiques contrôlent leur glycémie par cette méthode.
Réfractométrie
Cette méthode consiste à mesurer l'indice de réfraction d'une solution aqueuse sucrée à l'aide d'un réfractomètre, sachant que l'indice de la solution dépend de la concentration en sucre. Cette méthode est utilisée en viticulture pour mesurer le taux de sucre du jus de raisin.
Dosage par la glucose oxydase
Cette méthode enzymatique utilise une enzyme (figure 6) : la glucose oxydase (extraite d'Aspergillus niger). Le glucose est oxydé par le dioxygène de l'air en gluconolactone (puis en acide gluconique) avec production d'eau oxygénée. C'est cette dernière qui sera en fait dosée par colorimétrie. En présence d'une peroxydase, elle oxyde un chromogène réduit dont l'absorbance est mesurée avec un spectrophotomètre. Le chromogène pourrait être du phénol et de la 4-aminophénazone oxydé en quinone-imine. Dans d'autres techniques, l'eau oxygénée est oxydée au niveau d'une électrode (le courant produit est proportionnel à la concentration de glucose).
 Figure 6 : dosage du glucose par la glucose oxydase.
Figure 6 : dosage du glucose par la glucose oxydase.Cette méthode est utilisée en biochimie médicale pour mesurer la glycémie sur plasma.
Citation
« C'est une belle structure en anneau, un hexagone presque régulier, qui est cependant soumis à des échanges et équilibres difficiles avec l'eau dans laquelle il est dissous (...) Et si quelqu'un voulait vraiment demander : pourquoi un anneau et pourquoi soluble dans l'eau, eh bien, qu'il se tranquillise, ce sont là de ces questions, pas très nombreuses, auxquelles notre science est capable de répondre. » Primo Levi, Le système périodique, 1975.
Notes et références
- DEXTROSE, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
- http://www.jtbaker.com/msds/englishhtml/d0835.htm
- (en) J. G. Speight, Norbert Adolph Lange, Lange's handbook of chemistry, McGraw-Hill, 2005, 16e éd., 1623 p. (ISBN 0-07-143220-5), p. 2.289
- « Dextrose » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 24 avril 2009
- (en) Peter M. Collins, Dictionary of carbohydrates, CRC Press, 2005, 1282 p. (ISBN 0-8493-3829-8)
Voir aussi
Articles connexes
Liens externes
- Fiches internationales de sécurité chimique : DEXTROSE (ICSC: 0865)
- (en) COMPOUND: C00031 Database www.genome.ad.jp
- Portail de la biochimie
- Portail de la chimie
- Portail de l’alimentation et de la gastronomie
-
Wikimedia Foundation. 2010.