- Solubilite
-
Solubilité
La solubilité d'un composé ionique ou moléculaire, appelé soluté, est la concentration maximale (en moles par litre) de ce composé que l'on peut dissoudre ou dissocier dans un solvant, à une température donnée. La solution ainsi obtenue est alors saturée.
Le solvant le plus courant est l'eau. Le soluté peut être un gaz (exemple: air dans l'eau), un liquide (exemple: alcool dans l'eau) ou un solide (exemple: sel de cuisine NaCl dans l'eau). L'eau est l'un des solvants les plus efficaces pour dissoudre les composés ioniques ou polaires.
La dissolution simple d'un composé est endothermique: par exemple la dissolution de sucre (solide moléculaire) dans l'eau. Cependant, lorsque d'autres réactions interviennent lors de la dissolution, le phénomène global peut être exothermique: exemple la dissolution dans l'eau de l'acide sulfurique H2SO4 est très exothermique à cause de la solvatation des ions obtenus H3O+ et SO42–.
Dans le cas d'un composé solide ionique, la constante d'équilibre de la réaction de dissolution est appelée produit de solubilité et est notée Ks(T). Elle ne dépend que de la température T et en général elle augmente avec celle-ci. La solubilité S est fonction de ce produit de solubilité et varie dans le même sens.
Sommaire
Expression du produit de solubilité
Considérons la réaction suivante :
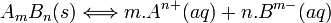
Le produit de solubilité Ks est donné par la relation : Ks = [a(An+)]m x [a(Bm–)]n
Les expressions a(An+) et a(Bm–) correspondent aux activités des espèces ioniques. Aux faibles concentrations on peut confondre activité et concentration. Plus le Ks est faible, plus le produit est insoluble.
Relation entre produit de solubilité et solubilité
Considérons la réaction suivante :
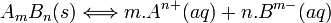
Avec :
Evolution des concentrations Temps AmBn mAn+ nBm- t = 0 c 0 0 t en cours c - s m.s n.s On a donc :
Ks = [a(An+)]m x [a(Bm–)]n = (m.s)m x (n.s)n = mm x nn x sn x sm
D'où :
La solubilité s d'une solution s'exprime par : s = ( Ks / (nn x mm) ) 1/(n+m)
Paramètres influençant la solubilité
En général :
- La polarité ainsi que la présence de liaisons hydrogène dans la molécule influe sur la dissociation de celle-ci.
- Quand la température de la solution augmente :
- si le soluté est solide, la solubilité augmente;
- si le soluté est gazeux, la solubilité diminue.
- Quand la pression augmente :
- si le soluté est gazeux, la solubilité augmente.
- La solubilité d'un sel est diminuée si un ion de ce sel est déjà présent dans la solution : on appelle cela l'effet d'ion commun.(Exemple : dissolution de KCl dans une solution où sont déjà introduits les ions Cl-).
- Le pH peut aussi influencer la solubilité.
Voir aussi
- Portail de la chimie
Catégories : Propriété chimique | Chimie générale | Solution
Wikimedia Foundation. 2010.
