- Hydrolyse
-
L'hydrolyse d'une substance est sa décomposition par l'eau grâce aux ions H3O+ et HO- provenant de la dissociation de l'eau.
Par exemple, l'hydrolyse du saccharose donne du glucose et du fructose (sucre inverti), ou encore, l'hydrolyse d'un ester donnera un alcool et un acide.
De façon schématique, la réaction est
- R1-COO-R2 + H2O ↔ R2-OH (alcool) + R1-COOH (acide)
La réaction inverse, l'estérification, est plus intéressante d'un point de vue industriel (production d'ester), car l'hydrolyse ne produit que des acides et des alcools.
Pour des substances organiques telles que les protéines, une hydrolyse équivaut à la coupure des liaisons peptidiques entre les différents acides aminés qui les constituent.
Les acides aminés sont coupés par les enzymes. Ainsi en est-il de l'hydrolyse de l’amidon ou amylolyse, utilisée en brasserie.
À titre d'exemple, lors de la cuisson d'une viande, le collagène ne peut se transformer en gélatine qu'en présence d'eau.
Sommaire
Substances hydrolysables
De nombreuses molécules peuvent être hydrolysées. Parmi les fonctions hydrolysables, nous trouvons les esters, les acétals (présents dans les polysaccharides) et les amides (présents dans les protéines).
Taux de conversion d'une hydrolyse
L'hydrolyse d'un ester par de l'eau est une réaction lente et limitée. En effet, il se forme des produits qui sont des acides et des alcools, qui eux-mêmes réagissent ensemble dans le milieu réactionnel pour former à leur tour de l'ester et de l'eau. Le taux de conversion d'une hydrolyse d'ester lors de l'introduction des réactifs en quantités stœchiométriques est de l'ordre de 33 % quand il forme un alcool primaire, 40 % pour un secondaire et 95 % pour un tertiaire. Un excès d'eau déplace logiquement cet équilibre vers la formation de l'alcool.
Hydrolyse basique
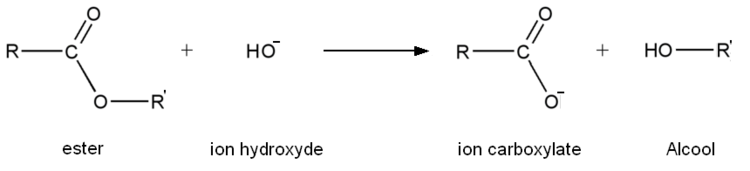
L'hydrolyse basique est, comme son nom l'indique, une réaction d'hydrolyse. Mais, contrairement à une hydrolyse classique, l'eau est remplacée généralement par de la soude ou toute autre solution contenant des ions hydroxyde (comme de l'hydroxyde de potassium par exemple), d'où le nom d'hydrolyse basique car la réaction d'hydrolyse se déroule en milieu basique. L'équation générale d'une réaction d'hydrolyse basique est la suivante :
L'ion carboxylate (contrairement à l'acide carboxylique formé lors d'une hydrolyse classique) est sans effet sur l'alcool de sorte que la réaction inverse d'estérification n'a pas lieu. Par conséquent une transformation d'hydrolyse basique est totale contrairement à une hydrolyse classique. Une hydrolyse basique est rapide à chaud.
Article détaillé : Saponification.Une application de l'hydrolyse basique est la formation de savons. En effet, les réactions de saponification à l'origine des savons ne sont autres que des réactions d'hydrolyse basique à partir de corps gras (qui sont des triesters du glycérol). Les savonettes sont obtenus par précipitation de l'ion carboxylate obtenu lors de la saponification à l'aide de sodium ou de potassium. Les savons sont des carboxylates de sodium ou de potassium.
Voir aussi
Articles connexes
Liens externes
Bibliographie
Notes
Wikimedia Foundation. 2010.