- Cyclohexane
-
cyclohexane 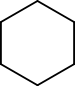
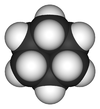
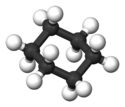
Différentes représentations
d'une molécule de cyclohexane.Général Nom IUPAC cyclohexane No CAS No EINECS DrugBank PubChem ChEBI SMILES InChI Apparence liquide incolore[1]. Propriétés chimiques Formule brute C6H12 [Isomères] Masse molaire[3] 84,1595 ± 0,0056 g·mol-1
C 85,63 %, H 14,37 %,Susceptibilité magnétique χM 68,1×10-6 cm3·mol-1[2] Propriétés physiques T° fusion 6,47 °C [4] T° ébullition 80,75 °C [5] Solubilité dans l'eau : nulle[1],
Sol. dans l'alcool, l'éther, l'acétone;
100 ml de méthanol dissout 57 g à 20 °C[4]
Miscible avec l'huile d'olive;Masse volumique 0,7786 g·cm-3 [6] T° d'auto-inflammation 260 °C[1] Point d’éclair -18 °C (coupelle fermée)[1] Limites d’explosivité dans l’air 1,3–8,4 %vol[1] Pression de vapeur saturante à 20 °C : 12,7 kPa[1] Viscosité dynamique 0,98 mPa·s à 20 °C [4] Point critique 280,3 °C [5], 40,7 bar [8] Vitesse du son 1 280 m·s-1 à 19 °C [9] Thermochimie ΔvapH° 3,6×105 J·kg-1 [4] Cp PCS 3 919,6 kJ·mol-1 [4] Propriétés optiques Indice de réfraction  1,42662 [4]
1,42662 [4]Précautions Directive 67/548/EEC 
Xn
F
NPhrases R : 11, 38, 50/53, 65, 67, Phrases S : 9, 16, 33, 60, 61, 62, Transport 33 1145 NFPA 704 SIMDUT[11] 

SGH[12] 


DangerÉcotoxicologie DL50 930–1 360 mg·kg-1 (rats, oral)[13] LogP 3,44 [4] Seuil de l’odorat bas : 0,52 ppm
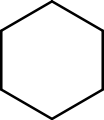
haut : 784 ppm[14]Unités du SI & CNTP, sauf indication contraire. Le cyclohexane est un hydrocarbure cyclique non éthylénique de la famille des (mono)cycloalcanes[15] de formule brute C6H12. Le cyclohexane est utilisé comme solvant apolaire dans l'industrie chimique, mais aussi comme réactif pour la production industrielle de l'acide adipique et du caprolactame, intermédiaires utilisés dans la production du nylon. La formule topologique du cyclohexane est présentée ci-contre.
Sommaire
Historique
- En 1890, Sachse et Mohr découvrent que la 'géométrie' du cyclohexane n'est pas plane et décrivent la conformation ‘chaise’ par ressemblance avec une chaise longue.
- En 1942, en étudiant le cyclohexane à l’état gazeux par diffraction des électrons, Odd Hassel peut établir que la forme la plus fréquente en phase gazeuse est la forme 'chaise'. L’autre forme du cyclohexane, dans laquelle les deux atomes de carbone opposés sont du même côté du plan de la molécule est nommée 'bateau'. Les deux formes se transforment avec facilité réciproquement l’une et l’autre: elles sont en équilibre mutuel. La forme bateau est moins stable.
- En 1943, Hassel montre qu’il existe dans le cyclohexane deux types de liaisons C—H: celles qui sont perpendiculaires au plan moyen de la molécule et celles qui sont parallèles à ce plan; c’est ce que l’on nommera un peu plus tard les liaisons 'axiales' et 'équatoriales'.
Géométrie et conformations
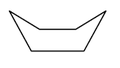
La rotation autour des liaisons C-C permet au cyclohexane d'adopter une infinité de conformations. Quand on représente la molécule de cyclohexane en 3 dimensions, deux conformations peuvent être utilisées : « chaise » et « bateau ».
Le passage d'une conformation chaise à l'autre dite "inversion de conformation chaise" se fait par rotation autour des liaisons carbone-carbone et par torsion. Du point de vue énergétique, les conformations chaises sont les plus stables, en effet à température ambiante plus de 99% des molécules de cyclohexane sont dans cette conformation. Comme le montre la représentation, les liaisons entre l'atome de carbone et l'atome d'hydrogène peuvent être de deux types différents :
- Les liaisons axiales qui sont perpendiculaires au plan moyen du cycle.
- Les liaisons équatoriales qui sont plus ou moins situées dans le plan moyen du cycle soit un peu au-dessus, soit légèrement au-dessous.
L'inversion de conformation chaise transforme une liaison équatoriale en une liaison axiale et réciproquement. Si le cyclohexane est substitué par un groupement méthyle par exemple ce dernier se trouvera en position équatoriale car la position énergétiquement la plus favorable (c'est-à-dire pour laquelle l'énergie potentielle est la plus basse) pour un substituant est la position équatoriale car elle minimise les interactions avec les atomes d'hydrogènes voisins.
Propriétés physico-chimiques
Le cyclohexane est un liquide incolore, mobile, d'odeur relativement agréable, insoluble dans l'eau, soluble dans les solvants saturé cyclique, le cyclohexane est chimiquement assez inerte, à l'image des paraffines. Il se dissocie en butadiène au-dessus de 700 °C.
Utilisation
Pour ses applications industrielles, il est oxydé en mélange de cyclohexanol et de cyclohexanone pour aboutir aux matières premières:
- Nylon-6,6 à partir d'acide adipique et d' hexaméthylène diamine
- Nylon-6 via le caprolactame.
Production et synthèse
Il est possible d'obtenir le cyclohexane par une triple hydrogénation du benzène en présence d'un catalyseur à base de nickel.
Notes et références
- CYCLOHEXANE, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- (en) Hyp J. Dauben, Jr., James D. Wilson et John L. Laity, « Diamagnetic Susceptibility Exaltation in Hydrocarbons », dans Journal of the American Chemical Society, vol. 91, no 8, 9 avril 1968, p. 1991-1998
- Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
- « Cyclohexane » dans la base de données Hazardous Substances Data Bank, consulté le 5 mai 2010
- (en) Iwona Owczarek et Krystyna Blazej, « Recommended Critical Temperatures. Part II. Aromatic and Cyclic Hydrocarbons », dans J. Phys. Chem. Ref. Data, vol. 33, no 2, 30 avril 2004, p. 541 [lien DOI]
- (en) J. G. Speight, Norbert Adolph Lange, Lange's handbook of chemistry, New York, McGraw-Hill, 2005, 16e éd., 1623 p. (ISBN 978-0-07-143220-7) (LCCN 84643191), p. 2.289
- (en) Robert H. Perry et Donald W. Green, Perry's Chemical Engineers' Handbook, USA, McGraw-Hill, 1997, 7e éd., 2400 p. (ISBN 978-0-07-049841-9) (LCCN 96051648), p. 2-50
- Properties of Various Gases sur flexwareinc.com. Consulté le 12 avril 2010
- (en) William M. Haynes, CRC Handbook of Chemistry and Physics, Boca Raton, CRC Press/Taylor and Francis, 1er juillet 2010, 91e éd., 2610 p. (ISBN 9781439820773) [présentation en ligne], p. 14-40
- (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams, vol. 2, Huston, Texas, Gulf Pub. Co., 1996 (ISBN 978-0-88415-858-5) (LCCN 96036328)
- « Cyclohexane » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 24 avril 2009
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- Cyclohexane sur ChemIDplus
- Cyclohexane sur hazmap.nlm.nih.gov. Consulté le 14 novembre 2009
- Chimie organique statique et de la truc universelle, M. Piraux, Office International de Librairie, Bruxelles, ISBN 978-2-87343-001-6, p.35
Voir aussi
Lien externe
- Fiche toxicologique de l'INRS
Catégories :- Produit chimique nocif
- Produit chimique facilement inflammable
- Produit chimique dangereux pour l'environnement
- Cyclohexane
- Solvant
Wikimedia Foundation. 2010.