- Ethanol
-
Éthanol
Éthanol
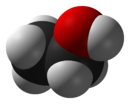
représentations de l'éthanol Général Nom IUPAC Éthanol Synonymes alcool éthylique
EtOHNo CAS No EINECS Code ATC
D08
DrugBank PubChem ChEBI No E E1510 FEMA SMILES InChI Apparence liquide incolore, d'odeur caractéristique.[1] Propriétés chimiques Formule brute C2H6O [Isomères] Masse molaire 46,0684 g∙mol-1
C 52,14 %, H 13,13 %, O 34,73 %,Propriétés physiques T° fusion -117 °C[1] T° ébullition 79 °C[1] Solubilité dans l'eau : miscible[1],
Complète dans les solvants polaires et apolaires (acétone, Éther diéthylique)Masse volumique 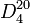 0,789 [2]
0,789 [2]T° d’auto-inflammation 423 à 425 °C;
363 °C (selon les sources)[2]Point d’éclair coupelle fermée :
13 °C pur
17 °C 95% vol.
21 °C 70% vol.
49 °C 10% vol.
62 °C 5% vol.[2]Limites d’explosivité dans l’air Inférieure : 3,5 Vol% Kohn-Birett
Supérieure : 15 Vol% Kohn-BirettPression de vapeur saturante à 20 °C : 5.8 kPa[1] Thermochimie S0liquide, 1 bar 159,86 J/mol·K[3] ΔfH0gaz − 235,3 kJ/mol ΔfH0liquide − 277,0 kJ/mol[4] Précautions Directive 67/548/EEC 
FPhrases R : 11, Phrases S : 2, 7, 16, [5] Transport 33 1170 NFPA 704 SGH[7] 
DangerClassification du CIRC Groupe 1 : Cancérogène pour l'homme[6] Inhalation ébriété, nausée, vomissements Peau aucun effet Yeux dangereux Ingestion ébriété, nausée, vomissements, coma éthylique (pouvant entraîner la mort) Écotoxicologie DL50 5 à 20 g/kg[2] CL50 20 000 à 30 000 ppm pendant 4 à 6 heures[2] LogP -0.32[1] Données pharmacocinétiques Métabolisme au niveau du foie en aldéhyde acétique puis acide acétique, à ~100mg/kg par heure[2] Unités du SI & CNTP, sauf indication contraire. L’éthanol, ou alcool éthylique, est un alcool, possédant la structure semi-développée suivante : CH3-CH2-OH
L’éthanol est usuellement désigné par l’abréviation EtOH.
C’est un liquide incolore, miscible à l'eau en toutes proportions.
On l'appelle souvent simplement « alcool », car l'éthanol est l'alcool qui se retrouve dans toutes les boissons alcoolisées. Dans la pharmacopée européenne, éthanol désigne l’éthanol absolu, c'est-à-dire pur à 100 % (sans eau), en opposition à l'éthanol à 95% ou 70% que l'on trouve en pharmacie. À cela, se rajoute la qualité alcool Ph. Eur. (Pharmacopée Européenne) qui désigne une qualité d'éthanol dont on a quantifié de nombreuses traces et impuretés. La norme Pr Eur autorise un certain pourcentage d'eau (4%). Il est important de noter que l'eau en faible proportion forme un azéotrope avec l'éthanol et qu'au delà de 96% de pureté en EtOH, il devient très difficile de les séparer. Ses synonymes sont esprit de vin, alcool de grain. L'alcoolisme est la consommation excessive de boissons contenant de l'éthanol.
Historiquement, l'éthanol a été produit par fermentation directe de sucres naturels : la production de vin ou de bière fermentée est attestée dans l'empire babylonien dès 3000 av. J.-C. Les premières obtentions pures sont probablement dues aux alchimistes perses qui développèrent l'art de la distillation au VIIIe et IXe siècle siècle de l'ère chrétienne.
On le fabrique aussi industriellement par hydratation de l'éthylène.
L'éthanol est utilisé comme intermédiaire de synthèse dans l'industrie chimique et comme solvant. C'est aussi un désinfectant.
En Amérique du Sud et surtout au Brésil, certaines essences disponibles à la pompe peuvent comporter jusqu'à 20 % d'éthanol et portent le nom d’ethanol blend.
En France, le gouvernement a lancé officiellement fin 2006 l'E85, un mélange de 85 % d'éthanol et de 15 % d'essence comme agrocarburant. Il est disponible dans plusieurs centaines de stations-service depuis la fin de l'année 2007.
Sommaire
Propriétés médicales
L'éthanol absolu est parfois injecté dans des tumeurs afin de provoquer leur nécrose. Il n'a toutefois pas une activité ciblée puisqu'il provoque indifféremment la nécrose des tissus sains et cancéreux.
L'éthanol est aussi utilisé comme antidote dans le cas d'intoxication au méthanol, afin de saturer l'ADH (alcool déshydrogenase)
Production industrielle d'éthanol[8]
Par hydratation catalytique directe de l'éthylène
La synthèse de l'éthanol par hydratation de l'éthylène repose sur la réaction suivante :
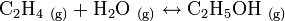
La variation d'enthalpie liée à cette réaction est ΔRH = − 43,4 kJ·mol−1[9]. Pour obtenir un rendement à l'équilibre satisfaisant (usuellement compris entre 7 % et 22 %), cette réaction nécessite d'être catalysée. La majorité des catalyseurs décrits dans la littérature technique présentent un caractère acide. On citera notamment l'acide phosphorique et l'acide silicotungstique. Ces catalyseurs imprègnent généralement un support poreux.
Le produit final de l'hydratation de l'éthylène est un mélange contenant entre 10 % et 25 % d'éthanol en poids. Des distillations successives seront donc nécessaires pour obtenir un mélange plus concentré. Au final, les conditions optimales pour la réalisation de cette réaction d'hydratation dépendent grandement du catalyseur utilisé, des caractéristiques du réacteur et des qualités du produit de départ.
Par hydratation indirecte de l'éthylène
La production d'éthanol par hydratation indirecte de l'éthylène fait intervenir un mécanisme réactionnel plus complexe avec deux grandes étapes : un ensemble de réactions d'estérification puis d'hydrolyse. Ce procédé consomme des grandes quantités d'acide sulfurique et nécessite en entrée un mélange gazeux de bonne qualité.
Production d'éthanol à partir de la biomasse
Dans ce cas, on parle de bioéthanol. La majorité du bioéthanol produit aujourd'hui provient du traitement des plantes sucrières (betterave, canne à sucre, …) ou des céréales (maïs, blé, …). La production de bioéthanol à partir de la biomasse se divise sommairement en 3 étapes.
- L'hydrolyse de la céréale : contrairement aux plantes sucrières qui donnent du sucre directement, il est nécessaire d'hydrolyser l'amidon (polymère du glucose) contenu dans les céréales afin d'obtenir du glucose. Cette hydrolyse peut se faire par des enzymes (hydrolyse enzymatique) ou par de l'acide (hydrolyse acide, nécessite que le mélange soit porté à ébullition).
- La fermentation du glucose : on utilise pour cette étape des levures que l'on insère dans un mélange de sucre et d'eau. La durée de fermentation varie mais tourne aux alentours de quelques semaines. A l'issue de cette étape on obtient un éthanol très dilué, inutilisable pour l'instant.
- La distillation : pour extraire l'éthanol du mélange d'éthanol et d'eau on peut procéder à une distillation fractionnée. Cette distillation s'appuie sur la température d'ébullition de l'éthanol, inférieure à celle de l'eau. Le mélange appelé parfois alcoolat est porté à ébullition, et l'éthanol s'évapore avant que l'eau ne commence à bouillir. En pratique, une certaine proportion d'eau et de produits plus volatiles que l'éthanol entrent dans le liquide obtenu après la première distillation qu'on appelle parfois flegme, la flegmasse étant le résidu de cette distillation. D'autre part, de multiples distillations ne permettent pas d'obtenir un éthanol à plus de 96% car il forme avec l'eau un azéotrope (96%, PE:78,17 °C[10]). Pour obtenir de l'éthanol plus pur, il faut déshydrater l'azéotrope, par exemple en le distillant sur CaO. Si le point azéotropique est dépassé, les distillations sont de nouveau opérationnelles.
D'autres filières existent cependant, notamment la production de bioéthanol (dit bioéthanol cellulosique) à partir de déchets végétaux (sciure de bois, paille de blé, emballages, …). En effet ces produits contiennent de grandes quantités de cellulose, un autre polymère du glucose. Le problème réside dans l'hydrolyse de la cellulose, difficilement réalisée à ce jour. Le procédé le plus élaboré dans ce domaine est actuellement celui développé par l'entreprise canadienne Iogen Corporation.
Economie et prix de la terre
En 2007, il fut révélé que la production et la consommation de l'éthanol au Brésil, l'un des principaux producteur d'éthanol de la planète, faisait radicalement augmenter le prix de la terre et le coût de production du maïs, du lait, du sucre et de la viande. Les producteurs d'éthanol comme Archer Daniels Midland ont suscité les critiques de chercheurs qui craignent une éventuelle famine en raison d'une hausse probable du prix de la nourriture et de la monoculture du sol, ce qui oblige les producteurs à importer les aliments essentiels[11]. En 2008, le Brésil a produit 22,3 milliards de litres d'éthanol, soit 1/3 de la production mondiale [12]. La moitié des champs de canne à sucre au Brésil sont consacré à la production de l'éthanol, dont 85% est consommé sur le marché intérieur, seuls 15% étant exportés [12]. Au Brésil, l'éthanol est utilisé comme biocarburant : le bioéthanol de canne à sucre couvre 22 % des besoins nationaux en carburant.
États-Unis et Brésil produisent à eux seuls 70% de l'éthanol mondial [12].
Notes et références
- ↑ a , b , c , d , e et f ETHANOL (ANHYDRE), fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- ↑ a , b , c , d , e et f Fiche toxicologique FT 48 de l'Institut National de Recherche et de Sécurité (INRS), consultée le 27 Juin 2009
- ↑ Haida, O.; Suga, H.; Seki, S., Calorimetric study of the glassy state. XII. Plural glass-transition phenomena of ethanol, J. Chem. Thermodynam., 1977, 9, 1133-1148.
- ↑ Chao, J.; Rossini, F.D., Heats of combustion, formation, and isomerization of nineteen alkanols, J. Chem. Eng. Data, 1965, 10, 374-379.
- ↑ ESIS. Consulté le 6 décembre 2008
- ↑ IARC Working Group on the Evaluation of Carcinogenic Risks to Humans, « Evaluations Globales de la Cancérogénicité pour l'Homme, Groupe 1 : Cancérogènes pour l'homme » sur http://monographs.iarc.fr, 16 janvier 2009, CIRC. Consulté le 22 août 2009
- ↑ Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- ↑ Une description précise des procédés industrielles de production d'éthanol peut être trouvée dans la référence suivante : Ulmann's Encyclopedia of Industrial Chemistry - Article éthanol ((en)).
- ↑ La méthodologie de détermination de cette valeur peut être trouvée entre autres dans la référence suivante : Chem. Abstr. 58 (1963) 6660g (en).
- ↑ http://pedagogie.ac-montpellier.fr:8080/disciplines/scphysiques/academie/ABCDORGA/Famille/Produit/ethanol.html
- ↑ Au Brésil, la fièvre de l'éthanol fait flamber le prix de la terre, Le Figaro, 21 juin 2007
- ↑ a , b et c Philippe Revelli, « Quand le Brésil joue le « pétrole vert » contre la réforme agraire », Le Monde diplomatique, avril 2009
Voir aussi
Autres alcools :
Usages :
Divers :
Lien externe
- Liste des départements dont les points de vente proposent du Super Ethanol E85 (avec tarifs mis à jour), sur le site du Ministère de l'économie et des finances français
- Portail de la médecine
- Portail de la chimie
- Portail de la pharmacie
Catégories : Produit chimique facilement inflammable | Alcool (chimie) | Tératogène | Produit chimique domestique | Solvant
Wikimedia Foundation. 2010.