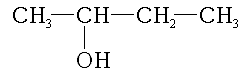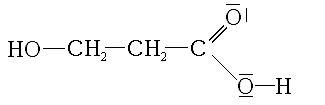- Alcool (Chimie)
-
Alcool (chimie)
 Cet article concerne la famille chimique des alcools. Pour les autres significations du mot, voir Alcool.
Cet article concerne la famille chimique des alcools. Pour les autres significations du mot, voir Alcool.En chimie organique, un alcool est un composé organique dont l'un des carbones (celui ci étant tétragonal) est lié à un groupement hydroxyle (-OH). L'éthanol (ou alcool éthylique) entrant dans la composition des boissons alcoolisées est un cas particulier d'alcool, mais tous les alcools ne sont pas propres à la consommation. En particulier, le méthanol est toxique et mortel à haute dose.
Sommaire
- 1 Utilisation
- 2 Production
- 3 Classification des alcools
- 4 Nomenclature
- 5 Propriétés physico-chimiques
- 6 Réactivité
- 7 Réactions
- 8 Alcools courants
- 9 Toxicité
- 10 Voir aussi
Utilisation
Les alcools sont utilisés dans l'industrie chimique comme:
- solvants : l'éthanol, peu toxique, est utilisé dans les parfums et les médicaments
- combustibles : le méthanol et l'éthanol peuvent remplacer l'essence et le fioul car leur combustion ne produit pas de fumées toxiques
- réactifs : les polyuréthanes, les esters ou les alcènes peuvent être synthétisés à partir des alcools
- antigels : la basse température de solidification de certains alcools comme le méthanol et l'éthylène glycol en font de bons antigels
Production
Les alcools peuvent être produits par fermentation alcoolique, notamment le méthanol à partir du bois et l'éthanol à partir des fruits et des céréales. L'industrie n'y a recours que dans le cas de l'éthanol pour produire du combustible et des boissons. Dans les autres cas, les alcools sont synthétisés à partir des composés organiques tirés du gaz naturel ou du pétrole notamment par hydratation des alcènes.
Classification des alcools
De manière générique, un alcool contient donc la séquence
- R - OH
où R est un radical organique variable, souvent un alkyle.
Selon la nature du carbone portant le groupement alcool, on distingue :
- Les alcools primaires, dont le carbone comportant le groupement hydroxyle est lié à au moins deux atomes d’hydrogène et un radical organique R :
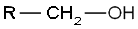
- Les alcools secondaires, dont le carbone comportant le groupement hydroxyle est lié à un atome d’hydrogène et deux radicaux organiques R et R' :
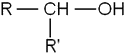
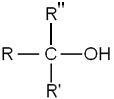
- Les alcools tertiaires, dont le carbone comportant le groupement hydroxyle est lié à trois radicaux organiques R, R' et R" :
- Les phénols, sont parfois considérés comme des alcools particuliers dont le groupement hydroxyle est lié à un carbone d’un cycle benzénique. Leur réactivité étant tellement différente de celle des autres alcools (ici le carbone portant le groupement -OH n'est pas tétragonal), les phénols sont généralement classés en dehors de la famille des alcools.
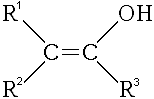
- Il existe aussi un groupe considéré parfois comme un cas particulier d’alcools appelés énols. Il s’agit d’une molécule dans laquelle la fonction hydroxyle est attachée sur un carbone d'une double liaison C=C (ici encore le carbone portant le groupement -OH n'est pas tétragonal). Il s’agit en fait d'une forme tautomère d’un aldéhyde ou d’une cétone. La forme majoritaire est généralement l'aldéhyde ou la cétone, et non l'énol, sauf cas particuliers où la forme énol est stabilisé par mésomérie comme par exemple les phénols.
Nomenclature
Lorsque l'alcool est la fonction principale, il suffit de remplacer le suffixe -e de l'alcane correspondant par le suffixe -ol et d'indiquer le numéro de l'atome de carbone où le groupe hydroxyle est fixé, bien que, parfois, lorsqu'elle n'est pas nécessaire à la description, cette dernière information soit omise.
Si elle n'est pas la fonction principale, il faut ajouter le préfixe hydroxy- précédé du numéro de l'atome de carbone où le groupe est fixé.
Pour la base conjuguée de l'alcool, l'ion alcoolate (voir paragraphe acidité), il suffit de remplacer le suffixe -e par le suffixe -oate.
Exemples:
- éthan-1-ol:
- butan-2-ol:
- acide 3-hydroxy-propanoïque:
Propriétés physico-chimiques
Aspect
Les alcools de faible masse moléculaire se présentent à température ambiante comme des liquides incolores ; les alcools plus lourds comme des solides blanchâtres.
Polarité et présence de liaisons hydrogène
Le groupe hydroxyle rend généralement la molécule d'alcool polaire. Cela est dû à sa géométrie (coudée, de type AX2E2), et aux électronégativités respectives du carbone, de l'oxygène et de l'hydrogène (Xsi(O)>Xsi(C)>Xsi(H)). Ces groupes peuvent former des liaisons hydrogène entre eux ou avec d'autres composés (ce qui explique leur solubilité dans l'eau et dans les autres alcools).
Point d'ébullition
Le point d'ébullition est élevé chez les alcools
- en raison du groupement hydroxyle qui permet les liaisons hydrogène
- en raison de la chaîne carbonée qui subit des forces de van der Waals.
Aussi, le point d'ébullition des alcools est-il d'autant plus élevé que
- le nombre de fonctions alcools est grand : un diol a une température d'ébullition supérieure à celle de l'alcool simple équivalent, qui lui-même a une température d'ébullition supérieure à l'hydrocarbure correspondant. Par exemple, parmi les alcools dérivés de l'isopropane, le glycérol (propan-1,2,3-triol) bout à 290 °C, le propylène glycol (propan-1,2-diol) à 187 °C et le propan-1-ol à 97 °C.
- la chaîne carbonée est longue : parmi les alcools linéaires, le méthanol bout à 65 °C, l'éthanol à 78 °C, le propan-1-ol à 97 °C, le butan-1-ol à 118 °C, le pentan-1-ol à 138 °C et l'hexan-1-ol à 157 °C.
- la chaîne carbonée est linéaire, par maximisation de la surface de la molécule susceptible de subir les forces de van der Waals. Par exemple, parmi les pentanols, le pentan-1-ol bout à 138 °C, le 2-méthyl-butan-1-ol à 131 °C et le 2,2-diméthyl-propan-1-ol à 102 °C.
Solubilité
La solubilité dans l'eau des alcools dépend des deux mêmes facteurs que précédemment, mais qui sont ici antagonistes :
- la chaîne carbonée, hydrophobe, tend à rendre la molécule non soluble.
- le groupement hydroxyle, hydrophile (grâce à ses liaisons hydrogènes) tend à rendre la molécule soluble
Ainsi, les alcools sont d'autant plus solubles dans l'eau que :
- la chaîne carbonée est courte : le méthanol, l'éthanol et le propan-1-ol sont solubles en toutes proportions dans l'eau, le butan-1-ol en proportion de 79 g⋅L-1, le pentan-1-ol de 23 g⋅L-1, l'hexan-1-ol de 6 g⋅L-1, l'heptan-1-ol de 2 g⋅L-1 et les alcools plus lourds sont pratiquement insolubles.
- le nombre de fonctions alcools est élevé. Par exemple, les butanediols sont solubles en toutes proportions tandis que le butan-1-ol ne l'est qu'en proportion de 79 g⋅L-1.
- la chaîne carbonée est non linéaire : parmi les pentanols, le 2,2-diméthyl-propan-1-ol est soluble dans une proportion de 102 g⋅L-1, le 2-méthyl-butan-1-ol de 100 g⋅L-1 et le pentan-1-ol de 23 g⋅L-1.
Les alcools de faible masse moléculaire sont généralement solubles dans les solvants organiques comme l'acétone, ou l'éther.
Réactivité
Acidité
Due à la liaison O-H
La polarisation forte de la liaison O-H donne la possibilité d'une rupture ionique : les alcools constituent donc des acides faibles, et mêmes très faibles (pKA compris en général entre 16 et 18, 10 pour les phénols, dans l'eau) par libération d'un proton H+ du groupe hydroxyle. Ils sont donc bien plus faibles que l'eau (à l'exception du méthanol) et ne manifestent leur caractère acide que dans des solutions non aqueuses, en réagissant par exemple avec la base NaNH2 dans une solution d'ammoniaque. On appelle la base conjuguée d'un alcool un ion alcoolate (ou alkoxyde).
Due aux doublets libres de l'oxygène
L'un des doublets libres de l'oxygène est capable de capturer un proton : l'alcool est donc une base de Brönsted, indifférente (pKA(ROH2+/ROH) d'environ -2), son acide conjugué, l'ion alkyloxonium, étant un acide fort, ne pouvant être présent qu'en très petite quantité (sauf en présence d'une concentration importante en acide fort).
Grâce à la réactivité de ces doublets, l'alcool est aussi une base de Lewis.
Nucléophilie
Les alcools sont de très bons nucléophiles, propriété toujours due à la réactivité des doublets libres de l'oxygène, réaction de surcroît rapide.
Nucléofugacité
- La liaison C-O étant polarisée, il y a possibilité de rupture ionique : R-OH → R+ + HO-. Cette rupture reste pourtant très difficile, faisant du groupe hydroxyle un mauvais nucléofuge (groupe partant).
- Cependant, sous sa forme protonée, l'ion alkyloxonium, la rupture est beaucoup plus facile.
Cette propriété lui permet notamment, comme nous allons le voir par la suite, de participer à des réactions de substitutions nucléophiles et des réactions d'éliminations.
Réactions
Réaction de substitution nucléophile
Article détaillé : Substitution nucléophile.Les alcools peuvent subir une substitution nucléophile dans laquelle le groupe hydroxyle est remplacé par un autre radical nucléophile.
Transformation en éther-oxyde
Passage de l'alcool aux halogénoalcanes
A partir d'un hydracide
- Réaction:
la réaction avec un hydracide, chlorure, bromure ou iodure d'hydrogène pour former un halogénoalcane (halogénure d'alkyle ou encore dérivé halogéné) :
R-OH + HX → R-X + H2O, X représentant l'halogène Cl, Br ou I (F n'est pas utilisé, la réaction est beaucoup trop lente).
Il s'agit de la réaction inverse de la réaction d'hydrolyse des dérivés halogénés.
- Propriétés:
- Réaction lente.
- Réaction réversible
- Elle est favorisée dans le sens direct si l'hydracide est concentré et en excès, dans l'autre sens en cas d'excès d'eau, et en milieu basique.
- stéréochimie : dépend de la classe de l'alcool (voir mécanismes)
- En fonction de la classe de l'alcool, et de la nature de l'hydracide, la réaction est plus ou moins lente et plus ou moins limitée (cela est aussi dû aux mécanismes).
On peut donc effectuer un classement: RIOH < RIIOH < RIIIOH ( "<" = "réagit moins vite et de façon plus limitée que") et HF<<HCl<HBr<HI.
- Mécanismes: Selon la classe de l'alcool, des mécanismes limites sont envisageables :
- Un alcool primaire (donc peu encombré stériquement) réagira selon le un mécanisme de type SN2. Toutes les propriétés sont donc celles d'une SN2 (inversion de configuration relative, énantièrospécificité,...)
- Un alcool tertiaire suit un mécanisme de type SN1 : en effet, le carbocation tertiaire formé est relativement stable. Les propriétés sont donc celles d'une SN1 (non stéréosélectivité, racémisation si le carbone porteur du groupe hydroxyle est asymétrique, ...)
- Un alcool secondaire peut suivre un mécanisme de type SN1, voire un mécanisme intermédiaire entre SN1 et SN2.
- Remarques:
- Ces réactions passant par un intermédiaire carbocationique peuvent provoquer des réarrangements.
- ces réactions peuvent être catalysées par un acide de Lewis comme le chlorure de zinc. Il se forme alors un adduit, qui débouche sur la formation d'un carbocation (HOZnCl2 est meilleur groupe partant que OH2), facilitant ainsi l'addition de l'halogène.
- Cette réaction peut être étendue à d'autres acides, comme l'acide phosphorique, sulfurique...
- Cette réaction est très peu utilisée en synthèse car elle est trop lente. On utilise donc du chlorure de tosyle pour former un tosylate qui est un très bon groupe partant.
A partir de dérivés d'acides inorganiques
Différents composés peuvent être employés pour permettre une halogénation des alcools.
- Pour la chloration, les réactifs les plus courants sont le phosgène (COCl2), le chlorure de thionyle (SOCl2), l'oxychlorure de phosphore (POCl3), et les chlorures de phosphore (PCl3) et (PCl5).
- Pour une bromation, (PBr3) et le couple CBr4 / triphénylephosphine.
- Les iodures sont généralement synthétisés par déplacement d'un chlorure par NaI dans l'acétone (NaI y est soluble, au contraire de NaCl, dont la précipitation est la force motrice de la réaction).
Réaction d'élimination (déshydratation)
Article détaillé : Élimination (chimie).Les alcools peuvent subir une réaction d'élimination à haute température en milieu acide et produire des alcènes :
- CH3-CH2-OH → CH2=CH2 + H2O
Cette réaction peut être inversée pour synthétiser des alcools à partir d'alcènes et d'eau, mais reste peu fiable car elle produit des mélanges d'alcools.
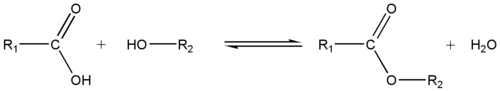
Estérification
Article détaillé : Estérification.En réagissant avec un acide carboxylique, l'alcool forme un ester.
Oxydation des alcools
Les alcools peuvent être oxydés en aldéhydes, cétones ou acides carboxyliques.
Article détaillé : Oxydation d'un alcool.Réduction des alcools
Les alcools peuvent être réduits en alcanes à l'aide de tributylétain par une réaction radicalaire appelée réaction de Mac Murry.
Alcools courants
- le méthanol, CH3(OH), dérivé du méthane ;
- l'éthanol, CH3-CH2(OH), dérivé de l'éthane ;
- le propanol, C3H8O, dérivé du propane ;
- le butanol, C4H10O, dérivé du butane ;
- l'éthylène glycol (ou éthan-1,2-diol), CH2(OH)-CH2(OH) ;
- le glycérol (ou propan-1,2,3-triol) CH2(OH)-CH(OH)-CH2(OH).
Toxicité
L'éthanol est une substance psychotrope toxique voire mortelle en grande quantité, même en quantité modérée en cas de consommation régulière (voir alcoolisme).
Les autres alcools sont généralement beaucoup plus toxiques car
- leur élimination est plus longue ;
- leur élimination conduit à des dégâts rénaux ;
- leur élimination produit des substances toxiques (par exemple, le foie dégrade le méthanol en formaldéhyde qui provoque la cécité ou la mort).
Leur ingestion doit être considérée comme une urgence médicale.
Voir aussi
- Alcool et corps humain
- Chimie organique
- Portail de la chimie
Catégorie : Alcool (chimie)
Wikimedia Foundation. 2010.