- Carbone
-
Carbone Bore ← Carbone → Azote —
6C ↑ C ↓ Si Table complète • Table étendue Informations générales Nom, symbole, numéro Carbone, C, 6 Série chimique Non-métaux Groupe, période, bloc 14, 2, p Masse volumique 1,8 à 2,1 g·cm-3 (amorphe),
1,9 à 2,3 g·cm-3 (graphite),
3,513 g·cm-3 (diamant gemme, 25 °C)[1]
3,15 à 3,53 g·cm-3 (diamant),Dureté 0,5 Couleur Noir (graphite) No CAS [2] Propriétés atomiques Masse atomique 12,0107 ± 0,0008 u[1] Rayon atomique (calc) 70 pm (67 pm) Rayon de covalence sp3 0,76 ± 0,01 Å [3]
sp2 0,73 ± 0,02 Å [3]
sp 0,69 ± 0,01 Å [3]Rayon de van der Waals 150 pm[4] Configuration électronique [He] 2s2 2p2 Électrons par niveau d’énergie 2, 4 État(s) d’oxydation -4, 0, +4, +2 Oxyde Acide faible Structure cristalline Hexagonale Propriétés physiques État ordinaire Solide diamagnétique Point d’ébullition 3 825 °C (sublimation)[1] Énergie de vaporisation 355,8 kJ·mol-1 Point triple 4 489 °C Volume molaire 5,29×10-6 m3·mol-1 Vitesse du son 18 350 m·s-1 à 20 °C Divers Électronégativité (Pauling) 2,55 Chaleur massique 710 J·kg-1·K-1 Conductivité électrique 61×103 S·m-1 Conductivité thermique 129 W·m-1·K-1 Énergies d’ionisation[5] 1re : 11,26030 eV 2e : 24,3833 eV 3e : 47,8878 eV 4e : 64,4939 eV 5e : 392,087 eV 6e : 489,99334 eV Isotopes les plus stables iso AN Période MD Ed PD MeV 12C 98,9 % stable avec 6 neutrons 13C 1,1 % stable avec 7 neutrons 14C trace 5 730 ans β- 0,156 14N Précautions SIMDUT[6] Produit non contrôlé Unités du SI & CNTP, sauf indication contraire. Le carbone est un élément chimique de la famille des cristallogènes, de symbole C, de numéro atomique 6 et de masse atomique 12,0107.
Sommaire
Étymologie
Le nom carbone vient du latin carbo, carbōnis signifiant « charbon ».
Historique
Le nom carbone n'apparaît dans le dictionnaire de l'Académie française, qu'à sa 6e édition (1832-5).
Préhistoire
Le carbone est présent sur terre depuis la formation de celle-ci : il a été produit par nucléosynthèse au cœur des étoiles qui ont explosé avant la formation du système solaire. Il existe sous forme de sédiments, charbon, pétrole, et également sous sa forme pure graphite, diamant. Les diamants naturels pouvant se trouver dans la kimberlite des cheminées d'anciens volcans, notamment en Afrique du Sud et dans l'Arkansas. On peut parfois trouver des diamants microscopiques dans certaines météorites.
Histoire
Elle est marquée par la considération accrue de l'importance du carbone.
- Deuxième millénaire (tradition de moines fondeurs, comme les Pères Chartreux, etc. - Élaboration (métallurgie) de fontes et aciers.
- Élaboration de la cémentation, « plus vieux » traitement connu en thermochimie.
- 1797 - Découverte de la forme « diamant » (voir article diamant synthétique).
- 1828 - Découverte des composés organiques et de la chimie organique (voir article Friedrich Wöhler).
- 1842 - Avec la RDM, August Wöhler pose les fondements de la future « science des matériaux ».
Nucléosynthèse
L'élément carbone n'est pas directement issu du Big Bang (nucléosynthèse primordiale), car les conditions de sa formation n'étaient pas réunies (la dilatation et le refroidissement de l'univers ont été trop rapides).
Le carbone est en revanche produit en masse dans le cœur des étoiles très massives, dites de la branche horizontale, où trois noyaux d'hélium fusionnent (réaction triple alpha).
Isotopes
Le carbone possède deux isotopes stables dans la nature, 12C (98,89 %) et 13C (1,11 %). Le premier, 12C, a été choisi comme nucléide de référence unique pour la masse atomique 12, après plusieurs propositions (anciennement l’hydrogène, puis conjointement avec l’oxygène pour les chimistes). La masse atomique du carbone reste cependant légèrement supérieure à 12 à cause de la prévalence de ses autres isotopes.
Le radioisotope 14C a une période de 5 730 ans et est couramment utilisé pour la datation d'objets archéologiques jusqu'à 50 000 ans. Il ne sera d'aucune utilité pour les archéologues de demain intéressés par les trésors de la civilisation actuelle car les explosions thermonucléaires réalisées dans l'atmosphère à partir des années 1960 ont créé des excès considérables.
Le radioisotope 11C a une période de 20 minutes. Cette courte période et la relative facilité de substituer un atome de 11C à un atome de carbone 12C (stable) en font un isotope utilisé en médecine nucléaire, notamment en tomographie à émission de positron. Les radiotraceurs les plus utilisés à ce jour sont le 11C-Raclopride qui se fixe préférentiellement sur les récepteurs dopaminergiques D2, et le 11C-Acétate utilisé en imagerie cardiaque.
Chimie
Corps simple
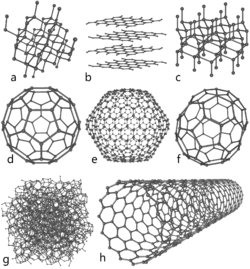
 Huit formes du carbone : diamant, graphite, lonsdaléite, buckminsterfullerène et 2 autres fullerènes, amorphe, et nanotube de carbone
Huit formes du carbone : diamant, graphite, lonsdaléite, buckminsterfullerène et 2 autres fullerènes, amorphe, et nanotube de carbone
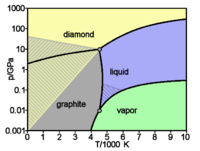
Le carbone est présent dans la nature dans deux formes allotropiques principales :- le graphite, empilement de structures cristallines hexagonales et monoplanes (graphènes, et de couleur grise. C'est la forme stable à température et pression ambiante.
- le diamant, de structure cristalline tétraédrique (structure type « diamant ») est transparent. C'est la forme stable à haute température et haute pression, métastable à température et pression ambiante.
Dans les conditions de pression normales, le carbone est sous la forme graphite, dans laquelle chaque atome est lié à trois autres dans une couche d'anneaux hexagonaux fusionnés, comme ceux des composés aromatiques hydrocarbonés. Grâce à la délocalisation des orbitales π, le graphite conduit l'électricité. Le graphite est mou, car les liaisons chimiques entre les plans sont faibles (2 % de celles des plans) et les couches glissent donc facilement les unes par rapport aux autres.
Sous très haute pression, le carbone cristallise dans un système cubique à face centrée nommé diamant, dans lequel chaque atome est lié à quatre autres (distance interatomique de 136 pm). Le diamant, grâce à la résistance des liaisons carbone-carbone, est, avec le nitrure de bore, la matière la plus dure à rayer. À température ambiante, la métamorphose en graphite est si lente qu'elle paraît invisible. Sous certaines conditions, le carbone se cristallise en lonsdaléite, une forme similaire au diamant mais hexagonale. De toutes les pierres précieuses, le diamant est la seule à se consumer complètement.
En plus du graphite (pur sp2) et du diamant (pur sp3), le carbone existe sous forme amorphe et hautement désordonnée (a-C). Ces formes amorphes du carbone sont un mélange de sites à trois liaisons de type graphite ou à quatre liaisons de type diamant. De nombreuses méthodes sont utilisées pour fabriquer du a-C : pulvérisation, évaporation par faisceau d'électrons, dépôt à l'arc électrique, ablation laser…Le carbone se sublime à 5 100 K. Sous forme gazeuse, il se constitue habituellement en petites chaînes d'atomes appelées carbynes. Refroidies très lentement, celles-ci fusionnent pour former les feuilles graphitiques irrégulières et déformées qui composent la suie. En particulier, parmi ces dernières, on trouve des formes où les feuilles sont pliées dans une forme stable et close comme une sphère ou un tube, appelées fullerènes, comme le buckminsterfullerène, C60. Certaines de ces formes sont aussi connues sous le nom de « footballène » et ont des propriétés qui n'ont pas encore été toutes analysées, mais apparaissent comme des structures extrêmement rigides.
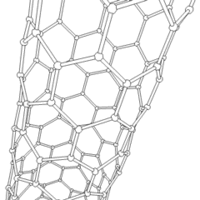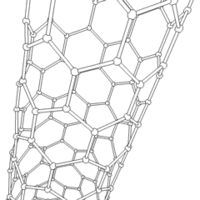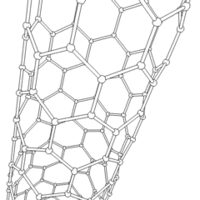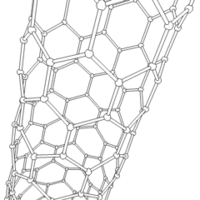
Les formes cylindriques du carbone sont appelées nanotubes et ont été découvertes dans le culot se formant à la cathode de l'arc électrique durant la synthèse de fullerènes. Ces objets de diamètre nanométrique et de longueur atteignant parfois le millimètre se présentent comme des couches de graphène enroulées sur elles-mêmes.
Les nanotubes fabriqués par la méthode de l'arc électrique sont presque tous « multifeuillets ». Conjointement à ces nanotubes, on observe un grand nombre de nanoparticules polyédriques. Les observations en microscopie électronique en transmission haute résolution ((en) HRTEM : High-resolution Transmission Electron Microscopy) révèlent que ces nanoparticules de carbone sont constituées de plusieurs couches de graphène, fermées, laissant une cavité nanométrique en leur centre. Les nanotubes de carbone sont d'excellents dopants mécaniques utilisés pour les ailes d'avions, par exemple afin d'améliorer leur dureté tout en conservant une bonne flexibilité[réf. nécessaire].
Et enfin, les oignons de carbone sont à la base des fullerènes multicouches.
Structure électronique
Le carbone possédant 6 électrons adopte une configuration électronique à l'état fondamental 1s22s22p2. Il possède 4 électrons sur sa couche de valence, ce qui lui permet de former quatre liaisons covalentes, dont des liaisons de type σ ou de type π. Les liaisons de type π sont toujours accompagnées d'une liaison de type σ. Le recouvrement des fonctions électroniques dans une liaison π est plus faible. Ces liaisons sont donc moins « solides ».
Composés courants du carbone
Petites molécule et ions
La forme la plus connue du carbone est le dioxyde de carbone CO2, qui est l'un des composants minoritaires de l'atmosphère terrestre (arrivant en quatrième position avec environ 0,03 % mais loin derrière l'azote 78,11 %, l'oxygène 20,953 % et l'argon 0,934 %) produit et métabolisé par les êtres vivants, l'industrie, les voitures et les centrales thermiques. Sa concentration a augmenté de près de 40% depuis le début de l'ère industrielle. Il possède deux modes de vibration qui absorbent la lumière infrarouge, ce qui en fait un gaz à effet de serre. Le CO2 est un composé majoritaire de l'atmosphère d'autres planètes comme Vénus.
Dans l'eau, il forme de très faibles quantités d'acide carbonique, H2CO3, qui produit des ions carbonate CO32- ou hydrogénocarbonate (bicarbonate) HCO3-. Beaucoup de minéraux sont des carbonates, notamment les diverses formes de calcaire (calcite, craie, marbre…). On connaît les propriétés thérapeutiques du bicarbonate de sodium NaHCO3.
Chimie organique
La chimie du carbone est essentiellement covalente. Le carbone est à la base d'une multitude de composés pouvant contenir un grand nombre d'atomes, en association avec l'hydrogène, l'oxygène, l'azote, les halogènes, le phosphore, le soufre, et les métaux, par liaisons simples, doubles ou triples. L'étude et la synthèse de ces composés constitue la chimie organique.
Dangers du carbone et de ses composés
Le (di)sulfure de carbone CS2, quoique de structure similaire au dioxyde de carbone, est un liquide hautement toxique utilisé comme solvant (vulcanisation du caoutchouc).
Les autres oxydes de carbone sont le monoxyde de carbone CO, et le suboxyde de carbone C3O2, moins commun. Le monoxyde de carbone est un gaz incolore et inodore, formé par combustion incomplète des composés organiques ou du carbone pur (charbon). Le monoxyde de carbone se lie plus fortement que l'oxygène, à l'hémoglobine sanguine pour former de la carboxyhémoglobine, un composé stable. Le résultat de cette réaction est l'empoisonnement des molécules d'hémoglobine, ce qui peut être mortel (voir l'entrée en question).
L'ion cyanure CN- a un comportement chimique similaire à un ion halogénure. Les sels contenant l'ion cyanure sont hautement toxiques. Le cyanogène, un gaz de composition (CN)2 est également proche des halogènes.
Avec les métaux, le carbone forme des carbures C4- ou des acétylures C22-. Quoi qu'il arrive, avec une électronégativité de 2,5, le carbone préfère former des liaisons covalentes. Quelques carbures sont des treillis covalents, comme le carbure de silicium, SiC, qui ressemble au diamant, et est d'ailleurs utilisé pour la taille de ceux-ci.
Les nanotechnologies permettent de produire des molécules particulières, dont les fullerènes, et des nanofils ou nanotubes difficiles à filtrer dans l'air et qui peuvent passer à travers les muqueuses et percer les enveloppes cellulaires. Certains craignent des effets différés comme on en a trouvé pour l'amiante.
Hydrocarbures
On appelle « hydrocarbures » les molécules associant carbone et hydrogène. On classe les hydrocarbures en trois familles :
- les alcanes, où le carbone forme des liaisons sp3 (« simples ») : méthane CH4, éthane C2H6, etc. ;
- les alcènes, où au moins un carbone forme des liaisons (« double ») (carbones sp2) : éthène (éthylène) C2H4, propène C3H6, etc. ;
- les alcynes, où au moins un carbone forme des liaisons (« triple ») (carbones sp) : éthyne (acétylène) C2H2, propyne C3H4, etc.
Suivant le nombre d'atomes de carbone, on fait précéder le suffixe -ane, -ène ou -yne :
- méth-
- éth-
- prop-
- but-
- pent-
- hex-
- hept-
- oct-
- non-
- déc-
La rotation est libre autour des liaisons simples carbone-carbone. En revanche, les liaisons doubles ou triples sont rigides : la liaison double est planaire, les angles de liaison autour des atomes de carbone sont 120°. Cela conduit à la formation de diastéréomères, c'est-à-dire de composés ayant la même formule chimique mais une disposition différente des atomes dans l'espace. La liaison triple est linéaire.
En outre, le carbone sp3 peut former des composés chiraux (du grec kheir (ἣ χείρ), la main). Le cas le plus simple est un composé possédant 4 substituants différents autour d'un atome de carbone. Suivant la disposition dans l'espace de ces substituants, on obtient deux molécules qui sont différentes : elles ne sont pas superposables, il s'agit d'une paire d'énantiomères. Les énantiomères sont l'image l'un de l'autre dans un miroir (comme nos deux mains).
Dans les hydrocarbures aromatiques, les atomes de carbone forment des cycles ou noyaux stabilisés par des liaisons π délocalisées.
Notes et références
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, CRC Press Inc, 2009, 90e éd., Relié, 2804 p. (ISBN 978-1-420-09084-0)
- Base de données Chemical Abstracts interrogée via SciFinder Web le 15 décembre 2009 (résultats de la recherche)
- (en) Beatriz Cordero, Verónica Gómez, Ana E. Platero-Prats, Marc Revés, Jorge Echeverría, Eduard Cremades, Flavia Barragán et Santiago Alvarez, « Covalent radii revisited », dans Dalton Transactions, 2008, p. 2832 - 2838 [lien DOI]
- Paul Arnaud, Brigitte Jamart, Jacques Bodiguel, Nicolas Brosse, Chimie Organique 1er cycle/Licence, PCEM, Pharmacie , Cours, QCM et applications, Dunod, 8 juillet 2004, Broché, 710 p. (ISBN 2100070355)
- "Ionization Energies of Atoms and Atomic Ions," in CRC Handbook of Chemistry and Physics, 91st Edition (Internet Version 2011), W. M. Haynes, ed., CRC Press/Taylor and Francis, Boca Raton, FL., p. 10-203
- « Carbone » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
Voir aussi
Articles connexes
Liens externes
- (en) Los Alamos National Laboratory - Carbon
- (en) WebElements.com - Carbon
- (en) EnvironmentalChemistry.com - Carbon
- (en) Schenectady County Community College - Carbon
- Mille et une facettes du carbone
s1 s2 g f1 f2 f3 f4 f5 f6 f7 f8 f9 f10 f11 f12 f13 f14 d1 d2 d3 d4 d5 d6 d7 d8 d9 d10 p1 p2 p3 p4 p5 p6 1 H He 2 Li Be B C N O F Ne 3 Na Mg Al Si P S Cl Ar 4 K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Kr 5 Rb Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te I Xe 6 Cs Ba La Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po At Rn 7 Fr Ra Ac Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Lr Rf Db Sg Bh Hs Mt Ds Rg Cn Uut Uuq Uup Uuh Uus Uuo 8 Uue Ubn * Ute Uqn Uqu Uqb Uqt Uqq Uqp Uqh Uqs Uqo Uqe Upn Upu Upb Upt Upq Upp Uph Ups Upo Upe Uhn Uhu Uhb Uht Uhq Uhp Uhh Uhs Uho ↓ g1 g2 g3 g4 g5 g6 g7 g8 g9 g10 g11 g12 g13 g14 g15 g16 g17 g18 * Ubu Ubb Ubt Ubq Ubp Ubh Ubs Ubo Ube Utn Utu Utb Utt Utq Utp Uth Uts Uto Métalloïdes Non-métaux Halogènes Gaz rares Métaux alcalins Métaux alcalino-terreux Métaux de transition Métaux pauvres Lanthanides Actinides Superactinides Éléments non classés
Wikimedia Foundation. 2010.