- Absorbance
-
L'absorbance mesure la capacité d'un milieu à absorber la lumière qui le traverse. On l'appelle également densité optique ou extinction. Il s'agit d'une grandeur sans unité donnée par la relation :
L'absorbance est définie par le logarithme de base dix du rapport entre l'intensité lumineuse I0, à une longueur d'onde λ, avant traversée du milieu, et l'intensité lumineuse transmise I [1].
L'absorbance diffère selon la nature de la substance étudiée, selon la longueur d'onde sous laquelle elle est analysée, et selon la concentration de cette substance dans le milieu traversé. Ce milieu peut être solide, liquide ou gazeux, pour autant qu'il soit transparent.
L'absorbance est couramment mesurée par un spectrophotomètre. Elle prend théoriquement une valeur entre 0 (I = I0) et l'infini (I = 0) mais, techniquement, il n'est pas aisé de mesurer un rapport I0/I supérieur à 1000. Les spectrophotomètres usuels ne donnent donc pas de valeur d'absorbance supérieure à 3. Pour étudier une substance fortement absorbante, il faut donc en diminuer l'épaisseur ou la concentration.
Sommaire
Lois de l'absorption de la lumière
Soit un faisceau de lumière monochromatique qui traverse une couche de matière transparente (comme un morceau de glace par exemple). Une part de l'énergie rayonnante passera à travers cette substance (énergie transmise), mais une partie sera réfléchie et une autre absorbée. La conservation de l'énergie incidente se traduit par la relation :
P0 est l'énergie incidente, Pa est l'énergie absorbée, Pt est l'énergie transmise et Pr est l'énergie réfléchie. L'énergie perdue par la réflexion est minimisée en effectuant des mesures en incidence normale (angle pour lequel la réflexion partielle est faible). Elle est prise en compte en comparant l'énergie transmise à celle passant dans un système équivalent (même matériau, même géométrie) mais ne contenant pas la substance à analyser (par exemple une cellule de référence en spectroscopie usuelle). On s'intéressera alors à la relation entre énergie incidente et énergie transmise. Cette relation a été formulée par Pierre Bouguer en 1729. La loi de Bouguer (connue aussi comme la loi de Lambert) consiste en deux parties; la première définit la transmittance, la seconde la variation de l'absorbance en fonction de l'épaisseur de la couche de substance traversée par la lumière.
Loi de Bouguer
Comme convenu précédemment, l'énergie transmise par un milieu homogène est proportionnelle à l'énergie appliquée sur celui-ci. Ainsi, l'énergie transmise par celui-ci sera toujours une partie de l'énergie totale appliquée. Ce rapport est défini comme la transmittance, T, qui s'exprime donc comme
Pour une substance donnée, avec une épaisseur et une longueur d'onde définies, T est une constante.
Comment varie la transmittance en fonction de l'épaisseur du milieu ?
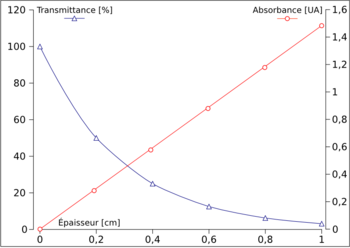
Supposons qu'une substance, d'un 1 cm d'épaisseur permet à 50 % de l'énergie reçue de la traverser. Autrement dit, sa transmittance vaut 0,5. Si cette lumière obtenue passe par une deuxième couche de même épaisseur, une nouvelle fois seuls 50 % de celle-ci réussiront à passer à travers. Au passage successif par les deux couches, seulement 25 % de l'énergie de la lumière incidente ont été transmis par 2 cm de cette substance (0,5 x 0,5 = 0,52 = 0,25). De même, 3 cm transmettront 12,5 % du total reçu (0,5 x 0,5 x 0,5 = 0,53 = 0,125). Il s'agit donc là d'une progression géométrique : la transmittance ne diminue donc pas d'une manière linéaire quand l'épaisseur augmente, mais exponentielle (voir figure). En conséquence, le logarithme de T (logT) diminue linéairement en fonction de l'épaisseur[2].
Le changement subi par l'énergie rayonnante P en fonction de la longueur du trajet optique traversé l, est défini par la relation:
où k est une constante de proportionnalité. En intégrant cette équation, on obtient :
d'où :
Pour les chimistes, on remplace le logarithme népérien par le logarithme décimal en divisant le facteur k par 2,303 l'incorporant dans une nouvelle constante notée a (α pour les physiciens):
Comme
 , on peut écrire :
, on peut écrire :On définit maintenant l'absorbance par :
a est le coefficient d'absorption ou absorptivité du milieu exprimé en m-1 ou cm-1.
Dans une solution, on peut diviser le coefficient d'absorption par la concentration molaire des entités contenues dans le volume traversé par un faisceau lumineux :
ε, exprimée en L.mol-1.cm-1, est l'absorptivité molaire ou coefficient d'extinction molaire de l'entité en solution. Il dépend de la nature du corps absorbant, de la longueur d'onde choisie et de la température.
Loi de Beer-Lambert
Pour plus de détails, voir l'article Loi de Beer-Lambert
Utilisant le même raisonnement que celui de la loi de Bouguer, August Beer propose en 1852 une équation reliant l'absorbance et la transmittance à la concentration d'une substance en solution. La loi est énoncée de la manière suivante :
La concentration c est exprimée en mol.L-1 ou en mol.m-3. L'absorptivité a peut être remplacée dans l'équation par le coefficient d'extinction molaire ε comme défini précédemment. Alors, par la combinaison des deux équations, on obtient la loi de Beer-Bouguer mieux connue comme la loi de Beer-Lambert :
La mesure de l'absorbance se fait grâce à un spectrophotomètre. l est la longueur du chemin optique traversé par la lumière dans la solution en cm. En pratique, cette longueur correspond à l'épaisseur de la cuve de mesure (généralement prise de 1 cm).
Cette loi permet aux chimistes de déterminer la concentration inconnue d'un ou plusieurs éléments dans une solution donnée. Toutefois, cette proportionnalité entre la concentration et l'absorbance ne serait plus applicable pour c > 0,01 mol.L-1 (car le phénomène de réflexion n'est plus négligeable).
Colorimétrie
Si un élément n'absorbe pas assez la lumière pour effectuer des mesures correctes, on le fait réagir avec un autre élément pour que le produit de la réaction affiche une couleur bien visible. L'intensité de la coloration obtenue est proportionnelle à la concentration réelle.
Turbidimétrie
La turbidimétrie se base sur un système de détection optique qui mesure la turbidité, c’est-à-dire la concentration de très petites particules en suspension dans une solution (mg.L-1). La lumière transmise à travers un milieu turbide dépend de la concentration en objets diffusants et de leurs sections efficaces d’extinction, donc de leurs tailles, leurs formes, leurs indices de réfraction, et de la longueur d’onde considérée.
Pour de faibles concentrations, l’intensité transmise peut être déterminée par la loi de Beer-Lambert. La mesure de l’intensité transmise permet ainsi, de remonter à la distribution de taille et à la concentration des particules absorbantes.Exemple d'application
étude classique, par spectrophotométrie, de la croissance bactérienne dans un milieu de culture liquide agité.Références
James HENKEL, Essentials of drug product quality (p 130,133). 1978, The Mosby Company, (ISBN 0801600316).
- IUPAC Compendium of Chemical Terminology, 2nd Edition (1997).
- En pratique les astronomes mesurent durant une nuit d'observation une même étoile à différentes distances zénithales définies par l'angle θ. Les magnitudes portées en fonction de l'épaisseur d'atmosphère traversée, proportionnelle à (1/cosθ), s'alignent sur une droite, en tolérant les écarts dus aux erreurs de mesure et aux variations d'absorption atmosphérique au fil des heures. Cette droite s'appelle la droite de Bouguer. L'ordonnée à l'origine de cette droite (pour un cosinus virtuellement infini, dont l'inverse vaut zéro) donne la valeur de la magnitude hors atmosphère.
Voir aussi
Catégories :- Grandeur physique
- Photométrie
- Chimie analytique
- Propriété chimique
Wikimedia Foundation. 2010.