- Poliomyélite
-
Poliomyélite
(Maladie de Heine-Medin)
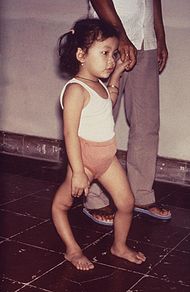
Classification et ressources externesEnfant présentant une amyotrophie du membre inférieur droit due à la poliomyélite CIM-10 A80., B91. CIM-9 045, 138 DiseasesDB 10209 MedlinePlus 001402 eMedicine ped/1843 pmr/6 MeSH C02.182.600.700 La poliomyélite (du grec polios (πολίός) « gris », -myelos (µυελός) « moelle » et -ite « inflammation »)[1], également appelée maladie de Heine-Medin, paralysie spinale infantile ou simplement polio, est une maladie infectieuse aiguë et contagieuse spécifiquement humaine causée par un virus à ARN du genre Entérovirus, le poliovirus sauvage (PVS)[2], dont il existe trois types : PV1, PV2 et PV3.
L'infection à poliovirus, transmise par voie digestive (oro-fécale), est inapparente chez 90 à 95 % des sujets et se traduit dans le reste des cas par des symptômes le plus souvent bénins et non spécifiques (pharyngite, syndrome grippal, vomissements)[3],[4]. L'infection du système nerveux central, la plus sérieuse, complique environ un cas sur cent. Elle entraîne une méningite et s'accompagne, dans la moitié des cas, d'une lésion des motoneurones de la corne antérieure de la moelle épinière qui définit la poliomyélite proprement dite ou poliomyélite antérieure aiguë. Il en résulte une paralysie flasque asymétrique intéressant le plus souvent les membres inférieurs.
La poliomyélite a été décrite et étudiée au XIXe siècle par Heine et Medin[5]. Des années 1880 jusqu'à la seconde moitié du XXe siècle, la maladie a sévi dans le monde entier sur un mode épidémique et handicapé ou tué plusieurs millions de personnes. Les progrès de l'hygiène et surtout la vaccination, découverte par Salk et Sabin, ont permis un recul considérable de son incidence. Depuis 1988, l'éradication de la poliomyélite fait l'objet d'une initiative mondiale sous l'égide de l'OMS, de l'Unicef et du Rotary International[6]. La campagne de vaccination de masse a fait passer son incidence de 350 000 nouveaux cas par an en 1988 à environ 1 500 en 2008[7] et environ 500 en 2011. Son éradication est officielle sur tout le continent américain, en Europe et dans les régions OMS du Pacifique occidental, Chine comprise[8]. En 2008, la maladie n'était encore endémique que dans quatre pays (Nigeria, Inde, Pakistan et Afghanistan) qui concentraient la quasi-totalité des cas[9]. Une flambée de cas au Tadjikistan au début de l'année 2010 rappelle cependant que le virus circule toujours[10]. En octobre 2011, L'Inde n'a compté pour cette année qu'en seul cas[11].
Historique
Bien que les premières épidémies de poliomyélite n'aient été identifiées qu'au XXe siècle, le poliovirus est probablement pathogène pour l'homme depuis plusieurs millénaires[12]. Il est difficile cependant de dater les grandes épidémies d'avant le XXe siècle, l'obligation officielle de notifier les cas de polio, dans chaque pays, n'ayant été prise qu'au début du siècle (d'abord en Suède et en Norvège - 1905 -, puis aux États-Unis en 1909, en Grande-Bretagne en 1911[13] et en France en 1936)[14].
Jusqu'au XIXe siècle le poliovirus était un agent endémique et quiescent ; à partir de 1910, les épidémies deviennent régulières dans tout le monde industrialisé, principalement dans les villes et durant les mois d'été. Conjointement au progrès des savoirs, cette évolution de la maladie, avec ses crises épidémiques parfois dramatiques, conditionna la connaissance que les médecins – et la population – purent en avoir.
De l'antiquité à la découverte d'un virus
Certaines gravures de l'Égypte antique représentent des personnages handicapés moteurs avec certaines caractéristiques de la poliomyélite (adultes aux membres amyotrophiés, enfants marchant à l'aide de cannes)[15] et des égyptologues anglais ont, il y a une cinquantaine d'années, reconnu des traces de polio sur un squelette datant de 3 400 ans avant J.-C.[13]. Dans ce que la tradition impute à Hippocrate d'abord et à Gallien ensuite, on trouve quelques mentions de paralysies qui peuvent évoquer la poliomyélite.
Si les médecins Michael Underwood en 1784 puis Giovanni Battista Monteggia[16] en 1813, sont crédités des premières descriptions de la poliomyélite : affection caractérisée par une période fébrile de quelques jours, suivie par une paralysie des jambes[17] (symptômes parfois présentés par d'autres maladies comme la diphtérie[18]), ce n'est qu'à partir des années 1860 que les médecins commencent à décrire les dommages spécifiques causés à la moelle épinière par la maladie, et cette dernière ne se voit baptisée de son nom scientifique de « poliomyélite » – qui signifie « inflammation de la substance grise de la moelle épinière » – qu’en 1874 (l'expression poliomyelitis anterior acuta est d'Adolphe Kussmaul). Jusqu'alors les symptômes de la poliomyélite avaient été décrits successivement, au début du XIXe siècle, sous les noms de paralysie dentaire, paralysie spinale infantile, paralysie essentielle de l'enfant (Barthez et Rilliet, 1851), paralysie régressive, myélite des cornes antérieures (Séguin), téphromyélite (du grec tephros, « cendre grise » ; Charcot 1872), paralysie regressive (Barlow) et paralysie du matin(West, 1843)[19].
C'est à Jakob Heine que l'on doit la première description précise, quoiqu'incomplète, de la maladie exposée dans son ouvrage de 1840 Beobachtungen über Lähmungszustände der untern Extremitäten und deren Behandlung. Il n'introduit toutefois le terme[20] de Spinale Kinderlähmung que dans la seconde édition publiée en 1860 sous le titre Spinale Kinderlähmung. Monograph. Cet orthopédiste allemand crée l'entité clinique qu'il distingue clairement de la paralysie cérébrale infantile, et de l'hémiplégie. Il émet l'hypothèse du caractère épidémique de la maladie et suggère la localisation des lésions dans la corne antérieure de la moelle épinière.
Cette dernière hypothèse, également émise par Guillaume Duchenne de Boulogne dans De l'Électrisation fut confirmée par les autopsies pratiquées par André Victor Cornil en 1863 et par son élève Jean-Martin Charcot en 1870 qui y trouvèrent effectivement des altérations histologiques. Il semble qu'avant Duchenne, la localisation des lésions dans les cornes antérieures étaient bien acceptées concernant les paralysies spinales de l'enfant ; l'originalité de Duchenne aura été de suggérer semblable localisation pour la paralysie spinale de l'adulte[21].
En 1885 le neurologue allemand Adolf Strümpell décrit une maladie - portant depuis son nom - qu'il prend alors pour une forme cérébrale de la poliomyélite.
À l'automne 1881, un médecin suédois Nils August Bergenholtz diagnostique treize cas de poliomyélite antérieure aiguë (chez des enfants et deux adolescents) et en suggère le caractère épidémique. N'ayant pas été publiée, cette observation est restée inaperçue de ses contemporains (et des historiens jusqu'à récemment)[22].
En 1887, un pédiatre suédois expérimenté Karl Oskar Medin qui n'avait jusqu'alors rencontré que des cas isolés de poliomyélite eut à faire face d'un coup à 44 cas à la polyclinique de Stockholm. Ses observations attentives lui permirent d'établir que la paralysie qui définissait jusqu'alors la maladie, n'était en fait que la deuxième phase d'un processus signalé d'abord par de la fièvre, des maux de tête et des malaises. Il établit aussi que la maladie pouvait se limiter à cette première phase. Enfin Medin fut aussi le premier à signaler le caractère épidémique de la maladie. Il publia ses travaux en 1890, année même où il acquit une reconnaissance internationale lors du 10e Congrès Médical International de Berlin[23].
Sur la base d'observations méthodiques faites pendant la vague épidémique de 1905 en Suède (qui fit 1 031 victimes), c'est le docteur Ivar Wickman qui devait apporter des preuves épidémiologiques de la contagiosité signalée précédemment par Oskar Medin. Enquêtant sur plus de mille cas, visitant lui-même les domiciles de plus de 300 patients, cherchant auprès des médecins des informations précises sur les autres, il arriva à la conclusion que la poliomyélite était souvent transmise par des personnes apparemment en bonne santé mais qui étaient tout de même affectées de façon mineure par la maladie, ce que Wickman lui-même appellera « poliomyélite abortive ». Sur ce point l'originalité de Wickman n'aura pas tant été de signaler ces cas bénins, que de souligner leur grande occurrence et leur rôle dans la propagation de la maladie[24]. Par ailleurs, Wickman établit différents temps d'incubation de la maladie et en relève aussi la saisonnalité marquée. Il s'étonnera de ce que les malades n'étaient pas que des enfants : 21,4 % avaient plus de 14 ans[25]. Enfin, c'est lui qui nomma la maladie maladie de Heine-Medin. Ses travaux conduisirent la Suède à rendre obligatoire la déclaration des cas de poliomyélite, tandis que l'épidémie de 1911-1913 donnant aux chercheurs l'occasion de confirmer ses travaux lui apportera une reconnaissance internationale.
La maîtrise des souches virales
La preuve définitive du caractère infectieux de la maladie est toutefois apportée par Karl Landsteiner et Erwin Popper en 1908[26]'[27]. Landsteiner injecta un extrait de la moelle épinière d'un jeune garçon décédé de polio à des rats, des cobayes, des souris ainsi qu'à deux singes (l'un Macaca mulatta, l'autre Papio hamadryas[28]) : les singes - et seulement eux - furent rapidement paralysés, l'un des deux aux deux jambes ; à l'examen microscopique, leur moelle épinière présentait le même aspect que celle d'enfants décédés de polio[29].
Lors de ces expériences, Landsteiner et Popper ne réussirent toutefois pas à démontrer le caractère contagieux ; ils ne purent pas transmettre la maladie de singe à singe. Cela fut réalisé peu après en 1909 par plusieurs équipes : Römer, Flexner et Lewis, Leiner et von Wiesner, enfin Landsteiner et Levaditi (Landsteiner ayant rallié provisoirement l'Institut Pasteur pour profiter de son animalerie)[30]. La nature de l'agent infectieux ne put être établie. Flexner et Lewis[31] n'ayant pu mettre en évidence aucun agent bactérien, concluent qu'il doit s'agir de ce qui était alors appelé un virus filtrant (la nature bactérienne de l'agent a eu ses défenseurs au moins jusqu'en 1952[32]'[33]'[34]). Malgré ces découvertes, la grande presse continuera encore à affirmer pendant des années aux États-Unis que le germe de la polio n'avait pas encore été découvert.
Sur la base d'expériences pratiquées sur des singes par Flexner et Lewis, mais aussi par Leiner et Von Wiesner, Simon Flexner et P.A. Lewis avancent en 1910 que le poliovirus accède au système nerveux central le long des voies nerveuses à partir de la muqueuse nasale. Une des raisons de cette conception erronée tient au fait que Flexner avait conduit ses expériences sur une des rares espèces de singes à ne pouvoir être infectée que par injections dans le système nerveux central[35]. Par ailleurs - ainsi qu'on ne put le mettre en évidence qu'à la suite des découvertes d'Enders en 1949 - les expériences réitérées de Flexner conduisirent à une sélection des souches virales (MV strain ; mixed virus) qui ne purent plus se développer que sur des tissus d'origine nerveuse et n'induisant qu'une faible virémie. Cette conception d'un neurotropisme exclusif du poliovirus, ainsi que de son entrée par la voie nasale, dominante jusque dans les années 1930, occultera les résultats d'expériences qui ne rentraient pas dans son cadre explicatif[36].
C'est ce qui arriva aux travaux du Suédois Carl Kling (en collaboration avec Wilhelm Wernstedt et Alfred Pettersson) : prolongeant l'expérience de Lansteiner de 1909, il put montrer que l'injection d'extraits de tissus de la gorge, du larynx ou des intestins provenant d'adolescents décédés de polio produisait également une paralysie chez les singes. Il en conclut que la contamination pouvait se faire par un virus présent dans la salive ou les intestins des personnes atteintes : c'est ce que l'on a appelé la théorie de la voie intestinale ou également, en anglais, "the oral-fecal route". Par ailleurs, Kling put confirmer de manière expérimentale ce que Wickman avait conclu de ses observations, à savoir que des personnes ne présentant aucun symptôme pouvaient héberger le virus dans leur gorge ou leur intestin. Quand Kling et son équipe présentèrent leurs travaux à une conférence à Washington en 1912, Flexner, directeur du Rockfeller Institute for Medical Research – alors le pôle principal de recherche sur la polio[37] – ne voulut leur accorder aucune crédibilité. Les chercheurs américains n'ayant pu aboutir aux résultats présentés par les Suédois après avoir repris leurs expériences, ils se détournèrent longtemps de la théorie de la voie intestinale[22]. Il faudra attendre les travaux de Trask et de Paul de l'université Yale et surtout ceux d'Albert Sabin et de Robert Ward en 1941[38] pour que s'impose définitivement l'importance de la voie intestinale ; toutefois dès les années 1920 en Suède, les vues de Flexner s'accommodaient de celles de Kling fût-ce de façon marginale[22]].
Les travaux de Kling ont sans doute souffert d'arriver aux États-Unis au moment où[22] les chercheurs américains - dans le sillage de Milton Rosenau et bientôt sous la pression des évènements de 1916[39]) - étaient enclins à voir dans la mouche des étables (Stomoxys calcitrans) le vecteur de la maladie.
Au même moment Simon Flexner découvrit des "germicidals substances" (appelées aujourd'hui anticorps), ayant d'abord extrait du sang de singes convalescents un sérum, puis en avoir injecté à d'autres singes en même temps que de la moelle infectée, il avait pu constater que ses sujets d'expérience ne manifestaient aucune paralysie. Arnold Netter avait fait une découverte semblable en 1909-1910 avec Constantin Levaditi[40]. En 1915 il s'implique dans la promotion de ce sérum (issu de convalescents, humains ou simiens) qui fut largement utilisé lors de la sérieuse épidémie de 1916 aux États-Unis. Faute tant d'évaluations que de traitements alternatifs cette sérothérapie fut utilisée jusqu'en 1935 aux États-Unis[41], jusqu'en 1940 au Canada[42].
Entre 1928 et 1931 Pierre Lépine démontre la survivance du virus de la poliomyélite dans les milieux extérieurs et, en particulier dans l'eau, la transmission du virus par la voie digestive au singe, l'action du chlore sur le virus[43]. En 1929 dans le cadre de l’Office international d’hygiène publique, Carl Kling et Constantin Levaditi montrent sur la base d'études épidémiologiques menées en Saxe et en Roumanie, que la majorité des cas de polio ont lieu dans le voisinage de cours d'eau : c'est l’hypothèse hydrique[22].
En 1931 comparant la souche Rockefeller MV avec une souche locale isolée à Melbourne, Sir Frank Macfarlane Burnet et Dame Jean MacNamara montrent qu'il existe au moins deux souches de virus (article publié en 1931 dans the British Journal of Experimental Pathology). Provenant de chercheurs inconnus situés sur un continent éloigné, ces résultats furent accueillis avec beaucoup de scepticisme. Leur importance ne fut vraiment reconnue que plus tard par Hammon, Francis et Rivers, à la lumière de l'échec des vaccins de 1935[44].
Dans les années 1934-35 apparurent deux vaccins américains rivaux et indépendants : l’un de type « inactivé » mis au point par le docteur Maurice Brodie, l’autre étant une version « atténuée » élaborée par le docteur John Kolmer. Malheureusement, leur utilisation à la hâte dans certaines parties des États-Unis se révéla inefficace, voire, dans certains cas, fatale. Pendant les vingt années qui suivirent cette expérience infructueuse, les chercheurs hésitèrent à se lancer dans un autre vaccin[45]. C'est à cette période que le Docteur Claus W. Jungeblut[46] proposa un traitement préventif et curatif par la vitamine C. Albert Sabin – déjà une autorité à l'époque – ne put obtenir les mêmes résultats[47] ; le Docteur Fred R. Klenner[48] proposera de nouveau cette approche en 1948 mais ne sera pas suivi. De la même façon, à la même époque, divers traitements par instillation nasale furent proposés et évalués[49], pour finir par être rejetés une fois leur inefficacité et leur nocivité établies.
En 1939 Charles Armstrong réussit à multiplier la souche Lansing dans le corps de souris, ce qui allait faciliter la recherche. Max Theiler, mais aussi Maurice Brodie semblent y être parvenus précédemment sans que cela ne soit relevé à l'époque[50].
En 1941 une équipe de l'Hôpital Johns Hopkins de Baltimore précisa le cycle du virus dans le corps humain. Ils montrèrent notamment que le virus devait pénétrer dans le sang avant de pouvoir accéder à la moelle épinière. Cette découverte ouvrait des perspectives pour un futur vaccin : si l'on arrivait à induire des anticorps dans le sang, alors le virus pourrait être neutralisé avant de provoquer des atteintes bulbaires.
En 1945 on pouvait encore s'interroger sur l'éventualité de réservoirs animaux du virus autres que les singes, par exemple les chiens[51],[52].
En 1946, Thomas Francis, dûment interrogé sur ce point, rappelle que les populations afro-américaines ne sont pas moins exposées à la poliomyélite ainsi que l'opinion commune semblait le croire[53]'[54].
En 1949, au moment même où deux spécialistes éminents de la polio, Sir MacFarland Burnet et William Hammon[55], expriment leur pessimisme quant aux perspectives de contrôle de la maladie, trois Américains font une découverte majeure. Dans un article paru dans la revue Science du 28 janvier 1949, Enders, Weller et Robbins, font savoir qu'ils sont parvenus à cultiver le virus poliomyélitique - souche Lansing - sur des cellules embryonnaires humaines, sur des prépuces, des reins humains puis des reins de singes[56]'[57]. Cette découverte – dont l'importance ne fut pas immédiatement perçue par tous les chercheurs – allait rapidement donner un nouvel élan à la recherche. Dorénavant les chercheurs purent disposer de grandes quantités de virus à moindre frais : jusqu'alors, en dépit de la découverte d'Armstrong d'une part, et de la publication de Sabin et Olitsky de 1936[58] de l'autre, le virus n'était multiplié qu'in vivo, et sur des singes[59] (Constantin Levaditi avait pourtant montré dès 1913 qu'il était possible de cultiver le virus sur des cellules d'origine non nerveuses[60]). Dans l'éventualité de la mise au point d'un vaccin c'était aussi une garantie de sécurité. On connaissait en effet les risques de paralysie et de mort (0,4 % des inoculés) attachés au vaccin antirabique de Pasteur et qui résultaient d'une réaction immunitaire à l'injection de myéline contenue dans le vaccin : en cultivant le virus destiné au vaccin sur des cellules autres que d'origine nerveuse on pourrait s'affranchir de ce risque. Dans le cadre de ces travaux, Enders, Weller et Robbins découvrirent aussi un moyen rapide et peu cher de détection du virus (jusqu'alors la présence du virus n'était avérée que lorsqu'un singe avait été paralysé suite à une injection). Ces découvertes leur valurent le prix Nobel de médecine en 1954[61]'[62]. Peu de temps après, en 1952, les laboratoires Lederle firent savoir que deux de leurs équipes avaient réussi à cultiver un des virus de la poliomyélite (souche MEFI) sur des embryons de poulet[63].
En 1949 toujours, Bodian et Morgan établissent que quatorze souches différentes de poliovirus se ramènent à trois sérotypes[64] (en 1951 un comité de la National Foundation for infantile Paralysis précisera que toutes les souches se regroupent bien en trois sérotypes, et seulement en trois[65]).
En 1950, William Hammon (Université de Pittsburgh) parvint à purifier des gamma globulines à partir du plasma sanguin des patients ayant guéri de la poliomyélite[66]. Hammon proposa l'injection de sérum anti-polio pour prévenir la maladie et réduire la sévérité des symptômes chez les patients atteints. Un grand essai clinique donna des résultats encourageants, laissant supposer que les gamma globulines anti-poliomyélitiques pouvaient prévenir la survenue d'une poliomyélite paralytique dans environ 80 % des cas[67]. Cependant l'immunisation passive par sérothérapie s'avéra impossible à mettre en œuvre à grande échelle, principalement en raison de la quantité insuffisante de sérum disponible. La recherche se détourna de cette stratégie et se focalisa sur la mise au point du vaccin[68].
Dans le même temps, William Haast et Murray Sanders – financés par la March of Dimes – élaborèrent un traitement à base de venin de cobra, qui tomba dans l'oubli suite aux découvertes de Salk et Sabin[69].
L'ère des vaccins
En 1948[70], le Dr Isabel M. Morgan Mountain de la Johns Hopkins University démontra sur des singes l'efficacité d'un vaccin inactivé[71], ce qui eut une grande importance théorique : à l'époque le consensus scientifique voulait que, pour ce qui était de la poliomyélite, seul un vaccin vivant était capable de conférer une immunité.
Les 17 et 27 février 1950, Hilary Koprowski, assisté du Dr Jervis et de M. Norton, inocule avec succès un vaccin vivant atténué (souche TN) à quelques enfants handicapés (après avoir obtenu une autorisation des parents, mais pas de ses autorités de tutelle)[72]'[73],[74]. Koprowsky fait part de ses travaux à une réunion de la Foundation for infantile Paralysis en 1951 à Hershey[75]. Cet essai vaccinal sur des êtres humains suscita un grand scandale aux États-Unis ; Koprowski s'aliéna ce faisant tout soutien des autorités gouvernementales, qu'il dut alors chercher auprès du secteur privé. Sur le territoire américain, il poursuivit ses essais[76] en 1952, en 1953, en 1954 et en 1955 .
En 1952 Dorothy Hortsmann de l'université Yale arriva enfin à mettre en évidence la présence du virus dans le sang[77], ce que confirmera David Bodian au Johns Hopkins Hospital.
Le 21 octobre 1952, le docteur Howard Howe de la Johns Hopkins University fait état d'un essai de vaccin trivalent à virus inactivé au formaldéhyde pratiqué sur six enfants handicapés, cinq autres enfants servant de contrôle. Les enfants ne furent pas soumis au virus : on mesura leur taux d'anticorps suite à l'inoculation des souches vaccinales[78],[73],[79],[80].
Fin 1952, utilisant le milieu 199 de Hanks fourni par Connaught et après se l'être injecté à lui-même et à sa famille, Salk administra le vaccin aux résidents d’une institution pour enfants infirmes, le D.T. Watson Home for Crippled Children. Il conduisit un autre essai à la Polk State School en Pennsylvanie[73]. À l'automne 1953, Salk avait testé son vaccin sur 637 personnes dans la région de Pittsburg. En 1953 Salk publie les résultats de ces essais, ce qui lui vaut immédiatement une renommée nationale[81],[82] et des critiques : on craint que l'adjuvant utilisé – une huile minérale – ne soit cancérigène : il passe à une solution aqueuse.
La Fondation nationale pour la paralysie infantile demanda aux laboratoires de lui fournir la quantité de fluide viral nécessaire pour conduire un essai sur le terrain en double aveugle sans précédent aux États-Unis, qui devait commencer le 26 avril 1954. L’essai fut l’une des plus vastes expériences médicales de l’histoire. Il impliquait le suivi détaillé de près de 1 800 000 enfants de 5 à 8 ans qui, ayant reçu soit le Milieu 199 comme placebo soit le vrai vaccin, devaient être observés pour voir s’ils contractaient ou non la polio. Le 12 avril 1955, l'annonce du succès de l'expérience fut un énorme événement médiatique. Les fabricants américains lancèrent en hâte leur vaccin pour répondre à la demande, dans le cadre de la Poliomyelitis Vaccination Assistance Act.
Le 25 avril 1955, c'est le Cutter incident : on découvrit les premiers de 205 cas de polio dus au vaccin produit par les laboratoires Cutter, en Californie ; 79 étaient des enfants vaccinés, et les autres s’étaient trouvés en contact avec ces derniers. Les trois-quart des malades furent atteints de paralysie et onze périrent. Le 27 avril, le Médecin Général américain fit retirer tous les vaccins de Cutter du marché et le 8 mai, après le lancement d'une vaste enquête, tout le programme de vaccination aux États-Unis fut interrompu. Au total, cette première campagne de vaccination massive aura été marquée par la fourniture d'un important lot défectueux (virus vivant non atténué) aboutissant à près de 220 000 contaminations dont 70 000 malades, 164 paralysies sévères et dix décès[83].
En Afrique du Sud, James Gear produit un vaccin de type Salk qu'il inocule à 15 000 enfants en 1955[84].
En 1956, Sabin inocule son vaccin à 9 000 singes (macaques ?), 150 chimpanzés, ainsi qu'à 133 jeunes adultes dans une prison de l'Ohio. La même année, George Dick - connu pour avoir travaillé sur le vaccin atténué contre la fièvre jaune - invite H. Koprowski à conduire un vaste essai en Irlande. George Dick interrompra l'essai après avoir constaté que la souche vaccinale atténuée avait pu regagner de sa virulence[85].
En 1957, Salk et Pierre Lépine publient à quelques semaines d'intervalle les résultats de leurs travaux. Les deux vaccins diffèrent par les souches employées. Pour prévenir tout risque d'infection, Lépine a procédé à une double inactivation du virus, d'abord par le formol, puis par adjonction de béta-propiolactone[86].
En juillet 1957, l'OMS appelle à l'organisation d'essais à grande échelle pour les vaccins atténués qui respecteraient six critères de sécurité[87]. C'est dans le prolongement de cette déclaration que le vaccin oral d'Albert Sabin fut testé à partir de 1957 sous l'égide de l'OMS en dehors des États-Unis sur 80 millions de personnes (Russie, Hollande, Mexique, Chili, Suède et Japon).
Le 18 août 1958, H. Koprowsky débute une vaste campagne de vaccination, avec le vaccin oral CHAT, au Congo belge, qui se prolongera jusqu'en 1960[88]'[89],[90]. De 1958 à 1960, il vaccinera également 40 000 enfants en Allemagne et plus de sept millions en Pologne (CHAT (sérotype 1)et/ou W-Fox(sérotype 3)) ; de 1960 à 1961 des essais ont lieu en Suisse et en 1961 en Croatie[91]. Les essais conduits par Cox en Floride et à Berlin montrant que des souches vaccinales redevenaient virulentes, les laboratoires Lederle abandonnèrent les recherches avec les souches utilisées par Cox[87].
En 1959, le comité spécial créé un an auparavant par le National Institutes of Health afin d'évaluer les souches destinées au vaccin oral établit la supériorité de celles de Sabin sur celles de Koprowski et de Cox (et sur celles cultivées à l'université Yale), ce qui conduira le Surgeon General à en recommander l'usage[92],[87].
Le 24 avril 1960 c'est le Sabin Sunday, premier test massif du vaccin Sabin aux États-Unis. Le vaccin oral monovalent de type 1 (MOPV1) et celui de type 2 (MOPV2) obtinrent leur agrément en 1961 aux États-Unis, le MOPV3 l'obtint en 1962[93].
En mai 1962, le Congrès américain examine un projet gouvernemental visant à édifier le cadre de futures campagnes de vaccinations massives (US Congressional Hearings[94] HR10541). À l'occasion des multiples auditions menées à cet effet, le Congrès prend connaissance notamment de la position critique du Pr Bernard Greenberg[95]. Ce dernier signale l'existence de différents biais statistiques ayant conduit à surestimer l'effet des premières vaccinations antipolio – avec le vaccin Salk – qu'il juge responsables au contraire d'une augmentation des cas de polio[96]. La loi est finalement adoptée la même année sous le nom de Vaccination Assistance Act PL 87-868 : elle débloque des fonds fédéraux pour l'achat de vaccins et pour l'établissement de statistiques[97].
En 1963 le vaccin oral Sabin trivalent (tOPV) obtient son autorisation[93]. Suite à l'agrément du vaccin Sabin, le recours au vaccin Salk diminua rapidement pour ne représenter que 2 % des vaccins polio utilisés annuellement aux États-Unis[98].
La vaccination devient obligatoire et par conséquent gratuite en France en 1964[99]. Elle avait précédemment été introduite dans le calendrier vaccinal français en 1958 (Salk), puis en 1962 (Sabin)[100].
Une épidémie est enrayée aux États-Unis en 1965. Le taux de nouvelles contaminations est tombé à 1 pour 10 millions de personnes.
Fin 1987 le « vaccin Salk amélioré » (enhanced potency IPV) obtient son autorisation aux États-Unis ; il avait été mis au point en 1978 selon le procédé de culture sur cellules diploïdes humaines (laboratoires Connaugh)[101],[98].
En 1997 l'Advisory Committee on Immunization Practices recommande l'usage du vaccin inactivé pour les deux premières injections, les deux autres étant pratiquées avec un vaccin oral. Le 17 juin 1999 l'ACIP ne recommande plus que le seul vaccin inactivé[102].
Le 11 septembre 2000 la Royal Society de Londres invalide l'hypothèse de Edward Hooper postulant l'origine du sida dans les campagnes de vaccination antipolio menées par Koprowsky au Congo Belge à la fin des années 1950[103],[104].
Agent causal
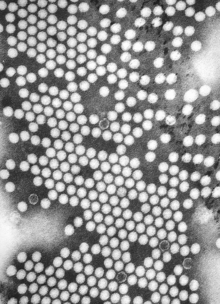
La poliomyélite est causée par les poliovirus, virus à ARN du genre Entérovirus et de la famille des Picornaviridae ; ces poliovirus (ou virus polio) ressemblent au virus de la grippe et de l'hépatite A qui ont la même taille et sont de la même famille. Ils ont les mêmes propriétés, les mêmes affinités pour aller s'installer dans l'intestin, la même contamination par la bouche[13].
L'Homme est le seul réservoir du virus[8]. Les poliovirus ont un tropisme préférentiel pour le tractus digestif[3]. Leur structure est très simple, composée d'un génome ribonucléique de sens positif entouré d'une capside[4]. La capside protège le matériel génétique et rend possible l'infection de certains types de cellules par le virus. Trois sérotypes de poliovirus ont été identifiés : poliovirus type 1 (PV1), type 2 (PV2) et type 3 (PV3), chacun différant légèrement des autres par les protéines de sa capside[105]. Tous trois sont extrêmement virulents et produisent les mêmes symptômes[4]. PV1 est la forme la plus régulièrement rencontrée, et la plus fréquemment associée à la paralysie[106].
En de rares circonstances des poliomyélites peuvent survenir des suites d'infections produites par des enterovirus autres que les poliovirus[107].
S'il peut « survivre » dans les eaux, la vase, etc., le polio-virus – comme tout virus – n'est capable de se multiplier qu'au sein de cellules vivantes : dans le milieu extérieur, faute de pouvoir se multiplier, il est donc voué à disparaître au bout quelques mois.
Physiopathologie
Transmission
La poliomyélite est très contagieuse et se transmet facilement par contact interhumain[108]. En zone d'épidémie, les souches sauvages de poliovirus sont théoriquement capables d'infecter la totalité de la population humaine[109]. La transmission est habituellement saisonnière sous les climats tempérés, avec un pic en été et en automne[108]. Ces différences saisonnières sont beaucoup moins prononcées sous les climats tropicaux[109]. La période d'incubation, qui sépare la première exposition des premiers symptômes, est habituellement comprise entre six et vingt jours, avec des valeurs extrêmes allant de trois à trente-cinq jours[110]. Des particules virales sont excrétées dans les fèces durant plusieurs semaines après l'infection initiale[110]. La transmission de la maladie est ainsi essentiellement digestive par voie oro-fécale, via l'ingestion d'aliments ou d'eau contaminés. Occasionnellement, la maladie peut être transmise par voie oro-orale via la salive[106], voie qui semble prépondérante dans les zones à haut niveau d'hygiène[108]. La transmission peut se faire aussi au contact des sécrétions respiratoires[111] (postillons émis lors de toux ou d’éternuements) d’une personne contaminée car celle-ci élimine le virus dans les sécrétions rhino-pharyngées pendant les premiers jours de l’infection. La contagiosité est maximale entre les sept à dix jours qui précèdent et les sept à dix jours qui suivent l'apparition des symptômes, mais la transmission est possible tant que le virus persiste dans la salive et les matières fécales[106].
Parmi les facteurs qui augmentent le risque d'infection ou influencent péjorativement la sévérité de la maladie, l'immunodépression[112], la malnutrition[113], l'amygdalectomie[114], l'activité physique suivant immédiatement la survenue de la paralysie[115], l'injection intramusculaire de vaccins ou de médicaments[116] et la grossesse[117] ont été cités. Bien que le virus franchisse le placenta durant la grossesse, le fœtus semble n'être atteint ni en cas d'infection maternelle ni en cas de vaccination[118]. Les anticorps maternels franchissent également la barrière placentaire, apportant au fœtus une immunité passive protectrice durant la grossesse et les premiers mois de la vie[119].
Infection
Le poliovirus pénètre dans l'organisme par la bouche et infecte les premières cellules avec lesquelles il rentre en contact dans le pharynx puis dans la muqueuse intestinale. Il infecte les cellules par l'intermédiaire d'une glycoprotéine transmembranaire de la famille des immunoglobulines située à la surface de la cellule, le récepteur CD155 ou récepteur du poliovirus[120]. Le virus prend alors le contrôle des processus génétiques de la cellule hôte et débute sa réplication. Le poliovirus se multiplie au sein des cellules gastro-intestinales durant une semaine environ, puis migre vers les amygdales (spécifiquement les cellules dendritiques folliculaires des centres germinaux amygdaliens), le tissu lymphoïde intestinal (dont les cellules M des plaques de Peyer) et les ganglions lymphatiques cervicaux et mésentériques, où il se multiplie activement. Le virus peut alors passer dans la circulation[121].
La phase de circulation sanguine du virus, ou virémie, permet sa distribution à différents sites de l'organisme. Le poliovirus peut survivre et se multiplier dans le sang et dans la lymphe pendant des périodes prolongées allant parfois jusqu'à 17 semaines[122]. La virémie est responsable du syndrome grippal généralement observé dans la première phase des infections à poliovirus symptomatiques. Dans une faible proportion de cas, le virus peut migrer et se répliquer dans le tissu adipeux, le système réticuloendothélial et les muscles[123]. Le passage du virus dans le système nerveux central est responsable d'une réponse inflammatoire locale. Dans la plupart des cas celle-ci est limitée aux méninges et définit une méningite aseptique non paralytique[1]. L'infection du parenchyme cérébral définit une encéphalite aiguë. Le mécanisme par lequel le poliovirus infecte le système nerveux central n'est pas entièrement élucidé, mais il semble indépendant de l'âge, du sexe et du niveau socioéconomique du sujet[124].
Immunisation
Le contact avec le virus (par infection ou par vaccination) est immunisant. Chez les sujets immunisés, des anticorps de type IgA sont sécrétés au niveau des amygdales et de la muqueuse digestive qui sont capables de bloquer la réplication virale. Les IgG et IgM sont protecteurs vis-à-vis de l'atteinte du motoneurone[108]. L'infection ou la vaccination par un sérotype de poliovirus n'immunise pas contre les deux autres, l'immunité complète requiert donc l'exposition à chaque sérotype[108].
Formes cliniques
Traduction clinique de l'infection Traduction Proportion de cas[125] Asymptomatique 90–95% Symptômes mineurs 4–8% Méningite aseptique
non-paralytique1–2% Poliomyélite paralytique 0.1–0.5% — Polio spinale 79% des cas paralytiques — Polio bulbospinale 19% des cas paralytiques — Polio bulbaire 2% des cas paralytiques Chez la plupart des sujets immunocompétents l'infection à poliovirus reste asymptomatique, les anticorps neutralisants sécrétés au niveau digestif assurant un rôle protecteur vis-à-vis du virus. Le terme poliomyélite se réfère à une infection symptomatique causée indistinctement par les trois sérotypes de poliovirus. Deux formes principales d'infection symptomatique sont décrites : une forme extra-neurologique parfois qualifiée de « poliomyélite abortive » (97 % des cas) d'évolution le plus souvent favorable, et une forme neurologique avec atteinte du système nerveux central (3 % des cas environ) qui peut être paralytique ou non paralytique[126].
Formes extra-neurologiques
Si le virus franchit la barrière digestive, l'infection se traduit par des manifestations générales mineures et non spécifiques allant de l'infection des voies respiratoires (maux de gorge, toux, fièvre) aux signes digestifs (nausées, vomissements, douleurs abdominales, constipation ou, rarement, diarrhée) en passant par le syndrome grippal[125]. Myocardite et péricardite sont possibles et parfois associées[8].
Formes neuroméningées non paralytiques
Le virus atteint le système nerveux central dans environ 3 % des cas, parmi lesquels une majorité développe un syndrome méningé fébrile (céphalées, douleurs cervicales et dorsales, fièvre, nausées, vomissements, léthargie) traduisant une méningite à liquide céphalo-rachidien clair, d'évolution favorable. L'absence de paralysie est alors la règle[1],[127]. Les formes encéphalitiques sont rares et surviennent presque exclusivement chez les nourrissons, s'accompagnant d'une fièvre élevée, de modifications du comportement, de crises convulsives généralisées et de paralysie spastique[128]. Une paralysie faciale périphérique isolée est possible[8].
Poliomyélite antérieure aiguë
 La dénervation du tissu musculaire squelettique secondaire à l'infection par le poliovirus peut conduire à la paralysie.
La dénervation du tissu musculaire squelettique secondaire à l'infection par le poliovirus peut conduire à la paralysie.
Entre 1 sujet sur 200 et 1 sujet sur 1 000 évolue vers une maladie paralytique qui se traduit par la survenue d'une faiblesse musculaire croissante jusqu'à la paralysie complète. Après incubation, la maladie se traduit par un syndrome infectieux fébrile non spécifique (pharyngite, troubles digestifs) suivi de l'installation rapide, en quelques heures, de paralysies flasques sans atteinte sensitive. L'atteinte est toujours asymétrique[8].
Le poliovirus migre le long des trajets nerveux et atteint les motoneurones de la corne antérieure de la moelle épinière, du tronc cérébral ou du cortex moteur dans lesquels il se réplique et qu'il détruit. La paralysie qui en résulte définit la poliomyélite paralysante, dont les diverses variantes (spinale, bulbaire, spinobulbaire) diffèrent par l'étendue des dommages causés aux motoneurones, par l'inflammation subséquente et par les régions du système nerveux central qui sont touchées. Les lésions s'étendent au ganglion spinal, parfois à la formation réticulée, aux noyaux vestibulaires, au vermis cérébelleux et aux noyaux gris centraux[124]. L'inflammation associée à la destruction neuronale altère souvent la couleur et l'apparence de la substance grise de la moelle épinière, qui apparaît rougeâtre et tuméfiée[1]. Des lésions du prosencéphale sont également associées à la poliomyélite paralytique, touchant particulièrement le thalamus et l'hypothalamus[124]. Les mécanismes moléculaires qui conduisent à la paralysie restent mal compris.
La propension à développer une poliomyélite paralytique augmente avec l'âge, de même que le risque de paralysie étendue. Chez les enfants, la méningite non paralytique est la conséquence la plus fréquente de l'infection du système nerveux central. La paralysie ne survient que dans 1 cas sur 1 000 et, avant l'âge de cinq ans, ne concerne généralement qu'un membre inférieur. Chez l'adulte, la paralysie survient dans 1 cas sur 75[129]. Elle s'étend plus volontiers aux muscles du thorax et de l'abdomen, voire aux quatre membres (quadriplégie)[130]. Le taux de paralysie varie également selon le sérotype viral. Ainsi le poliovirus 1 en est-il le premier pourvoyeur (1 cas sur 200) devant le PV3 et le PV2 (1 cas sur 2 000)[131].
Symptomatologie précoce
La poliomyélite antérieure aiguë se traduit par une symptomatologie précoce qui associe fièvre élevée, céphalées, raideur cervicale et dorsale, myalgies, faiblesse asymétrique de plusieurs muscles, sensibilité au toucher, troubles de la déglutition, disparition des réflexes ostéo-tendineux, paresthésies, irritabilité, constipation, difficultés mictionnelles. La paralysie survient en général un à dix jours après le début des symptômes, progresse durant deux ou trois jours, et cesse de s'étendre au moment de la défervescence[132].
Poliomyélite spinale
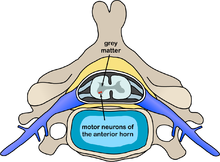
Localisation des motoneurones (en rouge) dans la corne antérieure du cordon médullaire (ici en région cervicale).
La poliomyélite spinale est la forme la plus courante de poliomyélite paralytique. Elle résulte de l'invasion par le poliovirus des motoneurones de la corne antérieure de la moelle épinière (partie ventrale de la substance grise), qui véhiculent l'ordre transmis par le cortex moteur et sont responsables des mouvements. Les nerfs moteurs spinaux innervent les muscles du tronc (dont les muscles intercostaux et le diaphragme) et des membres[133].
L'infection virale cause une inflammation des cellules nerveuses, conduisant à la destruction partielle ou totale du ganglion des motoneurones. La mort des motoneurones entraîne leur dégénérescence wallérienne[134]. Les cellules musculaires ne recevant plus de signaux en provenance du cortex moteur ni de la moelle épinière s'atrophient, s'affaiblissent et deviennent rapidement inactives[133]. La destruction partielle totale de l'innervation d'un muscle détermine l'intensité de sa paralysie. L'évolution vers une paralysie maximale est rapide (deux à quatre jours) et s'associe généralement à une fièvre et des myalgies[134]. L'arc du réflexe myotatique étant interrompu, les réflexes ostéo-tendineux sont abolis. En revanche, l'intégrité des nerfs sensitifs permet la préservation de la somesthésie[134].
La distribution de la paralysie spinale dépend de l'étage médullaire atteint, qui peut être cervical, thoracique, lombaire ou combiné[135]. L'atteinte peut être bilatérale, mais elle est toujours asymétrique[8]. La paralysie est souvent plus marquée pour les muscles proximaux (proches de la racine des membres) que pour les muscles distaux (doigts et orteils)[121].
Poliomyélite bulbaire
La poliomyélite bulbaire représente 2 % des cas de poliomyélite paralytique. Elle est la conséquence de l'invasion et de la destruction par le poliovirus des motoneurones de la région bulbaire du tronc cérébral[125] qui entraîne la paralysie des muscles innervés par les nerfs crâniens, des signes d'encéphalite, des difficultés respiratoires, des troubles de la phonation et de la déglutition[127]. Les trois nerfs crâniens les plus critiques sont le nerf glossopharyngien (IXe paire), qui contrôle les mouvements de l'oropharynx et la déglutition, le nerf vague (Xe paire) qui joue notamment un rôle majeur dans la phonation et le nerf accessoire (XIe paire) qui innerve le sterno-cléido-mastoïdien et le trapèze. L'atteinte du nerf trijumeau (Ve paire) et du nerf facial (VIIe paire) expose à des troubles de la mastication et à une paralysie faciale. L'atteinte des nerfs oculomoteurs (IIIe et VIe paires) entraîne une diplopie.
Poliomyélite spinobulbaire
Forme combinée des deux précédentes, la poliomyélite spinobulbaire représente 19 % des cas de poliomyélite paralytique. Elle est parfois qualifiée de poliomyélite respiratoire[125]. Le virus s'attaque à la partie supérieure de la moelle cervicale (de C2 à C5) exposant à la paralysie diaphragmatique par atteinte du nerf phrénique. Cette forme redoutable peut ainsi nécessiter le recours à la ventilation mécanique. Elle peut conduire également à la paralysie des membres, à des troubles de la déglutition et de la fonction cardiaque[136].
Chez les singes
L'homme est le seul hôte naturel connu chez qui le virus provoque la maladie, ce qui a permis d'envisager un programme d'éradication. Si dès 1909 il fut établi que les singes de certaines espèces pouvaient développer la maladie suite à des inoculations, il fallu du temps pour déterminer non seulement la sensibilité de chaque espèce de singe au virus - et à ses différents sérotypes - mais aussi pour savoir s'ils peuvent héberger le virus et être source de contagion en conditions naturelles : en 1948 cet inventaire n'était pas encore achevé[137],[138].
Les singes et les chimpanzés développent une paralysie lorsque le virus est inoculé dans leur cerveau ou leur moelle épinière. Les chimpanzés et les singes Cynomolgus (macaques crabiers) peuvent être infectés par la voie orale, mais ne présentent qu'exceptionnellement des signes cliniques. Ils peuvent parfois développer une virémie et en des cas très rares une paralysie[139]. Une poliomyélite paralytique a été décrite chez des chimpanzés, des orang-outans et des gorilles en captivité, ainsi que chez des chimpanzés sauvages. Cependant, ces espèces sont probablement des hôtes accidentels et leurs populations vivant à l’état sauvage sont trop petites et trop dispersées géographiquement pour pouvoir permettre la transmission du poliovirus ou constituer une menace de réintroduction du virus dans les populations humaines une fois éradication obtenue[140].
Les singes rhesus - Macaca Mulatta - font partie de ces rares espèces de singes qui ne développent pas d'infection suite à l'ingestion du poliovirus (qui ne se développe tout simplement pas dans son appareil digestif). Si Flexner a défendu son hypothèse erronée de neurotropisme exclusif, c'est en grande partie du au fait qu'il avait justement expérimenté sur ces singes rhesus[141].
Les singes ont été utilisés en grand nombre : dans les années 1950 quelques dizaines de milliers de Singe rhésus et cynomolgus étaient importés chaque année d'Inde et d'Indonésie vers les États-Unis et l'Europe. Le SV40 infectant les Maccacus rhesus importés d'Inde et les Maccacus cynomolgus importés d'Indonésie mais pas les singes africains, ces derniers ont commencé à être utilisés couramment dans la production des vaccins polio à compter des années 1960. Le singe Mac. cynomolgus (qui possède un système nerveux central très sensible à l'inoculation intracérébrale du poliovirus) continua cependant à être utilisé pour le contrôle des vaccins et pour les études de neurovirulence[142].
Dans la deuxième moitié des années 1950, tous les vaccins étaient préparés sur une culture de cellules de reins de singes. Si la plupart des concepteurs de vaccins firent clairement connaître l'espèce de singe utilisée[143], Hilary Koprowski fut moins explicite : Edward Hooper en tira argument dans la controverse sur l'origine du SIDA[144].
NB : Ce qui est désigné par goat polio en anglais, désigne la polioencéphalomalacie[145] une maladie métabolique qui affecte non seulement les moutons et les chèvres (ainsi que les camélidés le wapiti et le chevreuil) mais aussi les bovins[146]. Des sérums neutralisant le poliovirus ont été retrouvés chez d’autres vertébrés, par exemple chez des vaches, des chevaux, des poulets, des chiens, des chèvres et des moutons, mais sans qu’il y ait des signes d’infection[140].Évolution
La guérison est la règle chez les sujets porteurs d'une poliomyélite abortive. En cas de méningite aseptique les symptômes peuvent persister de deux à dix jours mais l'évolution est presque toujours favorable[147]. En cas de poliomyélite spinale, la paralysie est définitive si l'innervation motrice du muscle est entièrement détruite. Les cellules endommagées mais survivantes peuvent récupérer une partie de leur fonctionnement quatre à six semaines après les premiers signes[147] La moitié des patients atteints de poliomyélite spinale récupère totalement, un quart récupère avec des séquelles modérées et un quart présente un handicap sévère[148]. Le degré de paralysie à la phase aiguë et de paralysie résiduelle semble proportionnel à l'intensité de la virémie, et inversemment proportionnel au degré d'immunité[124]. La poliomyélite spinale est rarement mortelle[132].
En l'absence d'assistance respiratoire, les formes s'accompagnant d'atteinte respiratoire évoluent vers les pneumopathies d'inhalation et vers l'asphyxie[149]. Au total, 5 à 10 % des poliomyélites paralytiques évoluent vers la mort par paralysie des muscles respiratoires. Le taux de mortalité varie selon l'âge : 2 à 5 % des enfants, 15 à 30 % des adultes décèdent des suites de la maladie[125]. La [[Poliomyélite#Poliomyélite bulbaire|polio bulbaire est la plus meurtrière, constamment mortelle en l'absence de traitement et d'assistance respiratoire[136] et tuant 25 à 75 % des patients pris en charge[125],[150]. La ventilation mécanique en pression positive, méthode de ventilation artificielle de référence à l'heure actuelle, permet de réduire la mortalité à 15 %[151].
Diagnostic
Diagnostic clinique
Le diagnostic différentiel est très difficile dans les formes non paralytiques, la polio passant souvent pour une infection banale rhino-pharyngée ou digestive. La poliomyélite paralytique est cliniquement suspectée devant la survenue aiguë de paralysies flasques d'un ou de plusieurs membres avec diminution ou abolition des réflexes ostéo-tendineux, sans atteinte sensitive ni trouble des fonctions cognitives, et après exclusion d'une autre cause notamment inflammatoire (syndrome de Guillain-Barré, myélite aiguë transverse) ou mécanique (compression médullaire ou radiculaire, traumatisme)[152]. Le diagnostic est évoqué facilement chez les autochtones des zones endémiques, plus rarement chez les sujets voyageurs non immunisés.
Diagnostic biologique
L'analyse du liquide céphalo-rachidien (LCR) recueilli par ponction lombaire révèle un liquide clair, une hypercytose[153] modérée à prédominance de lymphocytes, une glycorachie normale, une protéinorachie normale ou modérément augmentée, traduisant une méningite aseptique. Répété 15 jours plus tard, l'examen montre généralement une régression du nombre de cellules et une majoration de la protéinorachie[8]. Le recours à la ponction lombaire n'est toutefois pas dénué de risque, notamment en période épidémique avérée[154].
La sérologie polio est sensible et précoce[125], mais le diagnostic de certitude nécessite la mise en évidence directe du poliovirus sur un écouvillonnage pharyngé, dans les selles ou dans le LCR[8]. Celle-ci n'est pratiquée que de façon exceptionnelle en zone d'endémie car coûteuse et non indispensable. Elle s'avère nécessaire en revanche dans les cas douteux, et particulièrement dans les régions où la maladie a disparu. L'identification du matériel génétique viral par Polymerase chain reaction (PCR) permet en outre de distinguer les souches sauvages des souches vaccinales utilisées pour la vaccination orale[155]. Cette distinction est importante puisque pour chaque cas rapporté de poliomyélite paralytique, on estime qu'il existe 200 à 3 000 autres cas asymptomatiques mais contagieux[156].
Traitement
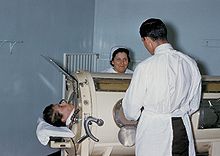 Patient souffrant de la polio placé dans un respirateur artificiel à pression négative (poumon d'acier).
Patient souffrant de la polio placé dans un respirateur artificiel à pression négative (poumon d'acier).
Il n'existe pas de traitement curatif de la poliomyélite. Les formes extra-neurologiques et les méningites aseptiques, si elles sont diagnostiquées comme telles, ne relèvent que de mesures symptomatiques. En cas de poliomyélite paralytique, les objectifs de la prise en charge thérapeutique portent sur l'atténuation des symptômes, l'accélération de la récupération et la prévention des complications. Le traitement comporte des antalgiques pour lutter contre la douleur, des antibiotiques pour traiter les surinfections bactériennes, l'exercice physique modéré et un régime alimentaire adapté[15]. Le traitement de la poliomyélite nécessite souvent une convalescence prolongée assortie d'une rééducation physique, de l'utilisation de prothèses, de chaussures orthopédiques et, dans certains cas, d'interventions orthopédiques[135].
Historiquement, les atteintes les plus sévères avaient recours à la ventilation non invasive à pression négative, plus communément appelée poumon d'acier, cette méthode permis à des milliers de patients d'être ventilés de façon acceptable dans l'attente de la récupération d'une autonomie respiratoire (généralement au bout d'une à deux semaines dans les meilleurs cas). Lors de la grande épidemie de polio au Danemark (1952), le médecin anéthesiste danois Björn Ibsen developpa l'assistance respiratoire à long terme par ventilation invasive à pression positive (d'abord) manuelle à l'aide d'un insufflateur[157]. Le taux de mortalité des patients tomba de 87% à env. 25% en l'espace de quelques semaines[158]. Depuis, les patients atteints de détresse respiratoire, nécessitent une prise en charge réanimatoire et peuvent nécessiter l'assistance ventilatoire à domicile à l'aide de respirateurs artificiels portatifs.
Prévention
La prévention non spécifique repose essentiellement sur le respect des règles d'hygiène alimentaire et sur la propreté des mains. Avant la Seconde Guerre mondiale, et surtout immédiatement après, la sérothérapie fut un moyen de prévention spécifique vite abandonné avec l'arrivée des vaccins, aujourd'hui seule prévention existante. L'utilisation du Pleconaril semblerait toutefois offrir de nouvelles possibilités.
Très tôt on essaya de mettre au point un vaccin. En 1913 Römer et Flexner s'inspirèrent du vaccin antirabique de Pasteur ; puis il y eut Maurice Brodie et John Kolmer, Jungeblut et Sanders[159], Blanc et Martin en 1950, et Alexandre Jezierski[160]. Différentes modalités de sérovaccination furent même envisagées[161]. Ce n'est que dans les années 1950 que les conditions scientifiques, techniques mais aussi financières furent réunies pour la réalisation de vaccins suffisamment surs et efficaces : vaccin de Salk d'abord (suivi en France par celui de Pierre Lépine), puis celui de Sabin (précédé par celui de Koprowski et concurrent de celui de H.R. Cox[162]).
En France, l'obligation vaccinale concernant la poliomyélite a été instituée par la loi n° 64643 du 1er juillet 1964 et par plusieurs décrets d'application comme celui n° 65213 du 19 mars 1965[163].
Deux vaccins antipoliomyélitiques sont disponibles : l'un inactivé administré par injection sous-cutanée ou intra-musculaire, l'autre vivant atténué administré par voie orale. Les deux confèrent une immunité efficace contre l'infection à poliovirus et préviennent sa transmission de personne à personne. Ils permettent ainsi la protection individuelle et l'immunité collective[164].
Vaccin inactivé
 La vaccination avec le VPTI débute en Suède en 1957
La vaccination avec le VPTI débute en Suède en 1957
Le vaccin antipoliomyélitique inactivé (VPI), ou à virus tué (souche Salk), injectable par voie intramusculaire (de préférence) ou sous-cutanée.
Le vaccin Salk VPTI[165] fut développé en 1952 par Jonas Salk et officiellement annoncé le 12 avril 1955[166], jusqu'en 1993 (où il est remplacé par le VPI (amélioré))[165]. Il est élaboré à partir de poliovirus cultivés sur lignée cellulaire simienne, puis inactivés chimiquement par le formaldéhyde[108]. Il confère une immunité protectrice chez 90 % des sujets après deux injections et chez plus de 99 % des sujets après trois injections[125]. Trivalent, il protège contre les trois souches de poliovirus (PV1, PV2, PV3). Il peut être administré à partir de l'âge de six semaines[167].
Ce vaccin induit essentiellement une immunité sérique mais peu, voire aucune, immunité locale : il n'a de ce fait qu'un effet très limité sur la multiplication intestinale, sur l'excrétion du virus, et donc sur le nombre potentiel de porteurs du virus[168]. Nécessitant en outre des injections de rappel, et d'un coût supérieur au vaccin vivant atténué, le VPI, quoique développé plus tôt, a vite été éclipsé par le vaccin oral, pour redevenir le plus utilisé dans les pays industrialisés (éventuellement associé au VPO)[169].
Malgré la faible immunité locale induite, le VPI s'est montré capable d'éliminer la poliomyélite dans les pays industrialisés qui l'ont utilisé exclusivement (Pays-Bas, Suède et Finlande)[170].
Depuis 1993, on utilise le Salk VPI (amélioré), un vaccin trivalent inactivé cultivé sur cellules diploïdes humaines. Il existe également depuis 2007, Imovax® Polio[165], un vaccin trivalent inactivé cultivé sur cellules Vero.
Ce vaccin (VPI) est à utiliser en cas de risque imminent d’exposition au poliovirus, comme première intention, et non pour lutter contre une apparition de la maladie (épidémie)[171].
Contre-indications et effets indésirables du VPI
Contre-indications :
- Attendre la guérison de toute maladie aiguë, notamment une maladie fébrile, avant l'injection du vaccin.
- Réaction immunitaire négative chez certaines personnes immunodéprimées
- Éviter chez la femme enceinte, mais non contre-indiqué (après le premier trimestre de grossesse) d'après le Comité consultatif national de l’immunisation (CCNI)
- Ne pas administrer, chez les sujets sensibles, en cas d'allergies à certaines substances composant le vaccin (albumine sérique bovine, polymyxine B, néomycine, formaldéhyde, phénylalanine, 2-Phénoxyéthanol, streptomycine, polysorbate 80), et de réaction allergique ou anaphylactique à une dose précédente
- Comme pour tous les autres vaccins, l’immunisation peut ne pas fonctionner
Effets indésirables du Salk VPI[165] (1993-), cultivé sur cellules diploïdes[171] :
- Réactions localisées au point d’injection survenant le soir même : rougeur 14%, induration 4%, douleur ou gêne 12%
Effets indésirables de l'Imovax® Polio[165] (VPTI)(2007-), cultivé sur cellules rénales de singe (Vero)[172] :
- Réactions localisées à l'endroit de l’injection, sur 395 patients : rougeur de 0,7 à 2,4%, induration 0,4%, et douleur de 0,7% à 34%
- Fièvre supérieure à 38,1° souvent ou très souvent, sur 205 enfants : 10% après la 1re dose, 18% à la 2e dose, et 7% à la 3e)
Les cas signalés après la commercialisation du vaccin sont très rares, ils représentent moins de 0,01%.
D'après l’Institute of Medicine (IOM) des États-Unis (NAS), aucun événement indésirable grave n’a été associé au vaccin[171]. Mais il existe une relation temporelle entre un vaccin inactivé et le syndrome de Guillain-Barré, et le décès de nourrissons, bien qu’aucune relation de cause à effet n’ait été établie[172].
Vaccin vivant atténué
- Le vaccin antipoliomyélitique oral (VPO), buvable, est un vaccin vivant (souche Sabin) qui a été mis au point en 1957 par Albert Sabin. Il utilise un poliovirus vivant mais atténué par un passage répété dans des cellules non humaines à des températures infra-physiologiques[173]. Il a été testé dès 1957 et a été autorisé en 1962[174]. Administré par voie orale, il reproduit une infection digestive à bas bruit et entraîne la synthèse active d'anticorps protecteurs par la barrière digestive. La souche vaccinale est incapable de se répliquer efficacement dans le tissu nerveux chez le sujet immunocompétent[175].
Il existe les vaccins antipoliomyélitique oraux monovalent (VPOm) spécifiques contre les poliovirus sauvages de type 1 (VPOm1), 2 (VPOm2)[176], et 3 (VPOm3)[177].
- Le vaccin antipoliomyélitique oral trivalent (VPOt), contre les 3 types de poliovirus sauvages, est d'efficacité comparable au vaccin atténué VPO (95 % de protection après trois doses). Il peut être administré dès la naissance[167]. Peu coûteux, efficace et facile à administrer, le vaccin oral est le mieux adapté à la vaccination de masse et est le plus employé dans le monde, particulièrement dans les pays en voie de développement[178]. Des phénomènes d'interférence virale sont parfois responsables d'échecs[179].
- Le vaccin antipoliomyélitique oral bivalent (VPOb), contre les sérotypes 1 et 3, d'après des données de l'OMS en 2009, donne des résultats similaires au VPOm, mais est plus efficace que le VPOt sur ces 2 types de virus[177].
Le vaccin antipoliomyélitique oral (VPO) est le seul vaccin approprié, et recommandé, pour arriver à une éradication des poliovirus sauvages à travers le monde, alors il pourra être remplacé par le VPI après l'arrêt, à l'échelle mondiale, de cette transmission de poliovirus, vaccin qui ne présente pas les rares effets indésirables du VPO (PPAV, PDSVc), malgré un faible risque de possibilité de naissance de poliovirus dérivé d’une souche vaccinale incluant alors une contagion[180].
Contre-indications et effets indésirables des VPO
Ils sont contre-indiqués, comme tout vaccin vivant, chez les sujets immunodéprimés et chez les femmes enceintes[125].
Effets indésirables :
- Une poliomyélite paralytique associée au vaccin (PPAV) survient dans près de 4 cas sur 1 000 000 par an (exemple pour les parents et travailleurs des services à l’enfance non immunisés : risque minime de transmission de la maladie paralytique associée au VPO lors de la vaccination des nourrissons[171])
- Le poliovirus dérivés de souches vaccinales circulants (PVDVc) est un risque important de défauts d’immunité : les virus issus du vaccin peuvent acquérir les caractéristiques de neurovirulence et transmettre le poliovirus sauvage provoquant une contagion.
- Les poliovirus dérivés de souches vaccinales associés à une immunodéficience (PVDVi), chez un petit nombre de personnes présentant une hypogammaglobulinémie commune d'expression variable.
À cause des risques décrits ci-dessus, certains pays ont choisi d'abandonner le VPO, assez bon marché et facile d'utilisation, pour le vaccin antipoliomyélitique inactivé (VPI), plus coûteux[181].
Épidémiologie
Facteurs de risque
- l'âge : la polio touche plus fréquemment les sujets jeunes et les enfants ;
- le sexe : la polio touche plus les hommes que les femmes ;
- la grossesse ;
- l'exercice musculaire et fatigue musculaire ;
- les injections intramusculaires[182][réf. à confirmer] ;
- les déficits immunitaires congénitaux ;
- l'amygdalectomie ;
- des facteurs génétiques (chromosome 19).
Programme d'éradication
En 1985, la section régionale de l'OMS, the Pan American Health Organization (PAHO)décide d'éradiquer la polio des Amériques[183]. En 1988, la Quarante et Unième Assemblée mondiale de la Santé, composée alors des délégués de 166 États membres, a adopté une résolution visant l’éradication de la poliomyélite dans le monde. C’est ainsi que l’Initiative mondiale pour l’éradication de la poliomyélite est née, sous la direction de l’Organisation mondiale de la Santé (OMS), de l’UNICEF, des Centers for Disease Control and Prevention des États-Unis d’Amérique (CDC) et du Rotary International (Global Polio Eradication Initiative) Cette initiative a été mise sur pied à la suite de la certification de l’éradication de la variole en 1980, des progrès accomplis au cours des années 1980 grâce aux opérations d’élimination du poliovirus dans les Amériques et de l’engagement pris par Rotary International de mobiliser des fonds pour protéger tous les enfants de cette maladie. Cette initiative a été lancée en vue d'éradiquer la poliomyélite vers l'année 2005. La cible a été secondairement retardée à 2010.
La surveillance de la poliomyélite, s’effectue grâce à un réseau de laboratoires qui recherchent les poliovirus sauvages chez tous les enfants de moins de 15 ans atteints de paralysie flasque aiguë (PFA), le symptôme qui caractérise la maladie[184]. La PFA pouvant être le symptôme d'autres maladies, des échantillons de selles doivent être rapidement prélevés et analysés en laboratoire pour confirmer la cause de la paralysie .
En France, le dernier cas de polio autochtone remonte à 1989. Puis un autre cas, importé, fut déclaré en 1995. Entre 1979 et 1986, il y eut 11 cas associés au vaccin oral (six étant survenus après la première dose vaccinale et le risque avait été évalué à 3 sur 10 millions de doses). Aucun nouveau cas n’est apparu depuis 1986[13].En 1992 est découvert un foyer de polio aux Pays-Bas, dans un groupe qui refuse la vaccination.
Fin 1999 le nombre de cas avait reculé de 95 % avec 7 094 nouveaux cas recensés pour 20 000 malades au total et le nombre de pays atteints est passé de 125 à 30, disparaissant de tout le continent américain, du Pacifique occidental, de la Chine et de l'Europe.
L'année 2004 a connu une augmentation des cas de polio (1 300 contre 800 en 2003). Le nombre de cas déclaré en 2005 atteint 1 650 et dépasse 1 760 cas en 2006[185].
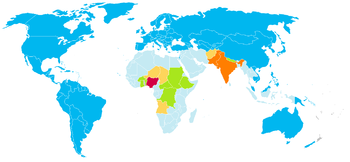
La maladie reste un important problème de santé publique pour de nombreux pays d'Afrique et d'Asie, où elle reste présente de manière préoccupante en Afghanistan, en Égypte, en Inde (plus de 500 cas en 2006), au Niger, au Nigeria (près de 1 000 cas en 2006) et au Pakistan.
Les causes de cette stagnation, voire de cette régression sont complexes. Elles sont dues aux problèmes récurrents d'accès à l'eau potable, à l'insalubrité, ainsi qu'au retard pris par les campagnes de vaccination dans deux États (État de Kano et Zamfara) au Nord du Nigeria, où les responsables lancent des rumeurs accusant les Américains de vouloir les contaminer par le SIDA et de les rendre stériles.
La maladie est également réapparue en Indonésie ; 225 cas ont été diagnostiqués en 2004. Une grande campagne de 24 millions de vaccinations en un jour a été réalisée le 29 août 2005 avec une mobilisation médiatique sans précédent dans le pays. Le dernier cas décrit dans ce pays date de février 2006.
Pour mettre en œuvre l’effort intensifié d’éradication de la poliomyélite en 2007-2008, le financement classique par les partenaires de l’aide au développement a été largement complété par des ressources intérieures des pays d’endémie restants. Le gouvernement indien a engagé, le lendemain de l’adoption de l’effort intensifié d’éradication de la poliomyélite en 2007-2008. Le gouvernement du Nigéria a annoncé en 2007 son intention de verser US $ 32 millions en faveur de son programme national d’éradication de la poliomyélite et a versé, en décembre 2008, US $ 19 millions sur le montant qu’il s’était engagé à verser. Le gouvernement pakistanais s’est engagé à verser US $ 35 millions sur ses ressources intérieures pour le VPO (vaccin antipoliomyélitique oral) à l’occasion des activités de vaccination supplémentaires en 2008, tout en étudiant des modalités pour pouvoir apporter un financement supplémentaire du VPO en 2009-2010. Exprimant leur confiance dans l’effort intensifié d’éradication, le Rotary International et la Fondation Bill & Melinda Gates ont annoncé en novembre 2007 un partenariat destiné à injecter US $ 200 millions dans l’Initiative Le 21 janvier 2009, une deuxième contribution a été annoncée par ces organisations du secteur privé, revenant à ajouter US $ 355 millions à leur contribution initiale. La contribution du Rotary à l’Initiative, grâce à ce partenariat de financement, dépassera US $ 1,2 milliard[186]. Les cas sont essentiellement confinés géographiquement aux endroits où la couverture vaccinale est sub-optimale (30 % d'enfants non vaccinés au Nigéria, les cas indiens étant limitées également à une région réticente aux vaccinations). La présence de cas sporadiques chez des personnes dûment vaccinées soulève des questions[187].
On a observé[188] en 2009-2010 une forte recrudescence des cas au Tadjikistan (pays récemment encore certifié indemne de polio, devenu le premier pays à voir ressurgir la maladie, avec 75 % des cas de poliomyélite recensés dans le monde ; taux très supérieur à celui relevé en Inde et au Nigeria). Le taux de vaccination était au Tadjikistan d'environ de 75 % mais diminue suite à des doutes de la population sur la sécurité de la vaccination, notamment portés par des courants religieux ou anti-gouvernementaux. L'OMS y encourage une campagne de vaccination et certains auteurs craignent une diffusion du virus vers d'autres régions du monde (en Ontario,le taux de vaccination est comparable à celui du Tadjikistan)[188]. L'OMS recommande un taux de 90 % de vaccination des populations, qui n'est plus atteint dans beaucoup de pays riches[188], alors même que le tourisme se développe dans certains pays à risque.
Syndrome post-polio
Trente à quarante ans après la phase aiguë de la maladie, alors que leur état général est depuis longtemps stabilisé, les malades peuvent ressentir une grande fatigue, une faiblesse musculaire progressive et des douleurs articulaires. Parfois ces symptômes s'accompagnent de difficultés respiratoires ou d'atrophie musculaire : c'est le syndrome post-polio, décrit pour la première fois par les neurologues Jean-Martin Charcot et Fulgence Raymond en 1875, mais qui n'a été ainsi nommé que dans les années 1980[13]. Il toucherait un survivant sur deux. En 2002, 55 000 personnes auraient des séquelles de polio en France, 700 000 en Europe et plus d'1 million aux États-Unis[189] .
Le Dr Richard L. Bruno signale la similarité du syndrome post-polio avec le syndrome de fatigue chronique qui serait selon lui la conséquence d'une infection préalable par un poliovirus ayant entraîné une poliomyélite non paralytique (le syndrome post-polio étant lui, la conséquence d'une poliomyélite paralytique). Établissant une corrélation entre l'importante augmentation des cas de fatigue chronique d'une part, et la généralisation des vaccins antipolio d'autre part, il fait l'hypothèse que les poliovirus éradiqués auraient laissé place à d'autres virus, causes d'infections symptomatiquement peu spectaculaires mais générant des lésions neurologiques ultérieurement invalidantes[190].
SV40 et vaccins antipoliomyélitiques
Entre 1955 et 1963 des millions de personnes ont été exposées au virus simien SV40 qui était présent dans les vaccins antipoliomyélitiques. Découvert en 1960, ce virus oncogène (qui induit le cancer) très puissant, a été éliminé par la suite des vaccins antipoliomyélitiques. Les conséquences de cette contamination sont à ce jour encore discutées[191].
Coxsackie Virus et autres enterovirus
La découverte par Gibert Dalldorf et Graces M. Sickles en 1948 d'un virus différent du poliovirus, mais pouvant provoquer des paralysies semblables[192], sema brièvement le trouble dans la communauté des chercheurs [on a même pu considérer ces virus Coxsackie comme une variété de virus polio[193]. Ce trouble fut rapidement dissipé par la mise au point et la diffusion des vaccins Salk et Sabin. En 1981 cependant, Sabin lui-même écrivait : « Paralytic poliomyelitis can now be regarded as a clinical-pathological syndrome that is caused by enterovirus, consisting of the three types of polioviruses, and probably 19 other enteroviruses[194] ».
L'existence de ces virus, et le caractère potentiellement très mutagène du poliovirus appellent une réflexion soutenue de la part des responsables du programme d'éradication[195],[196],[197],[198] (des recombinaisons entre des poliovirus -dérivés du vaccin polio oral- et d'autres entérovirus dont les coxsackievirus, ont donné lieu à des épidémies de poliomyélite, notamment à Madagascar[199])
Par ailleurs, le virus du Nil occidental peut aussi générer des paralysies flasques aiguës. On parle alors de West Nile poliomyelitis[200],[201].
Apports de l'étude de la poliomyélite
Au delà de son importante contribution à l'avancée du savoir médical et scientifique dans les domaines de la virologie et de l'immunologie, l'étude de la poliomyélite est aussi à l'origine d'avancées importantes dans le domaine de la rééducation dont profitent aujourd'hui encore par exemple les personnes victimes de traumatisme crânien, d'accidents vasculaires cérébraux ou de maladies neurodégénératives. En France, dans le sillage de la création à Garches en 1949 du Centre national du traitement des séquelles de poliomyélite par le professeur Grossiord (aujourd'hui hôpital Raymond-Poincaré), se sont développés l’hydrothérapie et la balnéothérapie (Leroy-Rennes), la kinésithérapie respiratoire (Goulon-Barrois) ainsi que les transports médicalisés (Cara en 1956). La diffusion et l'amélioration des orthèses des membres et du rachis, l'établissement d'un savoir concernant l'évolutivité de la scoliose et des déformations rachidiennes (Mme Duval-Beaupère) ainsi que la naissance de la chirurgie fonctionnelle (Pol Lecoeur) sont aussi le fruit des efforts déployés à cette époque[100].
L'Association des paralysés de france a été créé en 1933 par la volonté de quatre jeunes gens atteints de poliomyélite[202].
Fabricants des vaccins
Sanofi Pasteur est le premier fournisseur mondial de vaccins polio, que ce soit le vaccin oral ou le vaccin inactivé. La société vient d'obtenir de l'agence française de sécurité sanitaire des produits de santé (AFSSAPS) l'homologation d'un nouveau vaccin polio, le premier à avoir été développé depuis plusieurs dizaines d'années - Vaccin Polio Oral Monovalent 1 ou mOPV1 - qui a été produit sur le site de Val de Reuil[203].
Patients célèbres
- L'empereur Claude a été considéré comme atteint par la poliomyélite par les auteurs du milieu du XXe siècle[204]. Dans la mesure où il ne présentait pas de difformité, on considère actuellement que des troubles pré ou post nataux ont pu lui causer une paralysie partielle[205]. Claude est un prénom épicène issu du latin Claudius signifiant « boîteux », ce qui n'a pas de rapport direct avec l'état physique de l'empereur, puisque ce nom était porté à Rome par ses ancêtres depuis cinq siècles.
- sir Walter Scott[206].il présenta à l'âge de deux ans au cours de sa poussée dentaire « une fièvre sévère qui le priva de la force de sa jambe droite[207] ».
- Franklin Delano Roosevelt pensait avoir été atteint en 1921; il est plus probable qu'il ait souffert d'un syndrome de Guillain-Barré.
- Pierre Fournier
- Dmitri Chostakovitch
- Xavier Haas
- Frida Kahlo
- Itzhak Perlman
- Milton Erickson
- les membres du groupe Israel Vibration
- Guy Crescent
- Arthur C. Clarke
- Francis Ford Coppola
- Pier Giorgio Frassati
- Malek Boutih[208]
- The Goddess Bunny
- Probablement le pharaon Siptah (XIXe dynastie)
Notes et références
- (en)Chamberlin SL, Narins B, The Gale Encyclopedia of Neurological Disorders, Thomson Gale, Detroit, 2005, 1011 p. (ISBN 0-7876-9150-X)
- (fr)(en) [PDF]Progrès vers l’éradication de la poliomyélite en Inde, janvier 2007-mai 2009 Relevé épidémiologique hebdomadaire de l'OMS, no 28, 2009, 84, 281–288
- (en)Cohen JI, Harrison's Principles of Internal Medicine, McGraw-Hill Professional, 16e Édition, 2004, 2607 p. (ISBN 0-0714-0235-7), chap. 175 (« Enteroviruses and Reoviruses »), p. 1144
- (en)Ryan KJ, Ray CG, Sherris Medical Microbiology, McGraw Hill, 4e Édition, 2004, 992 p. (ISBN 0-8385-8529-9), « Enteroviruses », p. 535-7
- (en)Paul JR, A History of Poliomyelitis, Yale University Press, New Haven, Conn, 1971, 496 p. (ISBN 0-300-01324-8), p. 16–18
- Poliomyélite sur Organisation mondiale de la Santé, 2008. Consulté le 22-03-2009
- Éradiquer la polio sur Unicef, 2008. Consulté le 22-03-2009
- E. Pilly, Collège des universitaires de Maladies Infectieuses et Tropicales, Maladies infectieuses et tropicales, Vivactis Plus Ed, Paris, 20e édition, 2006, 747 p. (ISBN 2-9522954-1-7), « Infections à entérovirus », p. 518-19
- Relevé Épidémiologique hebdomadaire, vol. 83, 47 (pp. 421-428) sur Organisation mondiale de la Santé, 21 novembre 2008. Consulté le 25-05-2009
- OMS Europe — Flambée de poliomyélite au Tadjikistan : l’OMS intervient, 23 avril 2010
- Charlene Porter, « Journée mondiale contre la polio 2011 : de nouvelles idées pour combattre une vieille maladie » sur Bureau des programmes d'information internationale du département d'État des États-Unis, 24 octobre 2011. Consulté le 25 octobre 2011
- Trevelyan B, Smallman-Raynor M, Cliff A, « The Spatial Dynamics of Poliomyelitis in the United States: From Epidemic Emergence to Vaccine-Induced Retreat, 1910-1971 », dans Ann Assoc Am Geogr, vol. 95, no 2, 2005, p. 269–293 [lien PMID, lien DOI]
- Poliomyélite un peu d’histoire sur www.post-polio.asso.fr
- www.sante.gouv.fr
- (en) Daniel TM, Robbins FC (editors), Polio, Rochester, N.Y., USA, University of Rochester Press, 1997, 1re éd. (ISBN 978-1-878822-90-1) (LCCN 97018522), « A history of poliomyelitis », p. 5–22
- (fr)Polio Par Thomas M. Daniel,Frederick C. Robbins sur books.google.fr. Consulté le 10 septembre 2010.
- (en)(en) Underwood M, Debility of the lower extremities. In: A treatise on the dieases [sic] of children, with general directions for the management of infants from the birth (1789), vol. 2, Philadelphia, Printed by T. Dobson, no. 41, South Second-Street, 1793 [lire en ligne (page consultée le 2007-02-23)], p. 254–6
- (fr)anthropologie-et-paleopathologie.univ-lyon1.fr
- (en) Gould T, A Summer Plague: Polio and its Survivors, New Haven, Yale University Press, 1995 (ISBN 978-0-300-06292-2) (LCCN 94047253) [lire en ligne], « Chapter One »
- (fr)Infantile paralysis in Massachusetts, 1907-1912 sur www.archive.org
- (fr)Neuropathies périphériques: polyneuropathies et mononeuropathies multiples Par Pierre Bouche sur books.google.fr. Consulté le 10 septembre 2010.
- (en)do not eat those apples; they’ve been on the ground!’: polio epidemics and preventive measures, sweden 1880S-1940S sur asclepio.revistas.csic.es. Consulté le 11 septembre 2010.
- (en)Introduction to Epidemiology Par Ray M. Merrill sur books.google.fr. Consulté le 10 septembre 2010.
- (en)A Summer Plague - Polio and its Survivors By Tony Gould sur www.businessweek.com
- (en)ref : Mailing address: Institut für Virologie der Universität zu Köln, sur jvi.asm.org
- (en)[PDF]Evolution Génétique Du Poliovirus : Succès Et Difficultés De L'éradication De La Poliomyélite Paralytique sur www.revuemedecinetropicale.com
- (fr)[PDF]Brève histoire de la polio Par Christopher J. Rutty, Ph.D. sur polio-vaccine.com
- (en)[PDF]Comparative Virology of Primates1 by S. S. KALTER AND R. L. HEBERLING sur mmbr.asm.org
- Landsteiner K, Popper E. Uebertragung der Poliomyelitis acuta auf Affen. Z Immunitätsforsch. 1909;2:377–390
- (en)Milestones in Early Poliomyelitis Research (1840 to 1949) by Hans J. Eggers sur jvi.asm.org
- Flexner et Lewis The transmission of acute poliomyelitis to monkeys. Journal of the American Medical Association 1909. 53:1639.
- (en)[PDF]The 'American Journal of PubliclHealth. page 994. sur ajph.aphapublications.org
- (en)[PDF]PMC1521302 sur www.ncbi.nlm.nih.gov
- (en)[PDF]Relation of a Streptococcus to Epidemic Poliomyelitis - Studies in Etiology, Diagnosis and Specific Treatment by EDWARD C. ROSENOW, sur jem.rupress.org
- (en)Dirt and disease: polio before FDR Par Naomi Rogers sur books.google.fr. Consulté le 10 septembre 2010.
- PMC112492 sur www.ncbi.nlm.nih.gov
- (fr)[PDF]Brève histoire de la polio Par Christopher J. Rutty, Ph.D. sur www.polio-vaccine.com
- Sabin, A. B., and R. Ward. 1941. The natural history of human poliomyelitis. I. Distribution of virus in nervous and non-nervous tissues. J. Exp. Med. 73:771-793
- (fr)Dirt and disease: polio before FDR Par Naomi Rogers sur books.google.fr. Consulté le 10 septembre 2010.
- Constantin Levaditi (1874-1953) sur www. pasteur.fr
- (en)Section I: Poliomyelitis, Treatment, and Prevention Prior to 1955 sur www.vaccineethics.org. Consulté le 11 septembre 2010.
- (en)[PDF]www.vaccineethics.org Qu’est-ce que la polio ? sur www.vaccineethics.org. Consulté le 11 septembre 2010.
- (fr)Pierre Lépine (1901-1989) sur www.pasteur.fr
- (en)PMC112492 sur www.ncbi.nlm.nih.gov
- (fr)[PDF]historique sur www.polio-vaccine.com
- (en)Further Observations on Vitamin C Therapy in Experimental Poliomyelitis. sur www.ncbi.nlm.nih.gov
- (en)Vitamin C in Relation to Experimental Poliomyelitis With Incidental Observations on Certain Manifestations in Macacus Rhesus Monkeys on a Scorbutic Diet sur www.ncbi.nlm.nih.gov
- (en)The Origin of the 42-Year Stonewall of Vitamin C by Robert Landwehr sur www.seanet.com
- (en)Protective Action of Certain Chemicals Against Infection of Monkeys With Nasally Instilled Poliomyelitis Virus. sur www.ncbi.nlm.nih.gov
- (en)Milestones in Early Poliomyelitis Research (1840 to 1949) by Hans J. Eggers* sur www.ncbi.nlm.nih.gov
- (en)The neutralization of poliomyelitis virus by dog serums by F.B. Gordon sur www.jstor.org
- (en)The Significance of Protection Tests with the Serum of Man and Other Animals against the Lansing Strain of Poliomyelitis Virus sur www.jimmunol.org
- (en)Polio : an American story by David M. Oshinsky
- (en)Race and the Politics of Polio - Warm Springs, Tuskegee, and the March of Dimes sur books.google.fr
- (en)Polio Par Thomas M. Daniel,Frederick C. Robbins sur books.google.fr. Consulté le 22 septembre 2010.
- (en)Cultivation of poliomyelitis virus in cultures of human foreskin and embryonic tissues. sur www.ncbi.nlm.nih.gov. Consulté le 22 septembre 2010.
- (en)Cultivation of the Lansing Strain of Poliomyelitis Virus in Cultures of Various Human Embryonic Tissues. sur www.ncbi.nlm.nih.gov. Consulté le 22 septembre 2010.
- Sabin A B, Olitsky P K. Cultivation of poliomyelitis virus in vitro in human embryonic nervous tissue. Proc Soc Exp Biol Med. 1936;34:357–359
- (en)Milestones in Early Poliomyelitis Research (1840 to 1949) Hans J. Eggers sur www.ncbi.nlm.nih.gov. Consulté le 22 septembre 2010.
- (fr)[PDF]PROPHYLAXIE DE LA POLIOMYELITE sur www.ncbi.nlm.nih.gov. Consulté le 22 septembre 2010.
- (fr)Pierre Lépine (1901-1989) sur www.pasteur.fr. Consulté le 22 septembre 2010.
- (en)The Nobel Prize in Physiology or Medicine 1954 sur nobelprize.org. Consulté le 22 septembre 2010.
- (en)Polio Protection Pill sur www.jstor.org. Consulté le 22 septembre 2010.
- David Bodian, et al.: Differentiation of Types of Poliomyelitis Viruses: III. The Grouping of Fourteen Strains into Three Basic Immunological Types in: American Journal of Hygiene vol. 49, mars 1949
- (en)[PDF]American Journal of Epidemiology sur aje.oxfordjournals.org. Consulté le 22 septembre 2010.
- Hammon W, « Passive immunization against poliomyelitis », dans Monogr Ser World Health Organ, vol. 26, 1955, p. 357–70 [lien PMID]
- Hammon W, Coriell L, Ludwig E, et al, « Evaluation of Red Cross gamma globulin as a prophylactic agent for poliomyelitis. 5. Reanalysis of results based on laboratory-confirmed cases », dans J Am Med Assoc, vol. 156, no 1, 1954, p. 21–7 [lien PMID]
- Rinaldo C, « Passive immunization against poliomyelitis: the Hammon gamma globulin field trials, 1951–1953 », dans Am J Public Health, vol. 95, no 5, 2005, p. 790–9 [lien PMID]
- [PDF]www.nutrapharma.com
- (en)Isabel Morgan, Pioneer of the Killed-Virus Polio Vaccine sur www.findingdulcinea.com. Consulté le 22 septembre 2010.
- On doit rappeler ici que Jonas Salk fut à cette époque le collaborateur de Thomas Francis Jr. qui mit au point le premier vaccin contre la grippe – un vaccin vivant inactivé – en 1944(en)Timeline Development of the Salk Polio Vaccine at the University of Pittsburgh sur www.upmc.com. Consulté le 22 septembre 2010.
- Sutter R, Cochi S, Melnick J. Live attenuated poliovirus vaccines. In:Plotkin S, Orenstein W, eds. Vaccines. 3d ed. Philadelphia: WB Saunders, 1999:364–408
- (en)Ignored, shunned, and invisible: how the label "retarded" has denied freedom ... Par J. David Smit sur books.google.fr. Consulté le 22 septembre 2010.
- (en)Historical aspects of the development of live virus vaccine in poliomyelitis by Hilary Koprowsky sur www.ncbi.nlm.nih.gov, 9/juin/1960. Consulté le 22 septembre 2010.
- (en)PHILADELPHIA INQUIRER sur www.koprowski.net. Consulté le 22 septembre 2010.
- notamment sur des enfants de femmes emprisonnées à Clinton
- (en)“Breaking the back of polio” - In the 1940s, Yale’s Dorothy Horstmann solved a puzzle that would lead to the first polio vaccines 50 years ago this year. sur yalemedicine.yale.edu
- (en)The Victoria Advocate - 21 oct. 1952 : Scientist finds promising vaccine against polio sur news.google.com. Consulté le 22 septembre 2010.
- (en)The end of polio is in sight at last sur books.google.fr. Consulté le 22 septembre 2010.
- (en)Vaccination against Polio Passes Satisfactory Test sur www.jstor.org. Consulté le 22 septembre 2010.
- Jonas E. Salk, MD; MAJ Byron L.Bennett, US Army (ret); L. James Lewis, PhD; Elsie N.Ward, MA; J.S. Youngner, ScD JAMA. 1953;151(13):1081-1098 --- Studies in human subjects on active immunization against poliomyelitis. 1. A preliminary report of experiments in progress. JAMA 151(13): 1081-98, 1953.
- (en)Célébration de 125 ans La Polio aujourd’hui - Vers une éradication mondiale ? sur jamafr.ama-assn.org. Consulté le 22 septembre 2010.
- The Cutter incident, Paul Offit, Yale University Press, ISBN 0-300-10864-8 The Cutter incident sur bmj.bmjjournals.com
- S.A. MEDICAL JOURNAL , 23 June 1956
- (en)[PDF]Trial of living poliovirus vaccine - Combined gastric and duodenal ulcération sur www.bmj.com. Consulté le 23 septembre 2010.
- (fr)Pierre Lépine (1901-1989) sur www.pasteur.fr. Consulté le 23 septembre 2010.
- (en)Competition to develop an oral vaccin sur web.archive.org. Consulté le 23 septembre 2010.
- (en)[PDF]Vaccination with the CHAT strain of type 1 attenuated poliomyelitis virus in Leopoldville, Belgian Cogon. 1960.22. p.203 - 213 sur whqlibdoc.who.int. Consulté le 23 septembre 2010.
- (en)[PDF]Vaccination with the CHAT strain of type 1 attenuated poliomyelitis virus in Leopoldville, Belgian Cogon. 1960.22 p.215 - 234 sur whqlibdoc.who.int. Consulté le 23 septembre 2010.
- (en)[PDF]Vaccination with the CHAT strain of type 1 attenuated poliomyelitis virus in Leopoldville, Belgian Cogon. 1961.24 p.785 - 792 sur whqlibdoc.who.int. Consulté le 23 septembre 2010.
- (en)[PDF]Recent Results of Mass Immunization Against Poliomyelitis With Koprowski Strains Of Attenuated Live Poliovirus by Stanley A. Plotkin, M.D. sur ajph.aphapublications.org. Consulté le 23 septembre 2010.
- Melnick JL. Problems associated with the use of live poliovirus vaccine. Am J Public Health 1960; 50:1013–31
- (en)Gene transfer and expression in mammalian cells, Volume 38 Par Savvas C. Makrides sur books.google.fr. Consulté le 23 septembre 2010.
- (en)Hearings, "bernard greenberg" sur books.google.fr. Consulté le 23 septembre 2010.
- (en)Collection Title: Bernard G. Greenberg Papers, 1945-1982 sur www.lib.unc.edu. Consulté le 23 septembre 2010.
- (en)Dr. Bernard G. Greenberg : a visionary leader sur www.sph.unc.edu, 26 septembre 2008. Consulté le 23 septembre 2010.
- (en)Appendix B - Immunization Time-Line sur www.nap.edu. Consulté le 23 septembre 2010.
- (en)Poliomyelitis Prevention in the United States: Introduction of A Sequential Vaccination Schedule of Inactivated Poliovirus Vaccine Followed by Oral Poliovirus Vaccine ; Recommendations of the Advisory Committee on Immunization Practices (ACIP) sur www.cdc.gov. Consulté le 23 septembre 2010.
- (en)[PDF]Journal officiel du 2 juillet 1964, page 5762 sur www.legifrance.gouv.fr. Consulté le 23 septembre 2010.
- (fr)[PDF]Le syndrome post-poliomyélite mythe ou réalité ? Mémoire du Diplôme d’Etudes Spécialisées de Médecine Physique et de Réadaptation - Présenté et soutenu publiquement le 22 avril 2008 par le docteur Mr Laurent Thefenne sur www.sofmer.com. Consulté le 24 septembre 2010.
- (en)Recommendations of the Immunization Practices Advisory Committee Poliomyelitis Prevention: Enhanced-Potency Inactivated Poliomyelitis Vaccine -- Supplementary Statement sur wonder.cdc.gov. Consulté le 24 septembre 2010.
- (en)Poliomyelitis Prevention in the United States Updated Recommendations of the Advisory Committee on Immunization Practices (ACIP) sur www.cdc.gov. Consulté le 24 septembre 2010.
- Philosophical Transactions of the Royal Society, London, B; 2001; 376; 778-977
- (en)New material from Edward Hooper, to coincide with publication of the Royal Society's volume on "The Origins of HIV and the AIDS Epidemic" in summer 2001. sur weber.ucsd.edu. Consulté le 24 septembre 2010.
- (en) Katz SL, Gershon AA, Krugman S, Hotez PJ, Krugman's infectious diseases of children, Mosby, St-Louis, 2004, 822 p. (ISBN 0-323-01756-8), p. 81–97
- (en)Ohri LK, Marquess JG, « Polio: Will We Soon Vanquish an Old Enemy? », dans Drug Benefit Trends, vol. 11, no 6, 1999, p. 41–54
- Adams et al., Principles of Neurology, 6e éd, p764-5
- (en)Kew O, Sutter R, de Gourville E, Dowdle W, Pallansch M, « Vaccine-derived polioviruses and the endgame strategy for global polio eradication », dans Annu Rev Microbiol, vol. 59, 2005, p. 587–635 [lien PMID, lien DOI]
- (en)Parker SP, McGraw-Hill Concise Encyclopedia of Science & Technology, McGraw-Hill, New York, 1998, 2450 p. (ISBN 0-07-052659-1), p. 67
- Racaniello V, « One hundred years of poliovirus pathogenesis », dans Virology, vol. 344, no 1, 2006, p. 9–16 [lien PMID, lien DOI]
- (fr)La poliomyélite : pourquoi vacciner ? sur www.medisite.fr. Consulté le 24 septembre 2010.
- Davis L, Bodian D, Price D, Butler I, Vickers J, « Chronic progressive poliomyelitis secondary to vaccination of an immunodeficient child », dans N Engl J Med, vol. 297, no 5, 1977, p. 241–5 [lien PMID]
- Chandra R, « Reduced secretory antibody response to live attenuated measles and poliovirus vaccines in malnourished children », dans Br Med J, vol. 2, no 5971, 1975, p. 583–5 [lien PMID]
- Miller A, « Incidence of poliomyelitis; the effect of tonsillectomy and other operations on the nose and throat », dans Calif Med, vol. 77, no 1, juillet 1952, p. 19–21 [lien PMID]
- Horstmann D, « Acute poliomyelitis relation of physical activity at the time of onset to the course of the disease », dans J Am Med Assoc, vol. 142, no 4, 1950, p. 236–41 [lien PMID]
- Gromeier M, Wimmer E, « Mechanism of injury-provoked poliomyelitis », dans J. Virol., vol. 72, no 6, 1998, p. 5056–60 [lien PMID]
- Evans C, « Factors influencing the occurrence of illness during naturally acquired poliomyelitis virus infections », dans Bacteriol Rev, vol. 24, no 4, 1960, p. 341–52 [texte intégral [PDF], lien PMID]
- (en)[PDF]Salisbury A, Ramsay M, Noakes K (Joint Committee on Vaccination and Immunisation), Immunisation Against Infectious Disease, 2006, Stationery Office, Édimbourg, 2006, 468 p. (ISBN 0-11-322528-8) [lire en ligne], chap. 26 (« Poliomyelitis »), p. 313–29
- Sauerbrei A, Groh A, Bischoff A, Prager J, Wutzler P, « Antibodies against vaccine-preventable diseases in pregnant women and their offspring in the eastern part of Germany », dans Med Microbiol Immunol, vol. 190, no 4, 2002, p. 167–72 [lien PMID, lien DOI]
- He Y, Mueller S, Chipman P, et al, « Complexes of poliovirus serotypes with their common cellular receptor, CD155 », dans J Virol, vol. 77, no 8, 2003, p. 4827–35 [texte intégral, lien PMID, lien DOI]
- Yin-Murphy M, Almond JW, Baron's Medical Microbiology (Baron S et al, eds.), Univ of Texas Medical Branch, 1996, 4the éd. (ISBN 978-0-9631172-1-2) [lire en ligne], « Picornaviruses: The Enteroviruses: Polioviruses »
- (en)Todar K, « Polio », Ken Todar's Microbial World, University of Wisconsin - Madison, 2006. Consulté le 2007-04-23
- Sabin A, « Pathogenesis of poliomyelitis; reappraisal in the light of new data », dans Science, vol. 123, no 3209, 1956, p. 1151–7 [lien PMID, lien DOI]
- Mueller S, Wimmer E, Cello J, « Poliovirus and poliomyelitis: a tale of guts, brains, and an accidental event », dans Virus Res, vol. 111, no 2, 2005, p. 175–93 [lien PMID, lien DOI]
- [PDF](en) Atkinson W, Hamborsky J, McIntyre L, Wolfe S (eds.), Epidemiology and Prevention of Vaccine-Preventable Diseases (The Pink Book), Washington DC, Public Health Foundation, 2007, 10the éd., PDF [lire en ligne], « Poliomyelitis », p. 101–14
- Falconer M, Bollenbach E, « Late functional loss in nonparalytic polio », dans American journal of physical medicine & rehabilitation / Association of Academic Physiatrists, vol. 79, no 1, 2000, p. 19–23 [lien PMID, lien DOI]
- (en) Leboeuf C, The late effects of Polio: Information For Health Care Providers., Commonwealth Department of Community Services and Health, 1992, PDF (ISBN 978-1-875412-05-1) [lire en ligne (page consultée le 23 août 2008)]
- (en) Wood, Lawrence D. H.; Hall, Jesse B.; Schmidt, Gregory D., Principles of Critical Care, New York, McGraw-Hill Professional, 2005, 3rde éd. (ISBN 978-0-07-141640-5) (LCCN 2004061086), p. 870
- Gawne AC, Halstead LS, « Post-polio syndrome: pathophysiology and clinical management », dans Critical Review in Physical Medicine and Rehabilitation, vol. 7, 1995, p. 147–88 [texte intégral] Reproduced online with permission by Lincolnshire Post-Polio Library; retrieved on 2007-11-10.
- Young GR, « Occupational therapy and the postpolio syndrome », dans The American journal of occupational therapy, vol. 43, no 2, 1989, p. 97–103 [texte intégral, lien PMID]
- Nathanson N, Martin J, « The epidemiology of poliomyelitis: enigmas surrounding its appearance, epidemicity, and disappearance », dans Am J Epidemiol, vol. 110, no 6, 1979, p. 672–92 [lien PMID]
- (en) Silverstein A, Silverstein V, Nunn LS, Polio, Berkeley Heights, NJ, Enslow Publishers, 2001 (ISBN 0-7660-1592-0), p. 12
- (en) Frauenthal HWA, Manning JVV, Manual of infantile paralysis, with modern methods of treatment., Philadelphia Davis, 1914 (OCLC 2078290) [lire en ligne], p. 79–101
- Cono J, Alexander LN, Vaccine Preventable Disease Surveillance Manual, Centers for Disease Control and Prevention, 2002, 3rde éd., PDF [lire en ligne], « Chapter 10, Poliomyelitis. », p. 10–1
- Professional Guide to Diseases (Professional Guide Series), Hagerstown, MD, Lippincott Williams & Wilkins, 2005 (ISBN 978-1-58255-370-2), p. 243–5
- (en) Hoyt, William Graves; Miller, Neil; Walsh, Frank, Walsh and Hoyt's clinical neuro-ophthalmology, Hagerstown, MD, Lippincott Williams & Wilkins, 2005, 6e éd., relié (ISBN 978-0-7817-4814-8) (LCCN 2004021741), p. 3264–65
- (en)[PDF]Site de l'"american journal of epidemiology" sur /aje.oxfordjournals.org. Consulté le 24 septembre 2010.
- (en)Further experiments on the selective susceptibility of spider monkeys to poliomyelitic infection sur www.jstor.org. Consulté le 24 septembre 2010.
- (en)[PDF]Poliomyelitis and other interovirus diseases sur lib.itg.be. Consulté le 25 septembre 2010.lib.itg.be
- (en)[PDF]L’éradication des maladies en tant que stratégie de santé publique : l’exemple de l’éradication de la poliomyélite sur whqlibdoc.who.int. Consulté le 25 septembre 2010.
- (en)Polio: an American story by David M. Oshinsky sur books.google.fr. Consulté le 25 septembre 2010.
- (en)La pandémie du sida a-t-elle une origine iatrogène ? En marge du livre de E. Hooper, The River: a journey to the source of HIV and Aids sur www.john-libbey-eurotext.fr. Consulté le 25 septembre 2010.
- (Sabin, Salk et Cox utilisèrent des macaques rhesus et cynomolgus d'Asie ; Lépine recourut à des babouins de Guinée : et Gear se servit de vervets/singes verts d'Afrique du Sud) [1]
- Hooper , dans un document publié en 2003 ( qui est la transcription de son intervention de 2001 à l'académie National Academy of Lincei ) fait état d'une correspondance avec Simon Wayne Hobson qui lui écrivait “you can find references to people culturing polio in central Africa at the time, so the principle is established. It would be hard for anyone to deny this.”358
- (en)GOAT POLIO OR LISTERIOSIS ? Different Causes, Similar Symptoms, Similar Treatments sur www.tennesseemeatgoats.com. Consulté le 25 septembre 2010.
- (en)Polioencephalomalacie Par Brandy A. Burgess, DVM sur www.garondescliniques.ca. Consulté le 25 septembre 2010.
- (en)Neumann D, « Polio: its impact on the people of the United States and the emerging profession of physical therapy », dans The Journal of orthopaedic and sports physical therapy, vol. 34, no 8, 2004, p. 479–92 [texte intégral [PDF], lien PMID] Reproduced online with permission by Post-Polio Health International; retrieved on 2007-11-10.
- (en) Cuccurullo SJ, Physical Medicine and Rehabilitation Board Review, New York, Demos Medical Publishing, 2004, relié (ISBN 978-1-888799-45-3) (LCCN 2002000889) [lire en ligne]
- Goldberg A, « Noninvasive mechanical ventilation at home: building upon the tradition », dans Chest, vol. 121, no 2, 2002, p. 321–4 [lien PMID, lien DOI]
- Miller AH, Buck LS, « Tracheotomy in bulbar poliomyelitis », dans California medicine, vol. 72, no 1, 1950, p. 34–6 [lien PMID]
- Wackers, G., Constructivist Medicine, Maastricht: Universitaire Pers Maastricht, 1994, web [lire en ligne (page consultée le 4 janvier 2008)]
- « Case definitions for infectious conditions under public health surveillance. Centers for Disease Control and Prevention », dans Morbidity and mortality weekly report, vol. 46, no RR-10, 1997, p. 26–7 [texte intégral [PDF], lien PMID]
- Augmentation des numérations de cellules
- Gaudin OG, Sohier R. Poliomyélite. In : Encycl Med Chir. (Editions scientifiques et médicales Elsevier SAS, Paris). Maladies Infectieuses, 08-058-A-10, 1988, 7p.
- Chezzi C, « Rapid diagnosis of poliovirus infection by PCR amplification », dans J Clin Microbiol, vol. 34, no 7, juillet 1996, p. 1722–5 [lien PMID]
- (en) Gawande A, The mop-up: eradicating polio from the planet, one child at a time, 12 janvier 2004, p. 34–40
- Louise Reisner-Sénélar (2009) The Danish anaesthesiologist Björn Ibsen a pioneer of long-term ventilation on the upper airways
- L. Reisner-Sénélar, The birth of intensive care medicine: Bjørn Ibsen’s records. Intensive Care Medicine, May 2011
- (en)Structure Governs Use sur www.jstor.org. Consulté le 25 septembre 2010.
- (en)The Jezierski papers: live polio vaccine development in colobus monkey cells but not chimpanzee cells in the Belgian Congo, 1952-1958. by J Desmyter and D E Teuwen sur www.ncbi.nlm.nih.gov. Consulté le 25 septembre 2010.
- (en)[PDF]PROPHYLAXIE DE LA POLIOMYELITE Present et avenir par PIERRE LEPINE sur www.ncbi.nlm.nih.gov. Consulté le 25 septembre 2010.
- (en)Medicine: Too Many Polio Vaccines? sur www.time.com, 2 mai 1960. Consulté le 25 septembre 2010.
- cf. La vaccination : Manuel pratique de tous les vaccins, Nizar Ajjan. Un débat aurait alors eu lieu concernant la légalité de l'expression d'opinions contestant cette obligation.
- Fine P, Carneiro I, « Transmissibility and persistence of oral polio vaccine viruses: implications for the global poliomyelitis eradication initiative », dans Am J Epidemiol, vol. 150, no 10, 1999, p. 1001–21 [texte intégral, lien PMID]
- [PDF] Protocole d'immunisation du Québec Mise à jour septembre 2010, p. 13[81]
- Spice B : Tireless polio research effort bears fruit and indignation, The Salk vaccine: 50 years later/ second of two parts, Pittsburgh Post-Gazette (April 4, 2005). Consulté le 2008-08-23.
- E. Pilly, Collège des universitaires de Maladies Infectieuses et Tropicales, Maladies infectieuses et tropicales, Vivactis Plus Ed, Paris, 2006, 747 p. (ISBN 2-9522954-1-7), « Vaccinations », p. 148-56
- (en)disc.vjf.inserm.fr. Consulté le .
- WHO: Vaccines for routine use. Consulté le 23-08-2008
- (en)[PDF]Genetic Evolution of Poliovirus: Success and Difficulties in the Eradication of Paralytic Poliomyelitis sur www.revuemedecinetropicale.com. Consulté le 25 septembre 2010.
- [PDF] Vaccin antipoliomyélitique inactivé (cultivé sur cellules diploïdes) – VPI
- [PDF] IMOVAX ® Polio, janvier 2007, pp. 7 et 8
- Sabin AB, Boulger LR, « History of Sabin attenuated poliovirus oral live vaccine strains », dans J Biol Stand, vol. 1, 1973, p. 115–8 [lien DOI]
- A Science Odyssey: People and Discoveries, PBS, 1998. Consulté le 23-08-2008
- Sabin A, Ramos-Alvarez M, Alvarez-Amezquita J, et al, « Live, orally given poliovirus vaccine. Effects of rapid mass immunization on population under conditions of massive enteric infection with other viruses », dans JAMA, vol. 173, 1960, p. 1521–6 [lien PMID]
- [PDF] Jusqu'au dernier enfant Initiative mondiale pour éradication de la polio - Rapport annuel 2009 - OMS, 2010 - p. 37[33]
- (fr)(en) [PDF]recommandations du Comité consultatif sur l’éradication de la poliomyélite relatives à l’utilisation du vaccin antipoliomyélitique oral bivalent contre les types 1 et 3 Relevé épidémiologique hebdomadaire de l'OMS, no 29, 2009, 84, 289–300
- « Poliomyelitis prevention: recommendations for use of inactivated poliovirus vaccine and live oral poliovirus vaccine. American Academy of Pediatrics Committee on Infectious Diseases », dans Pediatrics, vol. 99, no 2, 1997, p. 300–5 [texte intégral, lien PMID, lien DOI]
- (fr)Virologie sur anne.decoster.free.fr. Consulté le 25 septembre 2010.
- [PDF] 2. Raisonnement menant à l’arrêt à terme de l’utilisation du vaccin antipoliomyélitique oral (VPO) dans la vaccination systématique après l'éradication Document cadre destiné aux responsables des politiques nationales au sein des pays utilisant le VPO - OMS 2005 - p. 4[3] à 6[5]
- [PDF] Vaccination et vaccins antipoliomyélitiques au cours de la période précédant l'éradication] : note d’information de l’OMS, publiée dans le REH du 4 juin 2010 - pp. 9-10
- (en)Poliomyelitis, injections sur sites.google.com. Consulté le 25 septembre 2010.
- (en)Polio Par Thomas M. Daniel,Frederick C. Robbins sur books.google.fr. Consulté le 25 septembre 2010.
- (en)Fiches des maladies infectueuses : La poliomyélite sur www.pasteur.fr. Consulté le 25 septembre 2010.
- (en)Comptabilité des nouveaux cas de polyomyélites sur /www.polioeradication.org
- (fr)[PDF]Initiative mondiale pour l’éradication de la poliomyélite : Implications budgétaires du plan stratégique de l’Initiative mondiale pour l’éradication de la poliomyélite et ressources financières nécessaires sur www.polioeradication.org. Consulté le 25 septembre 2010.
- (en)The eradication of polio — progress and challenges, Mark A. Pallansch, Hardeep S. Sandhu, New Eng J Med, 2006;355;24;2508-2511
- Dr. Paul Hébert ; éditorial du Canadian Medical Association Journal (CMAJ) en date du 23 juin 2010, relayé par ADIT
- [PDF](fr) le syndrome post-poliomyélite, mythe ou réalité sur www.post-polio.asso.fr
- (en)Interview With Dr. Richard L. Bruno sur www.mefmaction.net
- (en)[PDF]Simiam virus 40, poliovirus vaccines and human cancer sur whqlibdoc.who.int
- Au Japon, autour des années 1960 apparu une maladie présentant des symptômes semblables à ceux de la polio et qui recevra son nom officiel en 1964 : Subacute myelo-optic neuropathy (SMON); l'origine virale, d'abord activement recherchée, fut récusée : c'est un médicament,le Clioquinol, qui fut désigné comme la cause de cette maladie qui fit 11007 victimes [2]
- (en)[PDF]Virologie sur whqlibdoc.who.int. Consulté le 25 septembre 2010.
- (en)Paralytic poliomyelitis : old dogmas and new perspectives by A.B.Sabin sur www.jstor.org. Consulté le 25 septembre 2010.
- (en)Polio and Post-Polio News sur mt.lincolnshirepostpolio.org.uk. Consulté le 25 septembre 2010.
- (en)A Discussion with Jim Hogle sur virologyhistory.wustl.edu. Consulté le 25 septembre 2010.
- (fr)[PDF]Liste des Laboratoires proposant un sujet pour le M2 de Virologie 2006-2007 sur 209.85.229.132. Consulté le 26 septembre 2010.
- (fr)Groupe d'étude entérovirus sur cat.inist.fr. Consulté le 26 septembre 2010.
- (fr)[PDF]Les maladies infectieuses et le passage des barrières d’espèces - La Fondation pour la Recherche Médicale attribue son soutien à neuf équipes de recherche sur www.frm.org/images. Consulté le 26 septembre 2010.
- (en)West Nile Virus Poliomyelitis sur 209.85.229.132. Consulté le 26 septembre 2010.
- (en)West Nile virus and "poliomyelitis" sur www.neurology.org. Consulté le 26 septembre 2010.
- (fr)apf.asso.fr Présentation de l'APF sur www.apf.asso.fr. Consulté le 26 septembre 2010.
- (fr)prnewswire.co.uk Homologation du nouveau vaccin polio de sanofi pasteur pour une nouvelle approche de l'éradication mondiale sur www.prnewswire.co.uk. Consulté le 26 septembre 2010.
- Shell M, Stutter, Harvard University Press, Cambridge, 2005 (ISBN 0-674-01937-7), « Hamlet's Pause », p. 187–188
- Barbara Levick, traduit de l’anglais par Isabelle Cogitore, Claude, édition originale anglaise 1990, Infolio, 2002, (ISBN 2884742018), pp. 24-25
- (en)Was Sir Walter Scott's lameness cauded by poliomyelitis? sur www.ncbi.nlm.nih.gov. Consulté le 26 septembre 2010.
- (en)William Francis, A history of English literature in a series of biographical sketches sur /books.google.com. Consulté le 26 septembre 2010.
- (fr)Malek Boutih: ma force vient de mon handicap! sur www.omegatv.tv. Consulté le 26 septembre 2010.
Voir aussi
Article connexe
Liens externes
- (en) Global Polio Eradication Initiative, site officiel du programme d'éradication de la polio dans le monde
- (fr) Zone d'endémie de la poliomyélite, sur le site du CHU de Rouen
- (fr) Groupe de Liaison et d'Information Post-Polio
- (fr) Enregistrement d'une conférence sur l'éradication des maladies
- (en) Elizabeth Kenny/Wikipedia (en)
Catégories :- Infection virale
- Infection du système nerveux
- Maladie en pédiatrie
- Maladie de la moelle épinière
Wikimedia Foundation. 2010.