- Hepatite C
-
Hépatite C
L’hépatite C est une maladie infectieuse transmissible par le sang et due au virus de l'hépatite C (VHC ou HCV en anglais), qui s’attaque au foie.[1] L'infection se caractérise par une inflammation du foie (l’hépatite) qui est souvent asymptomatique, mais qui peut évoluer vers une hépatite chronique et plus tard une cirrhose (fibrose cicatricielle du foie) et un cancer du foie.
Le virus de l'hépatite C (VHC) se transmet par contact de sang à sang. Il n’existe aucun vaccin disponible contre l'hépatite C. Les symptômes de l'infection peuvent être contrôlés médicalement et, chez une certaine proportion des patients, le virus peut être rendu indétectable par l’administration de médicaments anti-viraux au long cours. Bien que la prise en charge médicale précoce soit utile, les personnes atteintes d’une infection par le VHC ne présentent souvent que des symptômes bénins et, par conséquent, ne sont pas demandeuses d’un traitement[1]. On estime que 150 à 200 millions de personnes dans le monde sont infectées par le virus de l'hépatite C essentiellement par la transfusion de sang qui n'a pas été soumis à un dépistage et la réutilisation d'aiguilles et de seringues non stériles[2]. Le virus de l'hépatite C est l'un des six virus connus de l'hépatite virale: A, B, C, D, E, G.
 La Cirrhose du foie et le cancer du foie peuvent être la conséquence d’une infection par le virus de l’ Hépatite C.
La Cirrhose du foie et le cancer du foie peuvent être la conséquence d’une infection par le virus de l’ Hépatite C.
Histoire
Au milieu des années 1970, Harvey J. Alter, responsable de la section des maladies infectieuses au département de médecine transfusionnelle du National Institutes of Health, a démontré avec son équipe que la plupart des cas d’hépatite post-transfusionnelles n’étaient pas dus au virus de l’hépatite A ni à celui de l’hépatite B. Malgré cette découverte, les efforts de recherche coordonnés au niveau international pour identifier le virus responsable de cette maladie, initialement baptisée hépatite non A non B (NANBH en anglais), sont restés sans résultat pendant une décennie. En 1987, Michael Houghton, Qui-Lim Choo, et George Kuo de la Chiron Corporation, en collaboration avec le Dr DW Bradley du CDC, ont utilisé une nouvelle approche de clonage moléculaire pour identifier l'organisme inconnu.[3] En 1988, l’existence du virus a été confirmée par Alter qui a vérifié sa présence chez un groupe de patients atteints d’hépatite non A non B. En avril 1989, la découverte du virus, connu maintenant sous le nouveau nom de virus de l'hépatite C (VHC), a fait l’objet d’une publication dans deux articles de la revue science.[4][5]
Chiron a déposé plusieurs brevets sur le virus et ses méthodes de diagnostic sérologique.[6] Une demande de brevet concurrente déposée par le CDC a été abandonnée en 1990 après que Chiron eut payé 1,9 millions $ au CDC et 337 500 $ à Bradley. En 1994, Bradley a poursuivi Chiron, pour faire invalider le brevet, se considérant lui-même comme co-inventeur, et demandant à recevoir des dommages et intérêts et des royalties. Il a renoncé en 1998 après avoir perdu devant une cour d'appel. [7]
En 2000, les Drs. Alter et Houghton ont reçu le prix Lasker pour leurs travaux novateurs qui ont abouti à la découverte du virus de l'hépatite C et au développement de méthodes de dépistage permettant de réduire les risques d’hépatite post-transfusionnelle aux États-Unis de 30% dès 1970 et à le réduire à un niveau proche de zéro en 2000.[8]
En 2004, Chiron a obtenu 100 brevets dans 20 pays atteints par l'hépatite C et a poursuivi avec succès devant les tribunaux de nombreuses entreprises qui avaient utilisé illégalement son procédé. Les scientifiques et les concurrents se sont plaints que la société entravait la lutte contre l'hépatite C en exigeant des royalties trop élevées pour utiliser sa technologie.[7]
Virologie
Article détaillé : Virus de l'hépatite C.Le virus de l'hépatite C (VHC) est un petit virus à ARN d’environ (60 nanomètres de diamètre), enveloppé et contenu dans une capside protéique icosaèdrique. Son génome est un ARN monocaténaire linéaire de polarité positive. Il existe six grands génotypes du virus de l'hépatite C, qui sont indiqués par un nombre (par exemple, le génotype 1, le génotype 2, etc.)
Le virus a été classé dans la famille des Flaviviridae qui se compose de trois genres :
- les Flavivirus, responsables d'arboviroses
- les Pestivirus, qui ont des pathologies uniquement chez l'animal
- le VHC (virus de l'hépatite C), qui est le seul membre connu du genre des Hepacivirus
Génotypes
Le VHC est une grande famille, ce virus à ARN a une variété de génome assez importante. Il existe six principaux génotypes, noté de 1 à 6, et de nombreux sous-types. Ces génotypes ne sont pas responsables d'évolutions significativement différentes de l'hépatite. Ils ont par contre une importance dans la réponse aux traitements. Les génotypes 2 et 3 répondent mieux que les 1 de manière démontrée, et certainement mieux que le 4. C'est pour cela que le traitement des génotypes 2 et 3 ne dure que 24 semaines alors qu'il est de 48 semaines pour le 1. Pour le 4, on a moins de recul du fait de son apparition récente en France comme en Europe.
Signes et symptômes
Le virus peut rester plusieurs années à l'état latent. Le patient est alors ce qu'on appelle un "porteur sain", c'est-à-dire qu'il n'a aucun symptôme, mais peut transmettre la maladie. Le danger est que de nombreux patients sont infectés par le virus sans le savoir, et peuvent donc contaminer leurs proches. D'où l'importance du dépistage en cas de risque encouru.
Quand la maladie se déclare, elle peut avoir plusieurs conséquences : une cirrhose (affection chronique du foie). Le virus favorise également le cancer du foie (10% des cas).Les premières études de charge virale chez onze porteurs asymptomatiques de l’hépatite C ont montré que la charge virale dans le plasma sanguin variait de 100/mL à 50 000 000/mL[9].
Hépatite C aiguë
Après la contamination et une phase d'incubation d'environ sept semaines[10] survient la phase aiguë de l'infection.
La phase de l'hépatite C aiguë désigne la période allant du début de l'infection jusqu'au six premiers mois. Cette phase est asymptomatique - sans symptôme - dans 60 à 70% des cas. Chez une minorité de patients on retrouve des symptômes non spécifiques, tels qu'une perte de l'appétit, un état de fatigue, des douleurs abdominales, un état pseudo grippal, un prurit ou un ictère. La durée des symptômes est, en règle, inférieure à 3 mois[10].
Le virus de l'hépatite C est habituellement détectable dans le sang une à trois semaines après le début de l'infection, et les anticorps contre le virus apparaissent généralement en moins de 3 à 12 semaines.
Au cours de cette phase :
- environ 20 à 30 % des personnes infectés éliminent spontanément le virus, comme en témoigne la normalisation des tests hépatiques (enzymes hépatiques), tels que l’Alanine amino transférase (ALAT) et l’Aspartate amino transférase (ASAT), ainsi que la disparition du plasma de l’ARN du VHC (phénomène connu sous le nom d’élimination spontanée du virus).
- environ 70 à 80 % des personnes infectés évoluent vers une hépatite C chronique, c'est-à-dire, une infection persistant plus de 6 mois.[11][12][13]
Les formes gravissimes, dites « fulminantes », sont rarissimes.
La pratique initiale était de ne pas traiter les infections aiguës et d’attendre que la personne guérisse spontanément, mais le traitement au cours de la phase aiguë des infections de Génotype 1 comportait plus de 90% de succès avec un temps de traitement réduit de moitié par rapport au traitement requis pour les infections chroniques, mais que la majorité des hépatite C aiguës était guérie.[14]
Hépatite C chronique
L'hépatite C chronique est définie par une infection persistant depuis plus de six mois. Cliniquement, cette maladie est souvent asymptomatique (sans symptômes) et est généralement de découverte fortuite.
L’évolution naturelle de l'hépatite chronique C varie considérablement d'une personne à l'autre. Pratiquement toutes les personnes infectées par le VHC présentent des signes d’inflammation à la biopsie hépatique, toutefois, le taux de progression vers la cicatrisation des lésions du foie (fibrose) montre une grande variabilité selon les individus.
L'évolution sans traitement se fait :
- dans un tiers des cas vers une hépatite chronique modérément active ou très active qui peut aboutir à une cirrhose en 10 à 20 ans. Parmi ces cas, certains développeront un carcinome hépato-cellulaire - ou cancer primitif du foie.
- dans un autre tiers vers une hépatite chronique peu active qui peut soit ne pas évoluer, soit aboutir à une cirrhose après 30 ans ;
- Le reste des patients semblent avoir une fibrose qui progresse si lentement qu'ils ont peu de chance de développer une cirrhose dans le cours normal de leur vie.
L’évolution de l'infection dépend de facteurs aggravants tels que l'âge, le sexe (chez les hommes la progression de la maladie est plus rapide que chez les femmes), la consommation d’alcool, la stéatose hépatique, l’excès de poids, la co-infection par le VIH (associée à une nette augmentation du taux de progression de la maladie) et le type de virus (parmi les 6 génotypes identifiés).
Les symptômes évocateurs d'une maladie du foie sont généralement absents jusqu'à la cicatrisation des lésions hépatiques. Toutefois, l'hépatite C est une maladie systémique et les patients peuvent présenter une grande variété de manifestations cliniques allant de l'absence totale de symptômes à une maladie avérée, jusqu’au développement d’une maladie hépatique avancée. Les signes et les symptômes associés à une hépatite C chronique, sont une fatigue, une perte de poids importante, un état pseudo-grippal, des douleurs musculaires, des douleurs articulaires, une fièvre peu élevée et intermittente, des démangeaisons, des troubles du sommeil, des douleurs abdominales (en particulier dans le quadrant supérieur droit), des troubles de l'appétit, des nausées, de la diarrhée, des troubles dyspeptiques, des troubles cognitifs, des troubles dépressifs, des maux de tête, et des sautes d'humeur.
Lorsque l'hépatite C chronique a atteint le stade de cirrhose, les signes et les symptômes qui peuvent apparaître sont généralement provoqués par une altération des fonctions hépatiques ou une augmentation de la pression dans la circulation sanguine intra-hépatique, une affection connue sous le nom d’hypertension portale. Les signes et les symptômes d’une possible cirrhose du foie sont l’ascite (accumulation de liquide dans la cavité péritonéale de l'abdomen), des ecchymoses et une tendance aux saignements, des douleurs osseuses, des varices oesophagiennes (dilatation des veines, en particulier à la jonction de l'estomac et de l'œsophage), l’émission de selles graisseuses (stéatorrhée), un ictère, et un syndrome de déficience cognitive connu sous le nom d’encéphalopathie hépatique.
Les tests de la fonction hépatique montrent une élévation plus ou moins importante des ALAT, des AST et des gamma glutamyl transpeptidase (gamma GT) et périodiquement ils peuvent montrer des résultats normaux. Habituellement le taux de prothrombine et de sérum albumine sont normaux. Il n’y a pas de corrélation entre le niveau d'élévation des enzymes hépatiques et l’importance de l’atteinte hépatique à la biopsie. Le génotype viral et la charge virale ne sont pas non plus en corrélation avec la gravité de l'atteinte hépatique. La biopsie du foie est le meilleur test diagnostic pour déterminer l’étendue des cicatrices et de l'inflammation ; il existe une alternative, le fibro-scan qui permet d'évaluer le niveau de fibrose en fonction de l'élasticité du tissu hépatique. Les examens d’imagerie médicale comme l'échographie ou la tomodensitométrie ne montrent pas d’atteinte hépatique avant que la maladie ne soit très évoluée.
L'hépatite C chronique, davantage que d'autres formes d'hépatite, est souvent diagnostiquée en raison de manifestations extra-hépatiques associées à la présence du virus de l'hépatite C qui sont maintenant bien connues: [1] Parmi ces manifestations on peut rencontrer une thyroïdite (inflammation de la thyroïde) avec hyperthyroïdie, une Hypothyroïdie, une porphyrie cutanée tardive, une cryoglobulinémie (une forme de Vascularite)[15] et une glomérulonéphrite (inflammation des reins), en particulier une glomérulonéphrite membranoproliférative (MPGN) [16] L'hépatite C est également associé à l’ ophtalmorhinostomatoxérose, à la Thrombocytopénie, au lichen plan, au Diabète sucré et au Syndrome lymphoprolifératif à cellules B[17].
Diagnostic biologique
Le diagnostic de l'hépatite C est rarement fait au cours de la phase aiguë de la maladie parce que la majorité des personnes infectées ne présentent aucun symptôme apparent au cours de cette phase de la maladie. Ceux qui présentent une phase aiguë symptomatique sont rarement suffisamment malades pour être amenés à consulter un médecin. Les signes sont, par ailleurs très souvent non spécifique.
L'hépatite C peut être suspectée sur la base des antécédents médicaux (notamment en cas d’antécédents d'abus de drogues par voie IV ou par inhalation de substances telles que la cocaïne), de certains symptômes, ou des anomalies des enzymes hépatiques ou de la fonction hépatique au cours des tests sanguins de routine. De temps en temps, l'hépatite C est diagnostiquée à l’occasion d’un dépistage ciblé pour le don de sang (les donneurs de sang font l’objet d’un dépistage pour de nombreuses maladies transmissibles par le sang y compris l'hépatite C) ou d’une enquête après un contact supposé avec le virus.
Sérologie
Les tests pour l'hépatite C commencent par des tests sérologiques, des tests sanguins permettant de détecter les anticorps anti-VHC. Ces derniers apparaissent vers la sixième semaine après la contamination[18]. Globalement, le dosage des anticorps anti-VHC possède une forte valeur prédictive positive pour caractériser l’exposition au virus de l'hépatite C, mais il peut laisser passer des patients qui n'ont pas encore développé d’anticorps (séroconversion), ou ont un niveau d'anticorps insuffisant pour pouvoir être détecté. Rarement, il existe des personnes infectées par le VHC qui ne développeront jamais d’anticorps contre le virus et donc, n’auront jamais de test positif au dosage des anticorps anti-VHC. En raison de cette possibilité, la recherche d'ARN viral (voir ci-dessous méthodes d’analyses de l'acide nucléique) devrait être proposée lorsque la recherche d'anticorps est négative, mais qu’il existe une suspicion élevée d'hépatite C (en raison par exemple de l’élévation des transaminases (ALAT) chez quelqu'un qui présente des facteurs de risque pour l'hépatite C).
En l’absence de signe cliniques ou de notion d’exposition à un risque le diagnostic biologique d'hépatite C se limite à la mise en évidence des anticorps anti-HCV par un test de dépistage. Si ce test est négatif, le sujet n'a jamais été en contact avec le virus. Si ce test de dépistage est positif, il faudra le contrôler sur un second prélèvement sanguin et utiliser une autre technique de détection des anticorps. Lorsque les deux tests sont positifs, le sujet a été en contact avec le virus et possède des anticorps qui ne sont malheureusement pas protecteurs contre une éventuelle nouvelle infection. L'hépatite virale C a pu toutefois être guérie spontanément.
Le taux d'anticorps ne semble pas être corrélé avec les chances de guérison[19]. Cet échec de l'immnunité humorale naturelle peut être expliqué, au moins partiellement, par un taux de mutation important concernant les antigènes du virus[20]. L'immunité cellulaire a un rôle au moins aussi important, dans la lutte de l'organisme contre le VHC.
En pratique, lors d'un tableau d'hépatite aigue, idéalement, une première sérologie doit être faite rapidement, complétée par un second dosage quelques semaines plus tard : l'augmentation importante du taux d'anticorps anti VHC entre les deux dosages (séroconversion) permet de signer la contamination récente. Il est fait de même en cas de contamination possible, par exemple après une piqure accidentelle par une aiguille potentiellement souillée.
Recherche du virus
La présence d’anti-anticorps anti-VHC pour les sujets ayant deux tests de dépistage positifs (ou des tests discordants), révèle une exposition au virus, mais ne permet pas de déterminer s'il s’agit d’une infection en cours ou d’une infection ancienne qui a pu guérir spontanément. Toutes les personnes ayant des anti-anticorps anti-VHC positifs doivent faire l'objet de tests supplémentaires pour rechercher la présence du virus de l'hépatite C lui-même afin de déterminer si l'infection est en cours d’évolution. La présence du virus est recherchée par l'utilisation de méthodes de test des molécules d’acides nucléiques tels que la Réaction en chaîne par polymérase (PCR), ou d’autres techniques d’amplification. Si cette recherche est positive, le sujet est infecté par le virus. Si cette recherche est négative, il a éliminé le virus (guérison spontanée) et n'est plus infecté. Ce dernier cas, représente un peu moins d'un tiers des cas. La majorité des sujets reste infecté de manière chronique par le virus (absence de guérison après 6 mois).
Tous les tests moléculaires sur les acides nucléiques du virus de l'hépatite C ont la capacité de détecter non seulement la présence du virus, mais aussi de mesurer la quantité de virus présent dans le sang (charge virale du VHC). Cette dernière est un facteur important pour déterminer la probabilité de réponse au traitement par l'interféron, mais ne permet pas d’évaluer la gravité de la maladie, ni son risque d'aggravation. Le suivi de la charge virale HCV permet de contrôler l'efficacité du traitement conjointement avec le dosage des transaminases (ALAT). L'objectif est la guérison avec une charge virale HCV indétectable 6 mois après l'arrêt du traitement.
Chez les personnes pour lesquelles l'infection par le VHC est confirmée, la détermination du génotype est généralement recommandée. La connaissance de ce dernier sert à déterminer la durée requise du traitement et d’évaluer les chances de réponse au traitement par l'interféron. Le génotypage du virus est le plus souvent réalisé par séquençage (ou hybridation) d'une région du génome viral.
Transmission
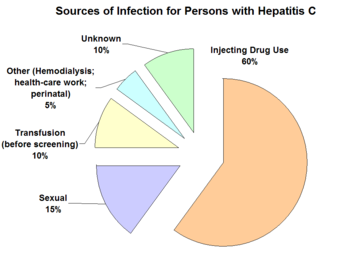 Chiffres du CDC pour les sources d'infection par le VHC aux États-Unis. Source
Chiffres du CDC pour les sources d'infection par le VHC aux États-Unis. Source
La transmission du virus de l'hépatite C (VHC)est parentérale c'est-à-dire qu’il se transmet par voie sanguine, par contact de sang à sang. Dans les pays développés, 90% des personnes porteuses d'infection chronique par le virus de l'hépatite C ont été infectées par la transfusion de sang ou de produits sanguins non testés ou par usage de drogues par injection ou de drogues par inhalation. Dans les pays en développement, les premières sources d'infection par le VHC sont le matériel d'injection non stérilisé et la transfusion de sang ou de produits sanguins mal testés.
Bien que l'utilisation de drogues injectables et l’administration de sang ou de produits sanguins infectés soient les voies de transmission les plus répandues de l’infection par le VHC, toute pratique, activité, ou situation qui implique un contact de sang à sang peut potentiellement être une source d'infection par le VHC. Le virus peut se transmettre par voie sexuelle, mais cette éventualité est rare et, en général, ne se produit qu’en cas d’association avec une MST (comme le VIH) ce qui augmente la probabilité de contact avec le sang.[21].
Plusieurs activités et plusieurs pratiques ont été identifiées comme des sources potentielles d'exposition au virus de l'hépatite C. Toute personne qui peut avoir été exposée au virus de l'hépatite C dans une ou plusieurs de ces circonstances devrait subir des examens pour dépister une éventuelle hépatite C.
Utilisation de drogues par voie injectable
Les personnes qui utilisent ou ont utilisé des drogues en injection intraveineuse ainsi que celles qui sont impliquées dans le circuit de fourniture de drogues illicites sont plus exposées à contracter l'hépatite C parce qu'ils peuvent partager les aiguilles ou d'autres ustensiles utilisés par les toxicomanes (y compris les réchauds, le coton, les cuillères, l'eau, etc), qui peuvent avoir été contaminés par du sang infecté par le virus de l'hépatite C. On estime que 60% à 80% de tous les utilisateurs de drogues injectables aux États-Unis ont été infectés par le VHC. Les stratégies de réduction des risques sont encouragés dans de nombreux pays pour réduire la propagation de l'hépatite C, par l'éducation, la fourniture d'aiguilles et de seringues, et la promotion de techniques d'injection sûres.
Usage de drogues par voie nasale (drogues qui sont "sniffées ")
Les chercheurs ont suggéré que la transmission du VHC pouvait être possible par inhalation nasale de drogues illégales comme la cocaïne et les cristaux de méthamphétamine lorsque les pailles (contenant des traces de mucus et de sang) sont partagées entre les utilisateurs.[22]
Produits sanguins
La transfusion sanguine, l’administration de produits sanguins, ou la transplantation d'organes avant la mise en œuvre du dépistage du VHC (aux États-Unis, cela concerne les procédures utilisées avant 1992) est un facteur de risque d'hépatite C en voie de régression.
Le virus a été isolé pour la première fois en 1989 et les tests de dépistage fiables de ce virus n'ont pas été disponibles avant 1992. Par conséquent, ceux qui reçu du sang ou des produits sanguins avant la mise en œuvre du dépistage du VHC dans les dérivés du sang ont été exposés au virus. Les produits sanguins comprennent les facteurs de coagulation (pour les hémophilies), les immunoglobulines, les plaquettes et le plasma. En 2001, les Centers for Disease Control and Prevention (CDC) ont indiqué que le risque d'infection du VHC par transfusion aux États-Unis était de moins d’un cas par million d'unités transfusées.
Ce n'est pas le cas dans d'autres pays où le dépistage systématique des donneurs n'est pas effectif. En Inde, par exemple, à la fin des années 1990, seuls 6% des donneurs ont été testés pour l'hépatite C[23]. La transmission par du matériel médical mal stérilisé reste une réalité dans les pays en voie de développement[24].
Exposition Iatrogénique au cours de soins médicaux ou dentaires
Les gens peuvent être exposés au virus de l'hépatite C par l'intermédiaire d’instruments médicaux ou dentaires mal stérilisés. Parmi le matériel qui peut être souillé par du sang contaminé s’il est mal stérilisé on compte les aiguilles ou les seringues, le matériel d'hémodialyse, les instruments d’hygiène bucco-dentaire, les carabines à air comprimé, etc. L’utilisation de techniques scrupuleuses de stérilisation et d'élimination du matériel usagé peut réduire le risque d'exposition iatrogène au virus de l'hépatite C pratiquement à zéro.
Exposition professionnelle au sang
Les professionnels des soins médicaux et dentaires, les intervenants de premiers secours (par exemple, les pompiers, les ambulanciers, le personnel des services médicaux d'urgence, les agents des services de police), les militaires et les combattants peuvent être exposés au virus de l'hépatite C par le biais d’une exposition accidentelle au sang à l’occasion de piqûres accidentelles ou d’éclaboussures de sang sur les yeux ou des plaies ouvertes. Les mesures universelles de protection contre les risques de tels accidents permettent de réduire très sensiblement le risque d'exposition au VHC.
Exposition au sang au cours des loisirs
Les sports de contact et d'autres activités, telles que la " slam dance" peuvent entraîner une exposition par contact accidentel de sang à sang, source potentielle d'exposition au VHC.[25]
Exposition sexuelle
La transmission sexuelle du VHC est considérée comme une éventualité rare (moins de 5% des cas). Des études montrent que le risque de transmission sexuelle dans les relations hétérosexuelles monogames est extrêmement faible, voire nul.[26][27] Le CDC ne recommande pas l'utilisation de préservatifs entre partenaires vivant en couple monogame stable (lorsqu’un des partenaires est positif et l'autre est négatif).[28] Toutefois, en raison de la forte prévalence de l'hépatite C, ce risque faible est susceptible de se traduire par un nombre non négligeable de cas transmis par voie sexuelle. Les rapports sexuels avec pénétration vaginale comporteraient un risque plus faible de transmission par rapport aux pratiques sexuelles qui impliquent un risque plus élevé de traumatisme des muqueuses ano-génitales (rapports sexuels avec pénétration anale, fist, utilisation de sex toys).[29]
Piercings et tatouages
Les tatouages à base de colorants ou d'encre, le port de stylets et de piercing peuvent transmettre l'hépatite C d'une personne à une autre par le sang infecté si des techniques de stérilisation correctes ne sont pas respectées. Les tatouages ou piercing réalisés avant le milieu des années 1980, "Underground", ou non professionnels sont particulièrement préoccupantes, car les techniques de stérilisation dans de tels contextes peuvent avoir été insuffisantes pour prévenir la maladie.
Partage d’articles de soins personnels
Les articles de soins personnels tels que rasoirs, brosses à dents, ciseaux à ongles, et d'autres instruments de manucure ou pédicure peuvent être facilement contaminés par du sang. Le partage de ces objets peut conduire potentiellement à une exposition au VHC.
Le VHC n’est pas propagé par simple contact comme étreintes, baisers, partage de nourriture ou d'ustensiles de cuisine.
Transmission verticale (mère à enfant)
Le terme de transmission verticale désigne la transmission d'une maladie infectieuse de la mère à son enfant pendant l’accouchement. La transmission de l'hépatite C de la mère à l’enfant a bien été décrite, mais elle se produit relativement rarement et uniquement chez les femmes qui sont positives pour l’ARN du VHC au moment de la délivrance, le risque de transmission dans ce contexte étant d'environ 6%[30]. Comme pour la transmission par voie sexuelle il est directement proportionnel à la virémie (quantité de virus circulant). Parmi les femmes qui sont séropositives à la fois pour le VHC et pour le VIH au moment de l'accouchement, le risque de transmission au nouveau-né de hépatite C est d’environ 25%[31].
Le risque de transmission verticale du virus de l'hépatite C ne semble pas être associé à un mode particulier d’accouchement ou à l'allaitement. Une césarienne ne semble donc pas prévenir le risque de transmission. Curieusement, il est nettement plus élevé si le nouveau-né est un garçon[32].
Épidémiologie
La prévalence de l'hépatite C est difficile à estimer car elle survient sans signe apparent dans une forte proportion des cas ce qui tend à faire sous-estimer les chiffres rééls, sauf à faire des études basées sur des sérologies faites systématiquement.
En 1999, l'hépatite C infectait environ 170 millions de personnes dans le monde[33]. Aux États-Unis, un peu moins de 4 millions de personnes seraient touchées[34]. 35000 à 185000 nouveaux cas environ surviennent chaque année aux États-Unis. La Co-infection par le VIH est fréquente et le taux d’infection parmi les populations VIH positives est plus élevé. 10000 à 20000 décès par an aux États-Unis sont dus au virus de l'hépatite C; on s’attend à ce que le taux de mortalité augmente, tant que n’auront pas été repérées toutes les personnes qui ont été infectées à l’époque où les tests sérologiques pour le virus de l'hépatite C n’étaient pas encore pratiqués avant toute transfusion. Une enquête réalisée en Californie a montré que la prévalence pouvait atteindre 34% chez les détenus;[35] 82% des sujets chez qui on a diagnostiqué une hépatite C ont fait un séjour en prison,[36] et la transmission en prison a été bien décrite.[37]
Suivant les régions, sa prévalence varie de 0,5% à 6% de la population (1% en France, 2% au Japon). En France environ 600 000 personnes sont porteuses du virus de l'Hépatite C (1% de la population) dont plus du tiers ignorent leur état; entre 200 000 et 300 000 personnes ont été infectés par transfusion sanguine.[38]
L’Égypte est le pays qui a le taux de séroprévalence du VHC le plus élevé, jusqu'à 20% dans certaines régions. Il existe une hypothèse selon laquelle cette forte prévalence serait liée à une campagne, maintenant interrompue, de traitement de masse de la bilharziose, qui est endémique dans ce pays.[39] Indépendamment de cause initiale de l'épidémie, un taux élevé de transmission du VHC persiste en Égypte, à la fois d’origine iatrogénique et par transmission communautaire familiale.
La séroprévalence de l'hépatite C chez les enfants et les adolescents est de 0,2 à 0,4 %.
L'incidence a augmenté jusqu'à un pic dans les années 1980 et tend à décroître depuis, du moins dans les pays industrialisés[40].
Co-infection avec le HIV
Aux États-Unis environ 350000, ou 35% des patients infectés par le VIH sont également infectés par le virus de l'hépatite C, principalement parce que les deux virus sont transmis par le sang et présents dans les mêmes populations. Dans d'autres pays où la co-infection est moins fréquente, ce qui peut être lié à des habitudes différentes dans l’usage des drogues. Le VHC est la principale cause de maladie chronique du foie aux États-Unis. Il a été démontré dans les études cliniques que l'infection par le VIH entraîne une progression plus rapide de l'hépatite chronique C vers la cirrhose et l’insuffisance hépatique. Cela ne veut pas dire un traitement n'est pas indiqué pour ceux qui présentent une co-infection.
Pronostic
Lors d'une hépatite aigue, un peu moins d'un tiers des patients élimine spontanément le virus en guérissant de l'hépatite aigue[19]. Les deux tiers restant évoluent vers une hépatite chronique. Parmi ces derniers, une très faible proportion contrôle spontanément l’infection pour devenir porteuses chroniques de l'hépatite C (0,5 à 0,74% par an)[41],[42]. La grande majorité des patients atteints n’en guérissent donc pas sans traitement.
La régression d'une cirrhose post hépatite C n'est pas exceptionnnelle sous traitement[43].
Traitement
Le but du traitement est, idéalement, d'avoir une charge virale nulle, c'est-à-dire, que le VHC devienne indétectable.
L'hépatite aigue guérissant spontanément dans un tiers des cas, le moment où il faut instaurer un traitement reste débattu.
La durée optimale du traitement dépend du type du VHC, de la réponse au traitement et du terrain. Elle peut atteindre plusieurs mois.
Traitement anti-viral
Le traitement de référence est une combinaison d’ interféron alpha pégylée (peginterféron alfa) (de noms commercial PEGASYS® et PEG-Intron®, ou encore Viraferon-PEG®) et d’un médicament antiviral la ribavirine pendant une durée de 24 ou 48 semaines, selon le génotype du virus. Cette durée peut être prolongée jusqu'à un an et demi dans les formes avec fibrose évoluée. Cette combinaison est utilisable désormais dès l'âge de trois ans. La forme pégylée permet l'administration par injection hebdomadaire, ce que ne permet pas la forme simple, avec une efficacité supérieure[44].
Le traitement commence que lorsqu’on détecte une activité (nécrose et inflammation) minime, et une fibrose même modérée, soit A1F2 sur le Score Metavir. Il est pris en charge à 100% par la sécurité sociale française. Son coût, en 2002, était d'environ 38 000 €uros.
Le traitement est indiqué chez les patients porteurs d’une infection persistante par le virus de l’hépatite C avec des anomalies persistantes des tests hépatiques. Des taux de rémission prolongée (arrêt de la réplication virale) de 75% ou plus peuvent s’observer chez les personnes atteintes d'hépatite C de génotypes 2 et 3 après 24 semaines de traitement,[45] et d’environ 50% en cas d’infection par le VHC de génotype 1 après 48 semaines de traitement et de 65% pour le génotype 4 après 48 semaines de traitement. La présence d'une cirrhose avérée diminue la probabilité de succès du traitement. Environ 80% des patients atteints d'hépatite C aux États-Unis ont le génotype 1. Le génotype 4 est plus répandu au Moyen-Orient et en Afrique. Si le traitement par interféron - ribavirine n’entraîne pas une réduction de la réplication virale ou une disparition complète de l'ARN (connue sous le terme de de réponse virale précoce) après 12 semaines pour le génotype 1, les chances de succès du traitement sont inférieures à 1%. La réponse virale précoce n'est généralement pas vérifiée pour les patients qui ne sont pas de génotype 1, pour qui les chances d'y parvenir sont de plus de 90%. Le mécanisme d'action n'est pas tout à fait élucidé, parce que même les patients qui semblent avoir eu une réponse virale prolongée peuvent encore avoir une réplication active du virus dans le foie et les cellules mononucléées du sang périphérique[46].
Le traitement pendant la phase d'infection aiguë présente un taux de réussite beaucoup plus élevé (plus de 90%) avec une durée de traitement plus courte, mais cela doit être mis en balance avec les 30% de chances de guérison spontanée sans traitement.
Les personnes à faible charge virale initiale répondent beaucoup mieux au traitement que celles qui ont des charges virales plus élevées (plus de 2 millions de virions/ml).
En plus du traitement habituel par l'interféron et la ribavirine, les taux de succès sont parfois plus élevés lorsque un médicament antiviral l’ Amantadine est ajouté au protocole à la dose de 100 mg deux fois par jour. On parle alors de trithérapie. Cette méthode peut être utile pour les patients "non répondeurs" pour lesquels les précédents traitements par l'interféron et la ribavirine n'ont pas été couronnés de succès.[47]
Actuellement, l'amantadine n'est pas validée pour le traitement de l'hépatite C en première intention.
Autres traitement
Les lignes directrices recommandent fortement de vacciner les patients atteints d'hépatite C contre les hépatites A et B, s’ils n’ont pas encore été exposés à ces virus, susceptibles d’aggraver radicalement l’atteinte hépatique.
La consommation de boissons alcoolisées accélère la fibrose et la cirrhose associées au VHC et rend plus probable la survenue d’un cancer du foie. La résistance à l'insuline et le syndrome métabolique peuvent également aggraver le pronostic hépatique. Le tabagisme augmente le taux de fibrose cicatricielle.
Pendant la grossesse et l’allaitement
Si une femme enceinte présente des facteurs de risque pour l'hépatite C, elle doit se voir proposer un dépistage par recherche d’anticorps contre le VHC. Environ 4 % des nourrissons nés de femmes infectées par le VHC seront atteints. Le virus se transmet au bébé au moment de la naissance. Il n'existe pas de traitement capable de prévenir cette transmission.
Lorsque la mère est également porteuse du VIH, le taux de transmission peut atteindre 19%. Il n'existe pas actuellement de données pour déterminer si un traitement antiviral réduit le risque de transmission périnatale. La Ribavirine et L’Interféron sont contre-indiqués pendant la grossesse. Toutefois, en évitant le monitoring du fœtus par pose d’électrodes sur le cuir chevelu et un travail prolongé après la rupture des membranes on peut réduire le risque de transmission au nouveau-né.
Les anticorps anti-VHC de la mère peuvent persistent chez le nourrisson jusqu'à l'âge de 15 mois. Si un diagnostic précoce est nécessaire, la recherche de l’ARN du VHC peut être effectuée à l’âge de 2 à 6 mois, avec une répétition des tests quel que soit le résultat du premier test. Si un diagnostic plus tardif est préféré, une recherche des anticorps contre le virus de l'hépatite C peut être effectuée après l'âge de 15 mois. La plupart des nourrissons infectés par le VHC au moment de la naissance n'ont pas de Symptôme et vont bien pendant l'enfance. Il n'existe aucune preuve que le virus de l'hépatite C se propage par l’Allaitement. Par prudence, une mère infectée devrait éviter l'allaitement si ses mamelons sont fissurés et présentent des saignements.[48]
Traitements alternatifs
Plusieurs traitements alternatifs visent à améliorer les fonctions du foie, plutôt que de traiter le virus lui-même, ce qui ralentit l'évolution de la maladie ou aide au maintien de la qualité de vie du patient. À titre d'exemple, des extrait de Chardon-Marie et de Réglisse sont vendus pour leurs effets présumés sur le VHC, le premier est censé stimuler les fonctions hépatiques, et le deuxième est réputé avoir un léger effet antiviral et augmenter la pression artérielle.[49]
Traitements en cours d’expérimentation
L'utilisation des molécules qui stimulent la production des globules rouges (érythropoïétine - EPO) ou blancs (filgastrim ou G-CSF) est de plus en plus fréquente, ce qui améliore la qualité de vie des patients sous traitement et leur permet de continuer jusqu'au bout le traitement contre l'hépatite C.
La viramidine, est un précurseur de la ribavirine et a un effet davantage ciblé sur le foie et qui peut, par conséquent, être plus efficace contre l'hépatite C et mieux toléré à dose équivalente est en cours d’essai clinique de phase III contre l'hépatite C. Il sera utilisé en association avec l’Interféron, de la même manière que la ribavirine. Cependant, ce médicament ne devrait pas être actif contre les souches résistantes à la ribavirine, et son utilisation contre les infections pour lesquelles un traitement ribavirine/interféron a déjà échoué, n'a pas été expérimentée.
Il existe de nouveaux médicaments en cours de développement comme les Inhibiteur de la protéase (comprenant le VX 950 ) et les inhibiteurs de polymérase (tels que le NM 283), mais leur développement est au stade de la phase I[50][51] ou II pour le telaprevir, même si cette molécule de nombreux effets secondaires, limitant la durée de prescription[52][53].Un inhibiteur de protéase, le BILN 2061, a dû être abandonné en raison de problèmes de sécurité au début de l'expérimentation clinique. Certains nouveaux médicaments plus récents apportent une certaine aide pour le traitement de l'hépatite C, ce sont l’Albuferon, le Zadaxin, et le DAPY. Un oligonucléotide antisens le Phosphorothioate prend pour cible le virus de l'hépatite C [54] Un oligonucléotide antisense, le Morpholino a montré des effets prometteurs dans les études précliniques [55] toutefois, on a prouvé qu’ils diminuaient peu la charge virale reduction.
Il existe des Immunoglobulines contre le virus de l'hépatite et de nouveaux types sont en cours de développement. Jusqu'à présent, leurs rôles n'ont pas été formulés clairement comme il n’a pas été prouvé qu’ils pouvaient jouer un rôle dans la guérison d’une infection chronique ou dans la prévention de l'infection aiguë après exposition (par exemple, piqûres par une aiguille contaminée). Ils ont un rôle limité chez les patients transplantés.
Les examens médicaux deviennent de plus en plus sensibles et fiables, aussi bien dans la détection du virus que dans l'approche non-invasive du suivi de l'état du foie (via des analyses sanguines, comme l'Actitest / Fibrotest®, le FibroMètre, ou par élastographie - le FibroScan®).
Et finalement, l'aspect humain de l'hépatite C devient de plus en plus important, avec une meilleure prise en compte par les médecins et autres intervenants des attentes de personnes malades, de leur vécu et de leurs difficultés.
De nouvelles études sont aussi en cours et augmentent les chances de réussite chez les patients non naïfs et/ou rechuteurs de génotype 1. TMC425 phase 2b [56]
Le Bocéprévir (phase 3) [57] est également très prometteur en phase 3 à l'heure actuelle
L'avantage du TMC425 est administré une fois par jour au lieu de trois fois par jour pour le Bocéprévir. Ceci évite des oublis ou retards de prise de la substance chez le patient.
Effets secondaires
Le traitement peut être physiquement éprouvant, en particulier pour les patients qui ont des antécédents de toxicomanie ou d'alcoolisme.
Les effets secondaires sont nombreux, varient suivant les personnes, mais disparaissent à la fin du traitement. Dans la plupart des cas, le patient doit cesser toute activité à cause de ces effets : travail, sport, ...
- Interféron : L'injection d'interféron provoque le syndrome pseudo-grippal : fortes fièvres, courbatures et mal de tête. Les autres symptômes sont la fatigue, les insomnies, la perte des cheveux, la sécheresse de la peau. Un trouble du caractère et un dérèglement de la glande thyroïde peuvent aussi survenir.
- Ribavirine : L'effet secondaire principal est l'anémie: essoufflement, cœur rapide, fatigue...
L'association de ces deux médicaments provoque les effets secondaires indiqués ci-dessus, mais ces effets sont plus fréquents.
Ces effets secondaires apportent d'autres complications :
- Sécheresse de la peau : Déshydratation avec envie de boire continuelle, éruptions cutanées de toutes tailles et toutes sortes sur tout le corps, Conjonctivite provoqué par l'absence de protection de l'œil (larmes).
- dépression avec envie de suicide [58]
Les insomnies, ajouté à la fatigue, peuvent amener un état d'épuisement.
Prévention
Les lignes directrices suivantes peuvent permettre de prévenir l'infection par le virus de l'hépatite C, qui se propage par le sang:
- Éviter de partager aiguilles utilisées pour les drogues injectables ou toute autre drogue, y compris celles inhalées avec des pailles.
- Évitez les tatouages dans des conditions d’hygiène défectueuses.
- Évitez les piercings et l’acupuncture dans des conditions d’hygiène défectueuses.
- Évitez les blessures par aiguille à injection.
- Évitez le partage des articles personnels comme les brosses à dents, les rasoirs, les coupe-ongles.
- Utilisez des préservatifs en latex pour les rapports sexuels en dehors d’une relation monogame durable [59]
Les tenants de la Réduction des risques pensent que les stratégies telles que la fourniture d’aiguilles et de seringues neuves, et l’apprentissage de procédures sécurisées d’injection de drogues sont susceptibles de diminuer le risque de propagation de l'hépatite C entre les consommateurs de drogues injectables.
Il n’existe aucun vaccin préventif ou curatif de l'hépatite C. Des vaccins sont en cours de développement et certains ont donné des résultats encourageants.[60]
Données nationales
Etats unis
Aux États-Unis, les personnes qui ont un passé d’usager de drogues par voie intraveineuse, par inhalation, par voie nasale, qui ont eu des tatouage s, ou qui ont été exposés au sang au cours de rapports sexuels non protégés ou de pratiques sociales exposées présentent un risque accru pour cette maladie. L'hépatite C est la principale cause de Transplantation hépatique aux États-Unis.
Notes
- ↑ a et b Ryan KJ; Ray CG (editors), Sherris Medical Microbiology, McGraw Hill, 2004 (réimpr. 4th ed.), pp. 551–2 p. (ISBN 0838585299)
- ↑ OMS - Hépatite C sur http://www.who.int. Consulté le 2 janvier 2009
- ↑ 2000 Albert Lasker Award for Clinical Medical Research, The Lasker Foundation. Accessed 20 February 2008
- ↑ Choo Q, Kuo G, Weiner A, Overby L, Bradley D, Houghton M, « Isolation of a cDNA clone derived from a blood-borne non-A, non-B viral hepatitis genome. », dans Science, vol. 244, no 4902, 1989, p. 359-62 [lien DOI]
- ↑ Kuo G, Choo Q, Alter H, Gitnick G, Redeker A, Purcell R, Miyamura T, Dienstag J, Alter M, Stevens C, « An assay for circulating antibodies to a major etiologic virus of human non-A, non-B hepatitis. », dans Science, vol. 244, no 4902, 1989, p. 362-4 [lien DOI]
- ↑ Houghton, M., Q.-L. Choo, and G. Kuo. NANBV Diagnostics and Vaccines. European Patent No. EP-0-3 18-216-A1. European Patent Office (filed 18 Novembre 1988, published 31 Mai 1989).
- ↑ a et b Paul Elias. ""Hepatitis Drug-Maker Complaints Reviewed", The Associated Press, 27 February 20
- ↑ 2000 Winners Albert Lasker Award for Clinical Medical Research, The Lasker Foundation. Accessed 20 February 2008.
- ↑ Ulrich P, Romeo J, Lane P, Kelly I, Daniel L, Vyas G, « Detection, semiquantitation, and genetic variation in hepatitis C virus sequences amplified from the plasma of blood donors with elevated alanine aminotransferase. », dans J Clin Invest, vol. 86, no 5, 1990, p. 1609-14 [texte intégral lien DOI]
- ↑ a et b Marcellin P, Hepatitis C: the clinical spectrum of the disease, J Hepatol, 1999;31:9-16
- ↑ Villano SA, Vlahov D, Nelson KE, Cohn S, Thomas DL, « Persistence of viremia and the importance of long-term follow-up after acute hepatitis C infection », dans Hepatology, vol. 29, no 3, 1999, p. 908–14 [lien PMID lien DOI]
- ↑ Cox AL, Netski DM, Mosbruger T, et al, « Prospective evaluation of community-acquired acute-phase hepatitis C virus infection », dans Clin. Infect. Dis., vol. 40, no 7, 2005, p. 951–8 [lien PMID lien DOI]
- ↑ NIH Consensus Development Conference on Management of Hepatitis C: 2002. Consulté le 2008-02-22
- ↑ Jaeckel E, Cornberg M, Wedemeyer H, Santantonio T, Mayer J, Zankel M, Pastore G, Dietrich M, Trautwein C, Manns MP, « Treatment of acute hepatitis C with interferon alfa-2b », dans New England Journal of Medicine, vol. 345, no 20, Nov {{{année}}}, p. 1452-1457 [lien DOI]
- ↑ Pascual M, Perrin L, Giostra E, Schifferli J, « Hepatitis C virus in patients with cryoglobulinemia type II. », dans J Infect Dis, vol. 162, no 2, 1990, p. 569-70
- ↑ Johnson R, Gretch D, Yamabe H, Hart J, Bacchi C, Hartwell P, Couser W, Corey L, Wener M, Alpers C, « Membranoproliferative glomerulonephritis associated with hepatitis C virus infection. », dans N Engl J Med, vol. 328, no 7, 1993, p. 465-70 [lien DOI]
- ↑ Zignego AL, Ferri C, Pileri SA, Caini P, Bianchi FB; for the Italian Association of the Study of Liver (A.I.S.F.) Commission on Extrahepatic Manifestations of HCV infection, « Extrahepatic manifestations of Hepatitis C Virus infection: A general overview and guidelines for a clinical approach », dans Dig Liver Dis., 2006, p. E-publication
- ↑ Netski DM, Mosbruger T, Depla E et als. Humoral immune response in acute hepatitis C virus infection, Clin Infect Dis, 2005;41:667-675
- ↑ a et b Maheshwari A, Ray S, Thuluvath Pj, Acute hepatitis C, Lancet, 2008;372:321-332
- ↑ Farci P, Alter HJ, Wong DC, et als. Prevention of hepatitis C virus infection in chimpanzees after antibody-mediated in vitro neutralization, Proc Natl Acad Sci USA, 1994;91:7792-7796
- ↑ What is hepatitis?, Planification familiale, accessed May 15, 2007
- ↑ Thompson S, Hernberger F, Wale E, Crofts N, « Hepatitis C transmission through tattooing: a case report », dans Aust N Z J Public Health, vol. 20, no 3, 1996, p. 317-8
- ↑ Kapoor D, Saxena R, Sood B, Sarin SK, Blood transfusion practices in India: results of a national survey, Indian J Gastroenterol 2000; 19: 64-67
- ↑ Simonsen L, Kane A, Lloyd J, Zaffran M, Kane M, Unsafe injections in the developing world and transmission of bloodborne pathogens: a review, Bull World Health Organ, 1999;77:789-800
- ↑ Karmochkine M, Carrat F, Dos Santos O, Cacoub P, Raguin G, « A case-control study of risk factors for hepatitis C infection in patients with unexplained routes of infection », dans J. Viral Hepat., vol. 13, no 11, 2006, p. 775–82 [lien PMID lien DOI]
- ↑ Lack of evidence of sexual transmission of hepatit...[Am J Gastroenterol. 2004] - PubMed Result
- ↑ Sexual Transmission of Hepatitis C | Hepatitis Central News, Updates and Commentary
- ↑ Hepatitis C: FAQ | CDC Viral Hepatitis
- ↑ Hahn JA, « Sex, Drugs, and Hepatitis C Virus », dans J Infect Dis, vol. 195, 2007, p. 1556–9 [lien DOI]
- ↑ Roberts EA, Yeung L, Maternal-infant transmission of hepatitis C virus infection, Hepatology, 2002;36:S106-S113
- ↑ Mast EE, Hwang LY, Seto DS, et als. Risk factors for perinatal transmission of hepatitis C virus (HCV) and the natural history of HCV infection acquired in infancy, J Infect Dis, 2005;192:1880-1889
- ↑ European Paediatric Hepatitis C Virus Network, A significant sex—but not elective cesarean section—effect on mother-to-child transmission of hepatitis C virus infection, J Infect Dis, 2005;192:1872-1879
- ↑ WHO. Hepatitis C—global prevalence (update). Wkly Epidemiol Rec 1999;49:421-428
- ↑ Alter MJ, Kruszon-Moran D, Nainan OV, et als. The prevalence of hepatitis C virus infection in the United States, 1988 through 1994, N Engl J Med, 1999;341:556-562
- ↑ Ruiz J, Molitor F, Plagenhoef J, « Trends in hepatitis C and HIV infection among inmates entering prisons in California, 1994 versus 1999. », dans AIDS, vol. 16, no 16, 2002, p. 2236-8
- ↑ Campbell J, Hagan H, Latka M, Garfein R, Golub E, Coady M, Thomas D, Strathdee S, « High prevalence of alcohol use among hepatitis C virus antibody positive injection drug users in three US cities. », dans Drug Alcohol Depend, vol. 81, no 3, 2006, p. 259-65 [lien DOI]
- ↑ McGovern B, Wurcel A, Kim A, Schulze zur Wiesch J, Bica I, Zaman M, Timm J, Walker B, Lauer G, « Acute hepatitis C virus infection in incarcerated injection drug users. », dans Clin Infect Dis, vol. 42, no 12, 2006, p. 1663-70 [lien DOI]
- ↑ Meffre C, Le Strat Y, Delarocque-Astagneau E, Antona D, Desenclos JC. Prévalence des hépatites B et C en France en 2004. InVS, Saint-Maurice, 2006.
- ↑ Frank C, Mohamed M, Strickland G, Lavanchy D, Arthur R, Magder L, El Khoby T, Abdel-Wahab Y, Aly Ohn E, Anwar W, Sallam I, « The role of parenteral antischistosomal therapy in the spread of hepatitis C virus in Egypt. », dans Lancet, vol. 355, no 9207, 2000, p. 887-91 [lien DOI]
- ↑ Armstrong GL, Alter MJ, McQuillan GM, Margolis HS, The past incidence of hepatitis C virus infection: implications for the future burden of chronic liver disease in the United States, Hepatology, 2000; 31: 777-782
- ↑ Watanabe H, Saito T, Shinzawa H, Okumoto K, Hattori E, Adachi T, Takeda T, Sugahara K, Ito J, Saito K, Togashi H, Suzuki R, Hayashi M, Miyamura T, Matsuura Y, Kawata S, « Spontaneous elimination of serum hepatitis C virus (HCV) RNA in chronic HCV carriers: a population-based cohort study », dans J Med Virol, vol. 71, no 1, 2003, p. 56-61 [lien DOI]
- ↑ Scott J, McMahon B, Bruden D, Sullivan D, Homan C, Christensen C, Gretch D, « High rate of spontaneous negativity for hepatitis C virus RNA after establishment of chronic infection in Alaska Natives », dans Clin Infect Dis, vol. 42, no 7, 2006, p. 945-52 [lien DOI]
- ↑ Mallet V, Gilgenkrantz H, Serpaggi J et Als. The relationship of regression of cirrhosis to outcome in chronic hepatitis C, Ann Int Med, 2008;149:399-403
- ↑ Fried MW, Shiffman ML, Reddy KR et als. Peginterferon alfa-2a plus ribavirin for chronic hepatitis C virus infection, N Engl J Med, 2002;347:975-982
- ↑ Shiffman ML, Suter F, Bacon BR, et al., « Peginterferon Alfa-2a and Ribavirin for 16 or 24 weeks in HCV genotype 2 or 3 », dans N Engl J Med, vol. 357, no 2, 2007, p. 124–134 [texte intégral lien DOI]
- ↑ Castillo I, Rodriguez-Iñigo E, López-Alcorocho JM, et al., « Hepatitis C virus replicates in the liver of patients who have a sustained response to antiviral treatment », dans Clin Infect Dis, vol. 43, no 10, 2006, p. 1277–83 [lien DOI]
- ↑ Maynard M, Pradat P, Bailly F, Rozier F, Nemoz C, Si Ahmed S, Adeleine P, Trépo C, « Amantadine triple therapy for non-responder hepatitis C patients. Clues for controversies (ANRS HC 03 BITRI). », dans J Hepatol, vol. 44, no 3, 2006, p. 484-90 [lien DOI]
- ↑ Mast E, « Mother-to-infant hepatitis C virus transmission and breastfeeding. », dans Adv Exp Med Biol, vol. 554, p. 211-6
- ↑ NCCAM. Hepatitis C and Complementary and Alternative Medicine: 2003 Update. May 2004. Accessed 25-02-2007.
- ↑ Hinrichsen H, Benhamou Y, Wedemeyer H, Reiser M, Sentjens R, Calleja J, Forns X, Erhardt A, Crönlein J, Chaves R, Yong C, Nehmiz G, Steinmann G, « Short-term antiviral efficacy of BILN 2061, a hepatitis C virus serine protease inhibitor, in hepatitis C genotype 1 patients. », dans Gastroenterology, vol. 127, no 5, 2004, p. 1347-55 [lien DOI]
- ↑ Lamarre D, Anderson P, Bailey M, Beaulieu P, Bolger G, Bonneau P, Bös M, Cameron D, Cartier M, Cordingley M, Faucher A, Goudreau N, Kawai S, Kukolj G, Lagacé L, LaPlante S, Narjes H, Poupart M, Rancourt J, Sentjens R, St George R, Simoneau B, Steinmann G, Thibeault D, Tsantrizos Y, Weldon S, Yong C, Llinàs-Brunet M, « An NS3 protease inhibitor with antiviral effects in humans infected with hepatitis C virus. », dans Nature, vol. 426, no 6963, 2003, p. 186-9 [lien DOI]
- ↑ McHutchison JG, Everson GT, Gordon SC, et als. Telaprevir with peginterferon and ribavirin for chronic HCV genotype 1 infection, N Engl J Med, 2009;360:1827-1838
- ↑ Hézode C, Forestier N, Dusheiko G et als. Telaprevir and peginterferon with or without ribavirin for chronic HCV infection, N Engl J Med ,2009;360:1839-1850
- ↑ Zhang H, Hanecak R, Brown-Driver V, Azad R, Conklin B, Fox M, Anderson K, « Antisense oligonucleotide inhibition of hepatitis C virus (HCV) gene expression in livers of mice infected with an HCV-vaccinia virus recombinant. », dans Antimicrob Agents Chemother, vol. 43, no 2, 1999, p. 347-53 [texte intégral]
- ↑ McCaffrey A, Meuse L, Karimi M, Contag C, Kay M, « A potent and specific morpholino antisense inhibitor of hepatitis C translation in mice. », dans Hepatology, vol. 38, no 2, 2003, p. 503-8 [lien DOI]
- ↑ http://feed.ne.cision.com/wpyfs/00/00/00/00/00/0F/35/80/wkr0011.pdf
- ↑ http://clinicaltrials.gov/ct2/show/NCT00708500?term=boceprevir&rank=3
- ↑ J-P Lang, S Schmitter, S Benassi, L Michel : Prise en charge de l’hépatite chronique C : une urgence psychiatrique ? in l'Information Psychiatrique. Volume 85, Numéro 7, 629-39, septembre 2009, Addictions
- ↑ Hepatitis C: Fact Sheet. Consulté le 15-04-2008
- ↑ Manns MP, Foster GR, Rockstroh JK, Zeuzem S, Zoulim F, Houghton M, « The way forward in HCV treatment—finding the right path », dans Nat Rev Drug Discov, vol. 6, no 12, 2007, p. 991–1000 [lien PMID lien DOI]
Voir aussi
Liens internes
Liens en anglais
- National Hepatitis C Program U.S. Department of Veterans Affairs
- CDC's Hepatitis C Fact Sheet
- CDC's Hepatitis C Frequently Asked Questions
- Hepatitis C Virus (HCV) Details
- Hepatitis Australia Hepatitis Australia
- Hepatitis C homepage of the UK National Health Service
- The hepatitis C trust - hepatitis C resource for the UK
- Special issue on virology and clinical advances of HCV
- National HCV Prison Coalition (U.S.A)
- HepCFacts UK information for children and young people about hepatitis C
- National Hepatitis C Program U.S. Department of Veterans Affairs
Liens en français
- Fédération SOS hépatites, Fédération d'Associations Régionales de malades atteints d'hépatites virales
- Hépatite C : dépistage et traitement, conférence de consensus, 1997, màj 2002
- Traitement de l'hépatite C, conférence de consensus, 2002
- hepatites.net
Site d'entraide et de soutient aux personnes vivtimes d'hépatites, SIDA et coinfections ainsi quà leurs proches.
Site Belge d'information concernant les hépatites CHAC (carrefour hépatites aide et contact).
Site Belge et blog en passe d'être réorganisé d'un patient HVC A1 F2 dont le traitement a échoué.
Bibliographie
- Christian Trépo, Philippe Merle, Fabien Zoulim : Hépatites virales B et C , (Pour professionnels, patients et entourage), Ed.: John Libbey Eurotext, 2006, Coll.: Pathologie science formation, ISBN 2742006044
- Portail de la médecine
- Portail des maladies infectieuses
Catégories : Hépatite | Flaviviridae | Infection virale
Wikimedia Foundation. 2010.
