- Obtention de l'helium
-
Hélium
 Pour les articles homonymes, voir Helium (homonymie).
Pour les articles homonymes, voir Helium (homonymie).L'hélium est un gaz rare, ou gaz noble pratiquement inerte. De numéro atomique 2, il débute la série des gaz nobles dans le Tableau périodique des éléments. Son point d'ébullition est le plus bas parmi les corps connus, et il n'existe sous forme solide qu'au-dessus d'une pression de 25 atm. Il possède deux isotopes stables : 4He, le plus abondant, et 3He. Ces deux isotopes, contrairement à la plupart des éléments chimiques, diffèrent sensiblement dans leurs propriétés, car le rapport de leurs masses atomiques est important. D'autre part, les effets quantiques, sensibles à basse énergie, leur donnent des propriétés très différentes. Le présent article traite essentiellement de l'4He. Le lecteur se réfèrera à l'article hélium 3 pour ce qui concerne les propriétés spécifiques de l'isotope 3He.
L'hélium est, après l'hydrogène, l'élément le plus abondant de l'Univers. Actuellement, pratiquement tout l'hélium a été produit lors de la nucléosynthèse primordiale. Les autres origines sont discutées ci-après dans la sous-section Abondance naturelle.
Sommaire
Propriétés physiques
L'hélium est un gaz incolore, inodore, et non toxique. Il est pratiquement inerte chimiquement, et monoatomique en toutes circonstances, et, dans un vaste domaine de températures et de pressions, il se comporte pratiquement comme un gaz idéal.
Isotopes
Article détaillé : Hélium 3.On connaît sept isotopes de l'hélium, mais seuls l'hélium 3 et l'hélium 4 sont stables. Dans l'atmosphère terrestre, il n'y a qu'un atome d'hélium 3 pour un million d'hélium 4[1]. Contrairement à la plupart des éléments, l'abondance isotopique de l'hélium varie considérablement selon son origine, en raison des processus de formation différents. L'isotope le plus abondant, l'hélium 4, est produit sur terre par la radioactivité α d'éléments lourd : les particules α qui y sont produites sont des noyaux d'hélium 4 complètement ionisés. L'hélium 4 est un noyau à la stabilité inhabituelle, parce que ses nucléons sont arrangés en couches complètes. Il a par ailleurs été formé en quantités énormes lors de la nucléosynthèse primordiale[2].
L'hélium 3 n'est présent sur terre qu'en traces ; la plupart date de la formation de la Terre, bien qu'un peu tombe encore dessus, piégée dans la poussière interstellaire[3]. Des traces sont aussi produites encore par la radioactivité β du tritium[4]. Les roches de la croûte terrestre ont des rapports isotopiques variant jusqu'à un facteur 10, et ces rapports peuvent être utilisés pour la détermination de l'origine des roches et la composition du manteau terrestre[3]. L'hélium 3 est bien plus abondant dans les étoiles, comme produit de la fusion nucléaire. Par suite, dans le milieu interstellaire, le rapport isotopique est environ 100 fois plus élevé que sur Terre[5]. Les matériaux extraplanétaires, comme le régolithe de la Lune ou des astéroïdes, ont des quantités en traces d'hélium 3 provenant du vent solaire. La surface de la Lune en contient une concentration de l'ordre de 10-8 [6],[7]. Un certain nombre d'auteurs, commençant par Gerald Kulcinski en 1986[8], ont proposé d'explorer la Lune, d'extraire l'hélium 3 du régolithe et de l'utiliser pour la fusion nucléaire.
L'hélium 4 peut être refroidi jusqu'à environ 1 K par évaporation. L'hélium 3, qui a un point d'ébullition inférieur, peut être refroidi jusqu'à 0,2 K par la même méthode. Des mélanges à parts égales d'hélium 3 et 4 se séparent, au-dessous de 0,8 K car ils ne sont plus miscibles, en raison de leurs différences (ils obéissent aux deux statististique quantiques différentes[N 1]). Les réfrigérateurs à dilution utilisent cette propriété pour atteindre quelques millikelvins.
On peut fabriquer par réactions nucléaires d'autres isotopes de l'hélium, qui sont instables, et se désintègrent rapidement vers d'autres noyaux. L'isotope de vie la plus courte, si on peut même parler d'isotope dans ce cas est l'hélium 2 (2 protons, sans neutron), qui se désintègre en deux protons en 3×10-27 s. L'hélium 5, et l'hélium 7 se désintègrent par émission d'un neutron, avec une de demi-vie de 7,6×10-23 s, et 2,9×10-21 s respectivement. L'hélium 6 et l'hélium 8 se désintègrent par radioactivité β, avec une demi-vie de 0,8 s et 0,119 s respectivement. Les isotopes 6 et 8 ont une structure lâche, dans laquelle des neutrons orbitent loin du cœur, ce que l'on appelle halo nucléaire.
Gaz
La conductivité thermique de l'hélium gazeux est supérieure à celle de tous les gaz, sauf l'hydrogène, et sa chaleur spécifique est exceptionnellement élevée. Son coefficient Joule-Thomson est négatif à température ambiante, ce qui signifie que, contrairement à la plupart des gaz, il se réchauffe lorsqu'il peut se détendre librement. La température d'inversion de Joule-Thomson est d'environ 40 K soit -233,2 °C à la pression d'1 atm[9]. Une fois refroidi en dessous de cette température, l'hélium peut être liquéfié par le refroidissement dû à sa détente.
L'hélium est aussi le gaz le moins hydrosoluble de tous les gaz connus[10]. En raison de la petite taille de ses atomes, sa vitesse de diffusion à travers les solides est égale à trois fois celle de l'air et environ 65 % celle de l'hydrogène.
L'indice de réfraction de l'hélium est plus proche de l'unité que celui de n'importe quel autre gaz[11]. La vitesse du son dans l'hélium est supérieure à celle dans tout autre gaz, sauf l'hydrogène[12].
Contrairement au plasma, le gaz est un excellent isolant électrique.
Plasma
 Une lampe à décharge fonctionnant à l'hélium.
Une lampe à décharge fonctionnant à l'hélium. Des problèmes pour écouter le fichier ? Aidez-moi
Des problèmes pour écouter le fichier ? Aidez-moiLa plupart de l'hélium extraterrestre se trouve dans l'état de plasma, dont les propriétés diffèrent notablement de celles de l'hélium atomique. Dans le plasma, les électrons de l'hélium ne sont pas liés au noyau, ce qui conduit à une très grande conductivité électrique, même quand l'ionisation est partielle. Les particules chargées sont très sensibles aux champs électrique et magnétique. Par exemple, dans le vent solaire, l'hélium et l'hydrogène ionisés interagissent avec la magnétosphère terrestre, donnant lieu aux phénomènes de courants de Birkeland et aux aurores polaires[13].
Comme les autres gaz nobles, l'hélium a des niveaux d'énergie métastables qui lui permettent de rester excité dans une décharge électrique dont la tension est inférieure à son potentiel d'ionisation. Ceci permet son utilisation dans les lampes à décharge.
Liquide
Contrairement aux autres éléments, l'hélium reste liquide jusqu'au zéro absolu, à des pressions inférieures à 25 atm. Ceci est une conséquence directe de la mécanique quantique : plus précisément l'énergie des atomes dans l'état fondamental du système est trop élevée pour permettre la solidification (voir solide). En outre, les phases liquide et solide ont des indices de réfraction très voisins, ce qui rend difficile l'observation.
Au dessous du point d'ébullition à 4,22 K, et au-dessus du point lambda à 2,1768 K, l'hélium 4 existe sous forme d'un liquide normal incolore, appelé hélium I[9]. Comme les autres liquides cryogéniques, il bout quand il est chauffé, et se contracte quand sa température est abaissée. L'hélium I a un indice de réfraction voisin de celui des gaz : 1,026, ce qui rend sa surface tellement difficile à apercevoir que l'on utilise souvent des flotteurs de mousse de polystyrène pour voir son niveau[14]. Ce liquide incolore a une viscosité très faible, et une densité 1/8, qui n'est qu'un quart de la valeur prévue par la physique classique[14]. Il faut recourir à la mécanique quantique pour expliquer cette propriété, et donc, l'hélium liquide sous ses diverses formes est appelé fluide quantique, pour signifier que les effets de la mécanique quantique, normalement sensibles seulement à l'échelle microscopique, se manifestent à l'échelle macroscropique. Ceci s'interprète comme un effet du fait que le point d'ébullition est si rapproché du zéro absolu que les mouvements thermiques aléatoires ne peuvent plus masquer les propriétés atomiques[14].
Superfluide
Article détaillé : Superfluide.L'hélium liquide en-dessous du point lambda commence à présenter des caractères tout à fait inhabituels, dans un état appelé hélium II.
À la transition de l'hélium I vers l'hélium II au point lambda, l'hélium se dilate. Quand la température baisse, l'hélium II continue à se dilater, jusqu'environ 1 K, où il recommence à se contracter comme la plupart des corps.
L'hélium II peut s'écouler à travers des capillaires de 10-7 à 10-8 m, sans viscosité mesurable[1]. Cependant quand on mesure la viscosité entre deux disques tournant l'un par rapport à l'autre, on trouve une viscosité comparable à celle de l'hélium gazeux. La théorie actuelle explique ce fait en utilisant un modèle à deux fluides de László Tisza pour l'hélium II. Dans ce modèle, l'hélium liquide, au-dessous du point lambda, consiste en un mélange d'atomes d'hélium dans l'état fondamental, et d'atomes dans des états excités, qui se comportent plus comme un fluide ordinaire[15]
Une illustration de cette théorie est donnée par l'effet fontaine. Dans cette expérience, un tube vertical, présentant un petit ajutage à son extrémité supérieure, est plongé par son extrémité inférieure dans un bain d'hélium II. Il y est bouché par un disque fritté, au travers duquel seul le fluide sans viscosité peut circuler. Si l'on chauffe le tube, en l'éclairant par exemple, on va y transformer la partie superfluide en fluide ordinaire. Pour rétablir l'équilibre des deux fluides avec le bain, du superfluide va pénétrer à travers le bouchon fritté, et pour conserver le volume, une partie du contenu du tube sera éjecté par l'ajutage supérieur, formant un jet, que l'on peut interrompre en cessant de chauffer[N 2].
La conductivité thermique de l'hélium II est supérieure à celle de tout autre corps connu. Ceci empêche l'hélium II de bouillir, car tout apport de chaleur se transporte immédiatement à la surface, où il provoque tout simplement l'évaporation en gaz. Cette conductivité est un million de fois supérieure à celle de l'hélium I, et plusieurs centaines de fois celle du cuivre[9]. Ceci est dû au fait que la conduction de la chaleur se fait par un mécanisme quantique exceptionnel. La plupart des matériaux bons conducteurs de la chaleur ont une bande de valence d'électrons libres qui servent à conduire la chaleur. L'hélium II n'a pas de telle bande, et pourtant conduit bien la chaleur. Le flux de chaleur obéit à des équations semblables aux équations d'onde de la propagation du son dans l'air. Quand de la chaleur est introduite, elle se déplace à 20 m⋅s-1 à 1,8 K dans l'hélium II. On appelle ces ondes deuxième son[16].
 L'hélium II rampe sur les surfaces de façon à rétablir l'équilibre hydrostatique.
L'hélium II rampe sur les surfaces de façon à rétablir l'équilibre hydrostatique.
Contrairement aux liquides ordinaires, l'hélium II rampe le long des surfaces, même, apparemment, contre la gravité. Il s'échappera d'un récipient non fermé en rampant sur les côtés, à moins qu'il ne rencontre un endroit moins froid où il s'évapore. Quelle que soit la surface, il se déplace en un film de quelque 30 nm. Ce film est appelé film de Rollin, en souvenir du physicien qui l'a caractérisé le premier, Bernard V. Rollin[16],[17],[18]. Suite à cet effet, et à la capacité de l'hélium II de passer rapidement à travers de petites ouvertures, il est difficile de confiner l'hélium liquide. À moins que le récipient ne soit astucieusement construit, l'hélium II escaladera les parois et passera à travers les vannes jusqu'à ce qu'il atteigne une région plus chaude où il s'évaporera. Les ondes qui se propagent le long d'un film de Rollin obéissent aux mêmes équations que les vagues en eau peu profonde, mais la force de rappel est ici la force de van der Waals à la place de la gravité[19]. Ces ondes sont connues sous le nom de troisième son[20].
Solide
Article détaillé : hélium solide.L'hélium ne se solidifie que sous l'effet de fortes pressions. Le solide pratiquement invisible et incolore qui en résulte est fortement compressible ; une compression en laboratoire peut réduire son volume de plus de 30 %[21]. Avec un module d'élasticité cubique de l'ordre de 5×107 Pa, il est cinquante fois plus compressible que l'eau. Dans des conditions normales de pression, et à l'inverse des autres éléments, l'hélium ne se solidifie pas et reste liquide jusqu'au zéro absolu. L'hélium solide nécessite une pression minimale d'environ 25 atm. Il est souvent assez difficile de distinguer l'hélium solide de l'hélium liquide, leurs indices de réfraction étant presque identiques. Le solide a une chaleur latente (chaleur de fusion) élevée et une structure cristalline hexagonale, comme celle de l'eau.
Propriétés chimiques
Avec le néon, l'hélium est chimiquement le moins réactif de tous les corps dans les conditions normales, en raison de sa valence égale à 0 [21]. Il peut néanmoins former des composés instables (excimères) avec le tungstène, l'iode, le fluor, le soufre et le phosphore en phase plasma, par décharge ou d'une autre manière. HeNe, HgHe10, WHe2 et les ions moléculaires He2+, He2++, HeH+, HeD+ ont été créés de cette manière. Cette technique a aussi permis la production de la molécule neutre He2, qui possède un plus grand nombre de systèmes de bandes, et HgHe, dont la cohésion ne semble reposer que sur des forces de polarisation. Théoriquement, d'autres composants comme le fluorohydrure d'hélium (HHeF) sont également possibles.
Il semblerait à l'heure actuelle que les seuls composés stables de l'hélium prouvés soient des complexes endoédriques de fullerènes, comme He@C60, qui désigne un atome d'hélium emprisonné dans une cage de fullerène C60.
Propriétés biologiques
L'hélium, neutre, dans les conditions standard, est non-toxique, ne joue aucun rôle biologique, et on en trouve des traces dans le sang humain. Si l'on en inhale assez pour que l'oxygène nécessaire à une respiration normale soit déplacé, l'asphyxie devient possible.
Inhalation
La voix d'une personne qui a inhalé de l'hélium temporairement change de timbre vers les harmoniques élevés : la vitesse du son dans l'hélium est presque 3 fois celle dans l'air ; et comme la fréquence fondamentale d'une cavité remplie de gaz est proportionnelle à la vitesse du son, l'inhalation d'hélium correspondra à une augmentation des fréquences de résonance de l'appareil phonatoire qui modulent la fréquence fondamentale donnée par les cordes vocales[1],[22], [23]. Un effet opposé, de baisse de timbre, peut être obtenu en inhalant un gaz dense, comme l'hexafluorure de soufre.
L'inhalation d'hélium à faible dose est normalement sans danger. Cependant l'utilisation d'hélium du commerce tout venant, comme celui utilisé pour gonfler des ballons, peut être dangereuse en raison des nombreux contaminants qu'il peut contenir, traces d'autres gaz, ou aérosols d'huile lubrifiante.
L'inhalation d'hélium en excès peut être dangereuse, puisque l'hélium est simplement un asphyxiant, qui déplace l'oxygène nécessaire à une respiration normale[1],[24]. La respiration d'hélium pur provoque l'asphyxie en quelques minutes. L'inhalation de l'hélium directement à partir de cylindres sous pression est extrêmement dangereuse, en raison du fort débit, qui peut résulter en un barotraumatisme qui déchire le tissu pulmonaire et peut être fatal[24],[25]. Cependant cet accident est assez rare, puisqu'on ne compte que deux décès entre 2000 et 2004 aux États-Unis[25].
À haute pression (plus de 20 atm ou 2 Mpa), un mélange d'hélium et d'oxygène (héliox) peut conduire à un syndrome nerveux des hautes pressions, une espèce d'effet contre-anesthésique ; en ajoutant un peu d'azote au mélange, on peut éviter le problème[26],[27].
Utilisation thérapeutique
L'hélium est administré dans des mélanges contenant un minimum de 20 % d'oxygène, à des patients aux prises avec une obstruction des voies respiratoires supérieures ou inférieures. La faible viscosité de l'hélium permet ainsi de diminuer le travail respiratoire.
Sécurité
Les mesures de sécurité en ce qui concerne l'hélium cryogénique sont semblables à celles nécessaires pour l'azote liquide ; sa température extrêmement basse peut résulter en brûlures par le froid.
Une inhalation en grande quantité en une seule fois, produit une légère asphyxie, conduisant à une courte mais dangereuse perte de conscience. On dénombre également certains cas d'embolies cérébrales ou de sérieux problèmes pulmonaires chez les personnes ayant inhalé de l'hélium sous pression.
Par ailleurs, le taux de dilatation entre la phase liquide et la phase gazeuse est tel qu'il peut provoquer des explosions en cas de vaporisation rapide, si aucun dispositif de limitation de pression n'est installé.
Les réservoirs d'hélium gazeux à 5–10 K doivent aussi être manipulés comme s'ils contenaient de l'hélium liquide, en raison de la dilatation thermique importante et rapide qui a lieu quand de l'hélium à moins de 10 K est amené à la température ordinaire[21].
Usages
Malgré son prix élevé, l'hélium est utilisé pour de nombreux usages qui exigent certaines de ses propriétés uniques, telles son point d'ébullition bas, sa faible densité, sa faible solubilité, sa haute conductivité thermique, ou son caractère chimiquement et biologiquement inerte. On le trouve dans le commerce sous forme liquide ou gazeuse. Sous forme liquide, on peut trouver des petits réservoirs appelés dewars, qui peuvent contenir jusqu'à 1 000 l d'hélium, ou dans des grands réservoirs ISO de capacités nominales jusqu'à 40 000 l. Sous forme gazeuse, de petites quantités d'hélium sont fournies dans des cylindres à haute pression contenant jusqu'à 8,5 m3 standards, tandis que les grandes quantités sont livrées en camions-citernes sous pression qui peuvent avoir des capacités jusqu'à 5 000 m3 standards.
Industriels
En raison de son caractère inerte, sa grande conductivité thermique, sa transparence aux neutrons, et parce qu'il ne forme pas d'isotope radioactifs au sein des réacteurs, on utilise l'hélium comme fluide de transfert de chaleur dans certains réacteurs nucléaires refroidis au gaz[28]
L'hélium est utilisé comme atmosphère protectrice lors de la croissance du silicium destiné à la fabrication de circuits intégrés, pour la production de titane et de zirconium, et en chromatographie en phase gazeuse[21], parce qu'il est inerte. Vu son inertie chimique, ses propriétés thermodynamiques et calorifiques idéales, la vitesse du son en son sein élevée, et un grand coefficient de Laplace, il est également utile dans les souffleries supersoniques[29] ou pour les installations d'étude de phénomènes transitoires[30].
L'hélium en mélange avec un gaz plus lourd, comme le xénon, est utile pour la réfrigération thermoacoustique, en raison du grand rapport des capacités thermiques et faible nombre de Prandtl[31]. L'inertie chimique de l'hélium a des avantages environnementaux sur d'autres systèmes de réfrigération, qui contribuent au trou d'ozone ou au réchauffement climatique[32].
Comme il diffuse à travers les solides trois fois plus vite que l'air, l'hélium est utilisé pour détecter les fuites dans les équipements à ultravide ou les réservoirs à haute pression[28]
Il est également utilisé avec des produits alimentaires (additif alimentaire autorisé par l'Union européenne sous la référence E939) pour permettre une vérification de l'étanchéité de l'emballage (voir liste des additifs alimentaires).
Scientifiques
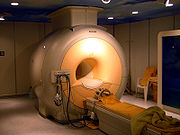
L'hélium liquide est utilisé pour refroidir les aimants supraconducteurs des appareil à IRM modernes
L'utilisation de l'hélium réduit les effets de distorsion dus aux variations de température dans l'espace séparant les lentilles de certains télescopes ou lunettes, en raison de son indice de réfraction exceptionnellement bas[9]. Cette méthode est spécialement utilisée pour les télescopes solaires, soumis à des variations importantes de température, mais pour lesquels une enceinte supportant la différence de pression entre l'atmosphère et le vide serait trop lourde[33],[34].
L'âge des roches et minéraux qui contiennent de l'uranium et du thorium peut être estimé en mesurant leur contenu en hélium par un procédé appelé datation à l'hélium[1],[9]
L'hélium liquide est aussi utilisé pour refroidir certains métaux aux températures extrêmement basses nécessitées pour la supraconductivité, par exemple pour les aimants supraconducteurs utilisés notamment pour les détecteurs à IRM. Le LHC au CERN utilise 96 t d'hélium liquide pour maintenir la température des aimants à 1,9 K[35]. De façon plus générale, l'hélium à basse température est utilisé en cryogénie.
Commerciaux et de loisir
En raison de sa faible solubilité dans le tissu nerveux, on utilise des mélanges d'hélium tels que le trimix, l'héliox et l'héliair pour la plongée profonde, afin de réduire les effets de la narcose à l'azote[36],[37]. Aux profondeurs supérieures à 150 m, de petites quantités d'hydrogène sont ajoutées au mélange hélium-oxygène pour contrebalancer le syndrome nerveux des hautes pressions[38]
À ces profondeurs, la faible densité de l'hélium diminue considérablement l'effort respiratoire[39].
Les lasers He-Ne ont diverses applications, en particulier les lecteurs de code-barres[1].
Dirigeables, ballons et fusées
Comme l'hélium est plus léger que l'air, il peut être utilisé pour gonfler des dirigeables et des ballons libres ou captifs. Bien que l'hydrogène ait une force portante approximativement 7 % supérieure, l'hélium a l'avantage d'être incombustible (et même ignifuge)[40].
L'exploration de l'atmosphère, notamment pour la météorologie s'effectue avec des ballons-sondes la plupart du temps gonflés à l'hélium.
En technique des fusées l'hélium, est utilisé comme milieu de déplacement pour gérer par pressurisation le combustible et le comburant dans les réservoirs en microgravité et pour assurer le mélange d'hydrogène et d'oxygène qui alimente les tuyères de propulsion. Il est aussi utilisé pour la purge de ces substances dans l'équipement au sol avant le lancement, et pour pré-refroidir l'hydrogène liquide des véhicules spatiaux. Par exemple, la fusée Saturn V consommait environ 370 000 m3 d'hélium pour décoller[21].
Ressources et purification de l'hélium
Abondance naturelle
L'hélium est le deuxième élément le plus abondant dans l'Univers connu (après l'hydrogène), et en constitue 23 % de la masse baryonique[1]. La grande majorité de l'hélium a été formé par la nucléosynthèse primordiale, dans les minutes suivant le Big Bang. C'est pourquoi la mesure de son abondance contribue à fixer certains paramètres des modèles cosmologiques. Dans la majeure partie de l'existence des étoiles, il est formé par la fusion nucléaire de l'hydrogène. En fin de vie, les étoiles utilisent l'hélium comme matière première pour la création d'éléments plus lourds, par des processus bien plus rapides, voire explosifs. Au total, l'hélium de l'univers ne provient qu'en très faible partie des étoiles.
Dans l'atmosphère terrestre, la concentration de l'hélium est 5,2×10-6 en volume[41],[42]. Cette basse concentration est assez constante dans le temps, en raison d'un équilibre entre la production continue d'hélium dans les roches et la fuite vers l'espace par divers mécanismes[43],[44]. Dans l'hétérosphère terrestre, une partie de la haute atmosphère, l'hélium et autres gaz légers sont les constituants les plus abondants.
Presque tout l'hélium sur terre provient de la radioactivité α. On le trouve principalement dans les composés d'uranium et de thorium, notamment la pechblende, la carnotite et la monazite, parce qu'ils émettent des particules α, qui sont des noyaux d'hélium ionisé He2+, qui se neutralisent immédiatement avec des électrons. On estime à 3 000 t l'hélium ainsi produit chaque année dans la lithosphère[45],[46],[47]. Dans la croûte terrestre, la concentration d'hélium est 8×10-9. Dans l'eau de mer, elle n'est que de 4×10-12. Il y en a aussi de petites quantités dans les eaux minérales, le gaz volcanique et le fer météoritique. Comme l'hélium est piégé comme le gaz naturel par les couches de roches imperméables, on trouve les plus hautes concentrations d'hélium dans les gisements de gaz naturel, d'où l'on extrait la plupart de l'hélium commercial. La concentration (par rapport au gaz naturel) varie dans une large fourchette de quelques millionièmes, à 7 % dans le comté de San Juan, Nouveau-Mexique[48],[49]
Extraction et purification
Pour l'utilisation à grande échelle, l'hélium est extrait par distillation fractionnée du gaz naturel, qui peut en contenir jusqu'à 7%[50]. Comme l'hélium a un point d'ébullition inférieur à tout autre corps, on utilise une basse température et une haute pression pour liquéfier presque tous les autres gaz (principalement l'azote et le méthane). L'hélium brut qui en résulte est alors purifié par exposition à des températures de plus en plus basses, ce qui fait précipiter pratiquement tout l'azote et autres gaz restants du mélange gazeux. On utilise enfin du charbon actif pour une étape finale de purification, pour obtenir ainsi de l'hélium de
 grade ⇔ qualité A, pur à 99,995 %[N 3],[51]. La principale impureté de l'hélium de qualité A est le néon. Pour terminer la purification, la plupart de l'hélium produit est liquéfié, par un processus cryogénique. La liquéfaction est nécessaire pour les applications utilisant l'hélium liquide, et permet d'ailleurs aux fournisseurs d'hélium de réduire le coût du transport à distance, car les plus grands réservoirs à hélium liquide ont une capacité au moins cinq fois plus grande que les remorques portant des cylindres d'hélium gazeux sous pression[52],a.
grade ⇔ qualité A, pur à 99,995 %[N 3],[51]. La principale impureté de l'hélium de qualité A est le néon. Pour terminer la purification, la plupart de l'hélium produit est liquéfié, par un processus cryogénique. La liquéfaction est nécessaire pour les applications utilisant l'hélium liquide, et permet d'ailleurs aux fournisseurs d'hélium de réduire le coût du transport à distance, car les plus grands réservoirs à hélium liquide ont une capacité au moins cinq fois plus grande que les remorques portant des cylindres d'hélium gazeux sous pression[52],a.En 2005, environ 160 millions de m3 d'hélium ont été extraits du gaz naturel, ou puisés dans les réserves, avec environ 83 % des États-Unis, 11 % d'Algérie, et le reste principalement de Russie et de Pologne[53]. Aux États-Unis, la plupart de l'hélium est extrait du gaz naturel de Hugoton, et des gisements voisins du Kansas, de l'Oklahoma et du Texas[52].
Une autre méthode de production et de purification de l'hélium est la diffusion du gaz naturel brut à travers des membranes semi-perméables ou d'autres barrières[54].
Il est possible de faire la synthèse de l'hélium en bombardant du lithium ou du bore avec des protons de haute énergie, mais cela ne constitue pas une méthode économiquement viable de production.[55].
Histoire
Découverte
La première indication de l'hélium est observée le 18 août 1868, comme une raie jaune brillante à une longueur d'onde de 587,49 nm dans le spectre de la chromosphère du Soleil. Cette raie est détectée par l'astronome français Jules Janssen pendant une éclipse totale à Guntur (Inde)[56],[1]. Au début, on pense que cette raie est celle du sodium. Le 20 octobre de la même année, l'astronome anglais Norman Lockyer observe une raie jaune dans le spectre solaire, qu'il appelle raie de Fraunhofer D3, en raison de sa proximité avec les raies bien connues D1 et D2 du sodium[57]. Il en conclut qu'elle est provoquée par un élément du Soleil inconnu sur terre. Lockyer et le chimiste anglais Edward Frankland nomment cet élément d'après le mot grec pour Soleil, ἥλιος (hélios)[58].
En 1882, Luigi Palmieri réussit pour la première fois à démontrer la présence d'hélium sur la terre, par l'analyse spectrale de la lave du Vésuve.
Le 26 mars 1895, le chimiste britannique Sir William Ramsay isole l'hélium sur terre en traitant la
 cleveite ⇔ clévéite[N 4] (une variété de pechblende, contenant au moins 10 % de terres rares) avec des acides minéraux. Ramsay cherchait de l'argon, mais, après avoir séparé l'azote et l'oxygène du gaz libéré par l'acide sulfurique, il remarque au spectroscope une raie jaune brillante qui coïncide avec la raie D3 observée dans le spectre solaire[59],[60],[61],[62].
cleveite ⇔ clévéite[N 4] (une variété de pechblende, contenant au moins 10 % de terres rares) avec des acides minéraux. Ramsay cherchait de l'argon, mais, après avoir séparé l'azote et l'oxygène du gaz libéré par l'acide sulfurique, il remarque au spectroscope une raie jaune brillante qui coïncide avec la raie D3 observée dans le spectre solaire[59],[60],[61],[62].Ces échantillons sont identifiés comme étant de l'hélium par Lockyer et le physicien britannique William Crookes. Indépendamment, il est isolé de la clévéite la même année par les chimistes Per Theodor Cleve et Abraham Langlet à Uppsala, qui accumulent suffisamment de gaz pour pouvoir déterminer avec précision sa masse atomique[1],[63],[64].
L'hélium avait aussi été isolé par le géochimiste états-unien William Francis Hillebrand, quelques années avant la découverte par Ramsay, en remarquant des raies spectrales inhabituelles à l'examen d'un échantillon d'uraninite. Mais Hillebrand attribue ces raies à l'azote. Sa lettre de félicitations à Ramsay présente un cas intéressant de découverte et de presque-découverte en science[65].
En 1907, Ernest Rutherford et Thomas Royds démontrent que les particules α sont des noyaux d'hélium, en permettant aux particules de pénétrer à travers une fine fenêtre en verre d'un tube où ils ont fait le vide, puis créant une décharge dans le tube pour étudier le spectre du nouveau gaz qui s'y trouve. En 1908, l'hélium est liquéfié pour la première fois par le physicien néerlandais Heike Kamerlingh Onnes, en refroidissant le gaz au-dessous de 1 K[66]. Il essaie de le solidifier en baissant encore la température, mais échoue, puisque l'hélium n'a pas de point triple. C'est un étudiant d'Onnes, Willem Hendrik Keesom, qui arrive à solidifier sous pression 1 cm3 d'hélium en 1926[67].
En 1938, le physicien soviétique Pyotr Leonidovitch Kapitsa découvre que l'hélium 4 n'a presque pas de viscosité aux températures proches du zéro absolu, phénomène maintenant nommé superfluidité[68]. En 1972, le même phénomène est observé dans l'hélium 3, mais à une température bien plus proche du zéro absolu, par les physiciens états-uniens Douglas D. Osheroff, David M. Lee, et Robert C. Richardson. Le phénomène dans l'hélium 3 est interprété comme la formation de paires d'atomes, qui sont des fermions, pour former des bosons, par analogie avec les paires de Cooper d'électrons à la base de la supraconductivité[69].
Production et usages
Après un forage pétrolier en 1903 à Dexter, Kansas, le jet de gaz produit était incombustible. Le géologue de l'état du Kansas, Erasmus Haworth collecta des échantillons du gaz produit et les rapporta à l'Université du Kansas, Lawrence. Avec l'aide des chimistes Hamilton Cady et David McFarland, il détermina que le gaz était, en volume, 72 % d'azote, 15 % de méthane (un pourcentage combustible seulement avec plus d'oxygène), et 12% de gaz inidentifiable.[1],[70]. Une analyse plus poussée montre à Cady et McFarland que 1,84 % de l'échantillon de gaz est de l'hélium[71] ,[72]. Ceci montre qu'en dépit de sa rareté globale sur terre, l'hélium est concentré en grandes quantités sous les Grandes Plaines états-uniennes, et disponible pour la production comme sous-produit de l'exploitation du gaz naturel[73]. Les plus grandes réserves d'hélium sont dans le gisement d'Hugoton et dans les gisements voisins du Kansas du sud-ouest, et des prolongements du Texas et de l'Oklahoma.
Ceci a permis aux États-Unis de devenir le premier producteur d'hélium du monde. Suivant la suggestion de Sir Richard Threlfall, la marine états-unienne subventionne trois petites usines expérimentales de production d'hélium pendant la Première Guerre mondiale. Le but est d'approvisionner les ballons captifs de barrage, avec ce gaz ininflammable et plus léger que l'air. Un total de 5 700 m3 d'hélium à 92 % est produit par ce programme, malgré le fait que précédemment, moins de 100 l ait été produit au total[59]. Une partie de ce gaz est utilisé pour le premier dirigeable gonflé à l'hélium dans le monde, le C-7 de la marine états-unienne, qui est inauguré pour son premier voyage de Hampton Roads en Virginie au terrain de Bolling à Washington, D.C. le 1er décembre 1921[74].
Bien que le procédé d'extraction par liquéfaction du gaz à basse température ne soit pas mis au point assez tôt pour jouer un rôle significatif pendant la Première guerre mondiale, la production va continuer. L'hélium est utilisé en premier lieu pour gonfler les aérostats. Cet usage va accroître la demande pendant la Deuxième guerre mondiale, de même que la demande pour la soudure à l'arc.
Le spectromètre de masse à hélium est également vital pour le projet Manhattan de bombe atomique[75].
Le gouvernement des États-Unis crée en 1925 une Réserve Nationale d'Hélium à Amarillo, Texas dans le but d'approvisionner les aérostats, militaires en temps de guerre, et civils en temps de paix[9]. En raison de l'embargo militaire contre l'Allemagne des États-Unis, la fourniture d'hélium a été restreinte, et le Hindenburg a dû être gonflé à l'hydrogène, avec les conséquences catastrophiques qui s'ensuivirent de son incendie. La consommation d'hélium après la deuxième Guerre mondiale diminue, mais la réserve est augmentée dans les années cinquante pour assurer la fourniture d'hélium liquide pour le lancement des fusées pendant la course à l'espace et la guerre froide. En 1965, la consommation d'hélium des États-Unis dépasse huit fois le maximum qu'elle a atteint pendant le temps de guerre[76].
Après les Amendements sur les lois de l'hélium de 1960 (loi publique 86-777), le Bureau des mines des États-Unis met en place cinq usines privées pour l'extraction de l'hélium du gaz naturel. Pour ce programme de préservation de l'hélium, le Bureau construit un gazoduc de 684 km de Bushton, Kansas à Cliffside, près d'Amarillo, gisement partiellement épuisé. Le mélange hélium-azote ainsi apporté est injecté et stocké jusqu'au moment des besoins, quand il est extrait et purifié[77].
En 1995, un milliard de m3 de gaz ont été réunis et la réserve a 1,4 milliards de dollars US de dettes, ce qui conduit le Congrès des États-Unis , en 1996 à cesser progressivement la réserve[1],[40]. La Loi de privatisation de l'hélium de 1996 qui s'ensuit (Loi publique 104–273) enjoint le Département de l'Intérieur des États-Unis de commencer à vider la réserve en 2005[78].
L'hélium produit entre 1930 et 1945 était pur à environ 98,3% (2% d'azote), ce qui convenait parfaitement pour les aérostats. En 1945, une petite quantité d'hélium à 99,9% était produite pour l'utilisation pour la soudure à l'arc. Dès 1949, des quantités commerciales d'hélium de qualité A à 99,995%[N 3] étaient disponibles[79].
Pendant plusieurs années, les États-Unis produisent plus de 90% de l'hélium commercialement utilisable dans le monde, les usines d'extraction du Canada, de Pologne, de Russie et d'autres nations produisant le reste. Au milieu des années 90, une nouvelle usine commence à produire à Arzew, en Algérie. Avec 1,7×107 m3 par an, elle peut couvrir toute la demande européenne, soit environ 16% de la production mondiale. Pendant ce temps-là, la consommation aux États-Unis a dépassé 15 000 t en 2000[80]. En 2004–2006, deux usines additionnelles sont construites, une à Ras Laffan (Qatar) produisant 9,2 tonnes d'hélium liquide par jour, et l'autre à Skikda (Algérie). L'Algérie est rapidement devenue le deuxième producteur d'hélium[52]. Au cours de cette période, la consommation d'hélium et les coûts de production ont augmenté[81]. Entre 2002 et 2007, les prix de l'hélium ont doublé[82], et pendant la seule année 2008, les principaux fournisseurs ont augmenté leurs prix d'environ 50%[citation nécessaire]. Ceci est lié à un état chronique de pénurie effective d'hélium, ce qui en fait une matière première stratégique, et recherchée par le monde scientifique et industriel, notamment pour de nouveaux usages comme la fabrication de fibres optiques et de circuits intégrés.
Notes
- ↑ Statistique de Bose-Einstein et statistique de Fermi-Dirac
- ↑ Voir un clip sur Youtube par ucilowtemp.
- ↑ a et b L'article original en anglais cite deux fois le pourcentage d'hélium de qualité A, une fois à 99,995 %, l'autre à 99,95 %. Il doit s'agir d'une erreur de typo. Pour choisir, le traducteur a eu recours à la référence a, qui donne 99,996 %. La valeur 99,995 % étant la plus proche a été retenue. C'est d'ailleurs celle qui est citée dans la version allemande.
- ↑ La version de Wikipedia anglaise nomme ce minéral cleveite, la version allemande Cleverit
Bibliographie
a. (en) Z. Cai, R. Clarke, N. Ward, W. J. Nuttall, B. A. Glowacki, « Modelling Helium Markets », 2007, University of Cambridge. Consulté le 22 juin 2009
- ↑ a , b , c , d , e , f , g , h , i , j et k (en) Nature's Building Blocks, John Emsley, Oxford University Press, Oxford, 2001, (ISBN 0-19-850341-5), p. 175–179
- ↑ (en) Achim Weiss, « Elements of the past: Big Bang Nucleosynthesis and observation », Max Planck Institute for Gravitational Physics. Consulté le 23 juin 2009;
(en) A. Coc et et al., « Updated Big Bang Nucleosynthesis confronted to WMAP observations and to the Abundance of Light Elements », dans Astrophysical Journal, vol. 600, 2004, p. 544 [lien DOI] - ↑ a et b (en) Don L. Anderson, G. R. Foulger, Anders Meibom, « Helium Fundamentals », 2006, MantlePlumes.orgMantlePlumes.org. Consulté le 20 juillet 2008 | commentaire =Abstract seulement. Article proposé à la vente
- ↑ (en) Aaron Novick, « Half-Life of Tritium », dans Physical Review, vol. 72, 1947, p. 972 [texte intégral lien DOI]
Accès restreint aux abonnés PROLA
- ↑ (en) G. N. Zastenker et E. Salerno, F. Buehler, P. Bochsler, M. Bassi, Y. N. Agafonov, N. A. Eismont, V. V. Khrapchenkov, H. Busemann, « Isotopic Composition and Abundance of Interstellar Neutral Helium Based on Direct Measurements », dans Astrophysics, vol. 45, no 2 mois =avril, 2002, p. 131–142 [texte intégral lien DOI (pages consultées le 20 juillet 2008)]| commentaire =Abstract seulement. Article proposé à la vente
- ↑ (en) Lunar Mining of Helium-3, 2007, Fusion Technology Institute of the University of Wisconsin-Madison. Consulté le 9 juillet 2008
- ↑ (en) E. N. Slyuta, A. M. Abdrakhimov, E. M. Galimov, « The estimation of helium-3 probable reserves in lunar regolith dans Lunar and Planetary Science XXXVIII », 2007. Consulté le 23 juin 2009
- ↑ (en) Eric R. Hedman, « A fascinating hour with Gerald Kulcinski », dans The Space Review, 16 janvier 2006 [texte intégral (page consultée le 23 juin 2009)]
- ↑ a , b , c , d , e et f (en) L. W. Brandt, (Clifford A. Hampel, éd.) The Encyclopedia of the Chemical Elements, Reinhold Book Corporation, New York , 1968, chap. « Helium », p. 256–268
- ↑ (en) Ray F. Weiss, « Solubility of helium and neon in water and seawater », dans J. Chem. Eng. Data, vol. 16, no 2, 1971, p. 235–241 [lien DOI]
Première page
- ↑ (en) Jack A. Stone et Alois Stejskal, « Using helium as a standard of refractive », dans Metrologia, vol. 41, 2004, p. 189–197 [lien DOI]
Abstract
- ↑ (en) The Encyclopedia of the Chemical Elements, op. cit., p. 261.
- ↑ (en) F. Buhler et W. I. Axford, H. J. A. Chivers, K. Martin, « Helium isotopes in an aurora », dans J. Geophys. Res., vol. 81, no 1, 1976, p. 111–115 [lien DOI]
Abstract
- ↑ a , b et c (en) The Encyclopedia of the Chemical Elements, op. cit. p. 262
- ↑ (en) P. C. Hohenberg et P. C. Martin, « Microscopic Theory of Superfluid Helium », dans Annals of Physics, vol. 281, no 1–2, octobre 2000, p. 636–705 [lien DOI]
Abstract. Article disponible pour les abonnés de ScienceDirect
- ↑ a et b (en) The Encyclopedia of the Chemical Elements, op. cit., p. 263
- ↑ (en) H. A. Fairbank et C. T. Lane, « Rollin Film Rates in Liquid Helium », dans Physical Review, vol. 76, no 8, octobre 1949, p. 1209–1211 [lien DOI]
Abstract. Article proposé à la vente
- ↑ (en) B. V. Rollin et F. Simon, « On the “film” phenomenon of liquid helium II », dans Physica, vol. 6, no 2, 1939, p. 219–230 [lien DOI]
Abstract. Article disponible pour les abonnés de ScienceDirect
- ↑ (en) Fred M. Ellis, « Third sound », septembre 2005, Wesleyan Quantum Fluids Laboratory. Consulté le 23 juin 2009
- ↑ (en) D. Bergman, « Hydrodynamics and Third Sound in Thin He II Films », dans Physical Review, vol. 188, no 1, octobre 1949, p. 370–384 [lien DOI]
Abstract. Disponible pour les abonnés PROLA, ou à la vente
- ↑ a , b , c , d et e (en) Periodic Table: Helium. Consulté le 23 juin 2009
- ↑ (en) M. J. Ackerman et G. Maitland, « Calculation of the relative speed of sound in a gas mixture », dans Undersea Biomed. Res., vol. 2, no 4, décembre 1975, p. 305–310 [texte intégral (page consultée le 23 juin 2009)]
- ↑ (en) Joe Wolfe, « Physics in speech », phys.unsw.edu.au.. Consulté le 23 juin 2009
- ↑ a et b (en) Martin Grassberger et Astrid Krauskopf, « Suicidal asphyxiation with helium: Report of three cases. Suizid mit Helium Gas: Bericht über drei Fälle. », dans Wiener Klinische Wochenschrift, vol. 119, no 9–10, 2007, p. 323–325 [lien DOI]
Résumé en allemand. Première page disponible. Article proposé à la vente
- ↑ a et b (en) Daniel Engber, « Stay Out of That Balloon ! », 2006, Slate.com. Consulté le 23 juin 2009
- ↑ (en) J. C. Rostain et C. Lemaire, M.C. Gardette-Chauffour, J. Doucet, R. Naquet, « Estimation of human susceptibility to the high-pressure nervous syndrome », dans J. Appl. Physiol., vol. 54, no 4, avril 1983, p. 1063–1070 [texte intégral (page consultée le 23 juin 2009)]
Disponible sur abonnement personnel ou institutionnel
- ↑ (en) W. L. Hunger Jr et P. B. Bennett, « The causes, mechanisms and prevention of the high pressure nervous syndrome », dans Undersea Biomed. Res., vol. 1, no 1, 1974, p. 1–28 (ISSN 0093-5387) [texte intégral (page consultée le 23 juin 2009)]
OCLC id = 2068005 ; PubMed id = 4619860
- ↑ a et b (en) Glenn D. Considine (éd.) Van Nostrand's Encyclopedia of Chemistry , Wylie-Interscience, (ISBN 0-471-61525-0), chap. « Helium », p. 764–765.
- ↑ (en) I. E. Beckwith et C. G. Miller III, « Aerothermodynamics and Transition in High-Speed Wind Tunnels at Nasa Langley », dans Annual Review of Fluid Mechanics, vol. 22, 1990, p. 419–439 [lien DOI (page consultée le 23 juin 2009)]
- ↑ (en) C.I. Morris, Shock Induced Combustion in High Speed Wedge Flows, Stanford University Thesis, 2001, [lire en ligne (page consultée le 23 juin 2009)].
- ↑ (en) James R. Belcher et William V. Slaton, Richard Raspet, Henry E. Bass, Jay Lightfoot, « Working gases in thermoacoustic engines », dans The Journal of the Acoustical Society of America, vol. 105, no 5, 1999, p. 2677–2684 [lien DOI]
Disponible sur abonnement
- ↑ (en) Arjun Makhijani, Kevin Gurney, Mending the Ozone Hole: Science, Technology, and Policy, MIT Press, 1995, (ISBN 0262133083).
- ↑ (en) H. Jakobsson, « Simulations of the dynamics of the Large Earth-based Solar Telescope », dans Astronomical & Astrophysical Transactions, vol. 13, no 1, 1997, p. 35–46 [lien DOI]
Abstract. Article sur abonnement
- ↑ (en) O. Engvold et R.B. Dunn, R. N. Smartt, W. C. Livingston, « Tests of vacuum VS helium in a solar telescope », dans Applied Optics, vol. 22, 1983, p. 10–12 [texte intégral lien DOI (pages consultées le 27 juillet 2008)]
Abstract. Article proposé à la vente
- ↑ (en) CERN - LHC: Facts and Figures – LHC Guide booklet, CERN. Consulté le 23 juin 2009
- ↑ (en) B. Fowler et K.N. Ackles, G. Porlier, « Effects of inert gas narcosis on behavior—a critical review », dans Undersea Biomedical Research Journal, 1985 [texte intégral (page consultée le 23 juin 2009)]
PubMed id = 4082343
- ↑ (en) J. R. Thomas, « Reversal of nitrogen narcosis in rats by helium pressure », dans Undersea Biomed. Res., vol. 3, no 3, 1976, p. 249–259 [texte intégral (page consultée le 23 juin 2009)]
PubMed id = 969027
- ↑ (en) J. C. Rostain et M. C. Gardette-Chauffour, C. Lemaire, R. Naquet, « Effects of a H2-He-O2 mixture on the HPNS up to 450 msw », dans Undersea Biomed. Res., vol. 15, no 4, 1988, p. 257–270 (ISSN 0093-5387) [texte intégral (page consultée le 23 juin 2009)]
OCLC id = 2068005 ; PubMed id = 3212843
- ↑ (en) Scott J. Butcher et Richard L. Jones, Jonathan R. Mayne, Timothy C. Hartley, Stewart R. Petersen, « Impaired exercise ventilatory mechanics with the self-contained breathing apparatus are improved with heliox », dans European Journal of Applied Physiology, Springer, Pays-Bas, vol. 101, no 6, décembre 2007, p. 659–669 [lien DOI (page consultée le 23 juin 2009)]
Première page libre, article restreint aux abonnés de Springer
- ↑ a et b (en) Albert Stwertka, Guide to the Elements: Revised Edition, Oxford University Press, New York, 1998, (ISBN 0-19-512708-0), p. 24.
- ↑ (en) B. M. Oliver et James G. Bradley, Harry Farrar IV, « Helium concentration in the Earth's lower atmosphere », dans Geochimica et Cosmochimica Acta, vol. 48, no 9, 1984, p. 1759–1767 [lien DOI (page consultée le 23 juin 2009)]
Abstract libre, article disponible sur abonnement ScienceDirect
- ↑ (en) The Atmosphere: Introduction dans JetStream - Online School for Weather, 29 août 2007, National Weather Service. Consulté le 23 juin 2009
- ↑ (en) Ø. Lie-Svendsen et M. H. Rees, « Helium escape from the terrestrial atmosphere: The ion outflow mechanism », dans Journal of Geophysical Research, vol. 101, no A2, 1996, p. 2435–2444 [lien DOI (page consultée le 23 juin 2009)]
Abstract, article par abonnement AGU
- ↑ (en) Nick Strobel, « Nick Strobel's Astronomy Notes chap.Atmospheres », 2007. Consulté le 23 juin 2009
- ↑ (en) Melvine A. Cook, « Where is the Earth's Radiogenic Helium? », dans Nature, vol. 179, 1957, p. 213 [lien DOI (page consultée le 23 juin 2009)]
Abstract, article proposé à la vente
- ↑ (en) L. T. Aldrich et Alfred O. Nier, « The Occurrence of He3 in Natural Sources of Helium », dans Phys. Rev., vol. 74, 1948, p. 1590–1594 [lien DOI (page consultée le 23 juin 2009)]
Abstract, article sur abonnement PROLA
- ↑ (en) P. Morrison et J. Pine, « Radiogenic Origin of the Helium Isotopes in Rock », dans Annals of the New York Academy of Sciences, vol. 62, no 3, 1955, p. 71–92 [lien DOI (page consultée le 23 juin 2009)]
Pas d'abstract, remerciements, article sur abonnement à Wiley InterScience
- ↑ (en) R. E. Zartman, « Helium Argon and Carbon in Natural Gases », dans Journal of Geophysical Research, vol. 66, no 1, 1961, p. 277–306 [texte intégral lien DOI (pages consultées le 21 juillet 2008)]
Sur abonnement AGU, ou à la vente
- ↑ (en) Ronald F. Broadhead, « Helium in NewMexico – geology distribution resource demandand exploration possibilities », dans New Mexico Geology, vol. 27, no 4, 2005, p. 93–10 [[pdf] texte intégral (page consultée le 23 juin 2009)]
- ↑ (en) Mark Winter, « Helium: the essentials », 2008, University of Sheffield. Consulté le 23 juin 2009
- ↑ The Encyclopedia of the Chemical Elements, op. cit., p. 258
- ↑ a , b et c (en) E.M. Smith et T.W. Goodwin, J. Schillinger, « Challenges to the worldwide suply of helium in the next decade », dans Advances in Cryogenic Engineering, vol. 49A, no 710, 2003, p. 119–138 [[pdf] texte intégral lien DOI (pages consultées le 23 juin 2009)]
- ↑ (en) Mineral Commodity Summaries – Helium, 2004, U.S. Geological Survey. Consulté le 23 juin 2009
- ↑ (en) V.P. Belyakov et S. G. Durgar'yan, B. A. Mirzoyan, et al., « Membrane technology — A new trend in industrial gas separation », dans Chemical and Petroleum Engineering, vol. 17, no 1, 1981, p. 19–21 [lien DOI (page consultée le 23 juin 2009)]
Première page gratuite, la suite sur abonnement SpringerLink ou payant
- ↑ (en) P. I. Dee et E. T. S. Walton, « A Photographic Investigation of the Transmutation of Lithium and Boron by Protons and of Lithium by Ions of the Heavy Isotope of Hydrogen », dans Proceedings of the Royal Society of London, vol. 141, no 845, 1933, p. 733–742 [lien DOI (page consultée le 23 juin 2009)]
Accès payant ou sur abonnement pour non-membres de la Royal Society
- ↑ (en) R. K. Kochhar, « French astronomers in India during the 17th - 19th centuries », dans Journal of the British Astronomical Association, vol. 101, no 2, 1991, p. 95–100 [texte intégral (page consultée le 23 juin 2009)]
- ↑ (en) The Encyclopedia of the Chemical Elements, op. cit., p. 256
- ↑ (en) W. Thomson,Frankland and Lockyer find the yellow prominences to give a very decided bright line not far from D, but hitherto not identified with any terrestrial flame. It seems to indicate a new substance, which they propose to call Helium., Rep. Brit. Assoc. xcix, 1872
- ↑ a et b The Encyclopedia of the Chemical Elements, op. cit., p. 257
- ↑ (en) William Ramsay, « On a Gas Showing the Spectrum of Helium, the Reputed Cause of D3 , One of the Lines in the Coronal Spectrum. Preliminary Note », dans Proceedings of the Royal Society of London, vol. 58, 1895, p. 65–67 [lien DOI (page consultée le 23 juin 2009)]
Payant, ou sur abonnement pour les non-membres de la Royal Society
- ↑ (en) William Ramsay, « Helium, a Gaseous Constituent of Certain Minerals. Part I », dans Proceedings of the Royal Society of London, vol. 58, 1895, p. 80–89 [lien DOI (page consultée le 23 juin 2009)]
Payant, ou sur abonnement pour les non-membres de la Royal Society
- ↑ (en) William Ramsay, « Helium, a Gaseous Constituent of Certain Minerals. Part II », dans Proceedings of the Royal Society of London, vol. 59, 1895, p. 325–330 [lien DOI (page consultée le 23 juin 2009)]
Payant, ou sur abonnement pour les non-membres de la Royal Society
- ↑ (de) N. A. Langlet, « Das Atomgewicht des Heliums », dans Zeitschrift für anorganische Chemie, vol. 10, no 1, 1895, p. 289–292 [lien DOI (page consultée le 23 juin 2009)]
À la vente ou sur abonnement à Wiley InterScience
- ↑ (en) E.R. Weaver, Industrial & Engineering Chemistry, 1919, chap. « Bibliography of Helium Literature ».
- ↑ (en) Pat Munday, American National Biography, John A. Garraty et Mark C. Carnes (éd.), Oxford University Press, 1999, « Biographical entry for W.F. Hillebrand (1853–1925), geochemist and US Bureau of Standards administrator », vol. 10-11, p. 227–228
- ↑ (en) Dirk van Delft, « Une petite tasse d'hélium, une grande science », dans Physics today, 2008, p. 36–42 [[pdf] texte intégral (page consultée le 23 juin 2009)]
- ↑ (en) Coldest Cold, 1929, Time Inc.. Consulté le 23 juin 2009
- ↑ (en) P. Kapitza, « Viscosity of Liquid Helium below the λ-Point », dans Nature, vol. 141, 1938, p. 74 [lien DOI (page consultée le 23 juin 2009)]
- ↑ (en) D. D. Osheroff et R. C. Richardson, D. M. Lee, « Evidence for a New Phase of Solid He3 », dans Phys. Rev. Lett., vol. 28, no 14, 1972, p. 885–888 [lien DOI (page consultée le 23 juin 2009)]
Abstract. Article sous copyright PROLA
- ↑ (en) D. F. McFarland, « Composition of Gas from a Well at Dexter, Kan », dans Transactions of the Kansas Academy of Science, vol. 19, 1903, p. 60–62 [texte intégral lien DOI (pages consultées le 23 juin 2009)]
Première page. Article complet aux conditions JSTOR
- ↑ (en) The Discovery of Helium in Natural Gas, 2004, American Chemical Society. Consulté le 23 juin 2009
- ↑ (en) H.P. Cady et D. F. McFarland, « Helium in Natural Gas », dans Science, vol. 24, 1906, p. 344 [lien DOI (page consultée le 23 juin 2009)]
Pas d'abstract. Article en vente, ou membres de l'AAAS
- ↑ (en) H.P. Cady et D. F. McFarland, « Helium in Kansas Natural Gas », dans Transactions of the Kansas Academy of Science, vol. 20, 1906, p. 80–81 [texte intégral lien DOI (pages consultées le 23 juin 2009)]
<Pas d'abstract. Article aux conditions JSTOR
- ↑ (en) Eugene M. Emme(éd.), Aeronautics and Astronautics : An American Chronology of Science and Technology in the Exploration of Space, 1915–1960, NASA, Washington, D.C. , 1961, (ISBN NuméroISBN), DOI:#doi, [lire en ligne (page consultée le 23 juin 2009)], chap. « Aeronautics and Astronautics Chronology, 1920–1924 », p.11–19.
- ↑ (en) N. Hilleret, S. Turner (éd.) CERN Accelerator School, vacuum technology: proceedings: Scanticon Conference Centre, Snekersten, Denmark, 28 May – 3 June 1999, CERN, Genève, Suisse , 1999, [lire en ligne (page consultée le 23 juin 2009)], chap. « Leak Detection », p. 203–212. « Le début de la méthode de détection de fuite à l'hélium doit être rapportée au projet Manhattan, et aux exigences sans précédent d'étanchéité des usines de séparation de l'uranium. La sensibilité exigée pour la vérification de l'étanchéité a conduit au choix du spectomètre de masse conçu par le Dr. A.O.C. Nier, et calé sur la masse de l'hélium »
- ↑ (en) John G. Williamson, « Energy for Kansas », dans Transactions of the Kansas Academy of Science, Kansas Academy of Science, vol. 71, no 4, Hiver 1968, p. 432–438 [texte intégral (page consultée le 23 juin 2009)]
Première page. Article complet aux conditions JSTOR
- ↑ (en) —, « Conservation Helium Sale », dans Federal Register, vol. 70, no 193, 06 octobre 2005, p. 58464 [[pdf] texte intégral (page consultée le 23 juin 2009)]
- ↑ (en) Executive Summary : The Impact of Selling the Federal Helium Reserve (ISBN 978-0-309-07038-6),, nap.edu. Consulté le 23 juin 2009
- ↑ (en)P.V. Mullins,R. M. Goodling Helium, Bureau of Mines / Minerals yearbook 1949, 1951, [lire en ligne (page consultée le 21 juin 2009)], p. 599–602
- ↑ (en) G.R. Matos, J.B. Peterson, « Helium End User Statistic », U.S. Geological Survey. Consulté le 23 juin 2009
- ↑ (en) Karen H. Kaplan, « Helium shortage hampers research and industry », dans Physics Today, American Institute of Physics, vol. 60, no 6, juin 2007, p. 31–32 [texte intégral lien DOI (pages consultées le 23 juin 2009)]
- ↑ (en) Sourish Basu et Philip Yam (éd.), « Updates: Into Thin Air », dans Scientific American, Scientific American, Inc., vol. 297, no 4, octobre 2007, p. 18 [texte intégral (page consultée le 23 juin 2009)]
- (en) Cet article est partiellement ou en totalité issu d’une traduction de l’article de Wikipédia en anglais intitulé « Helium ».
Voir aussi
Articles connexes
- Superfluide
- Cryogénie
- Chimie des gaz nobles
- Caléfaction ou Effet Leidenfrost
- Détection de fuite
- Atome
- Atome à N électrons
Liens et documents externes
- La découverte de l'hélium liquide en 1908 par Kamerlingh, BibNum. Consulté le 21 juin 2009, texte commenté.
s1 s2 g f1 f2 f3 f4 f5 f6 f7 f8 f9 f10 f11 f12 f13 f14 d1 d2 d3 d4 d5 d6 d7 d8 d9 d10 p1 p2 p3 p4 p5 p6 1 H He 2 Li Be B C N O F Ne 3 Na Mg Al Si P S Cl Ar 4 K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Kr 5 Rb Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te I Xe 6 Cs Ba La Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po At Rn 7 Fr Ra Ac Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Lr Rf Db Sg Bh Hs Mt Ds Rg Cn Uut Uuq Uup Uuh Uus Uuo 8 Uue Ubn * Ute Uqn Uqu Uqb Uqt Uqq Uqp Uqh Uqs Uqo Uqe Upn Upu Upb Upt Upq Upp Uph Ups Upo Upe Uhn Uhu Uhb Uht Uhq Uhp Uhh Uhs Uho ↓ g1 g2 g3 g4 g5 g6 g7 g8 g9 g10 g11 g12 g13 g14 g15 g16 g17 g18 * Ubu Ubb Ubt Ubq Ubp Ubh Ubs Ubo Ube Utn Utu Utb Utt Utq Utp Uth Uts Uto
Métalloïdes Non-métaux Halogènes Gaz rares Métaux alcalins Métaux alcalino-terreux Métaux de transition Métaux pauvres Lanthanides Actinides Superactinides Éléments non classés - Portail de la chimie
- Portail de la physique
- Portail des technologies
Catégories : Élément chimique | Gaz noble | Théorie de la plongée
Obtention de l'helium
Wikimedia Foundation. 2010.