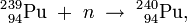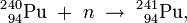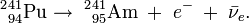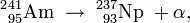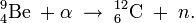- Americium
-
Américium
L’américium est un élément chimique transuranien de symbole Am et de numéro atomique 95.
Sommaire
Caractéristiques notables
L’américium est un élément radioactif de la famille des actinides. Sous forme métallique, il a une couleur blanche et un lustre argenté (plus argenté que le plutonium ou le neptunium). À température ambiante, il se ternit lentement dans l’air sec.
Du fait de son instabilité, l’américium n’est pas présent dans la croûte terrestre. C’est un élément artificiel produit lors de réactions successives intervenant dans le cœur des réacteurs nucléaires, et il est actuellement considéré comme un déchet radioactif.
Historique
L’américium a été nommé en référence au continent américain, par analogie avec l’europium, élément de la famille des lanthanides dont il est l’homologue chimique. Tout comme les autres éléments plus lourds que l’uranium, il a été découvert relativement récemment. Le développement de la physique nucléaire expérimentale dans les années 1940 a permis de le créer artificiellement.
Il fut synthétisé pour la première fois par Glenn T. Seaborg, Leon Morgan, Ralph James, et Albert Ghiorso vers la fin de l’année 1944 au laboratoire métallurgique de l’université de Chicago (connu maintenant sous le nom d’Argonne National Laboratory). Cette équipe forma l’isotope d’américium 241 en soumettant du plutonium 239 à plusieurs réactions successives de capture de neutrons dans un réacteur nucléaire. On crée alors du 240Pu puis du 241Pu (demi-vie, 14,2 ans) qui se transforme en 241Am par émission bêta selon la chaine de réaction suivante (identique à celle prenant place dans les réacteurs nucléaires actuels) :
Suite à la mise en place dans les années 1970 de parcs de réacteurs nucléaires destinés à la fabrication d’électricité ; des quantités non négligeables d’américium ont été, et sont toujours produites dans plusieurs pays (en France : environ 1 tonne par an, mélangé aux autres actinides et aux produits de fissions). Ceci a eu pour conséquence un déploiement important de recherches concernant les propriétés physicochimiques de l’américium et de ses composés.
L’américium fait encore actuellement l’objet de recherches dans différents domaines liés à l’industrie nucléaire :
- Caractérisation de sa stabilité dans les différentes matrices envisagées pour son stockage de longue durée, études dans l’objectif de pouvoir le séparer des autres déchets radioactifs (amélioration du procédé PUREX).
- Études en vue de son utilisation dans des réacteurs nucléaires incinérateurs destinés à la transmutation.
Isotopes
Articles principaux : américium 241 et américium 242m.Parmi les dix-huit isotopes connus de l’américium (231Am à 247Am), seuls trois ont une période radioactive supérieure à un an[1]. Ces isotopes les plus stables sont 243Am (demi-vie 7370 ans), 241Am (demi-vie 432 ans) et 242mAm (demi-vie 141 ans).
L’américium 241 et l’américium 243 émettent majoritairement des rayonnements alpha – ils se décomposent respectivement en neptunium 237 et neptunium 239 –, tandis que l’américium 242m subit essentiellement une transition isomérique vers son état stable, l’américium 242 dont la demi-vie est de 16 heures.
Ce dernier se désintègre par radiation bêta à 83 % en donnant du curium 242 ou par capture électronique à 17 %, donnant du plutonium 242[2].
L’américium 241, qui fait partie de la chaîne de désintégration du plutonium 241, est le plus fréquent du fait de son apparition en équilibre avec le plutonium produit dans les centrales nucléaires. Il décroît par désintégration alpha (demi-vie 432 ans) en neptunium 237, lui-même un émetteur alpha et gamma avec une période de 2 millions d’années.
Les isotopes 241Am, 242mAm et 243Am sont en outre fissiles[3]. L’américium 241 aurait une masse critique (sphère nue) comprise entre 60 et 100 kg. L’américium 242m a une masse critique très faible (entre 9 et 18 kg), ce qui fait envisager son utilisation comme combustible spatial. La masse critique de l’américium 243 varie s ivant les estimations, entre 50 et 150 kg.
Propriétés chimiques
L’américium est un métal dont l’état solide présente trois formes cristallographiques, notées α (jusqu’à 1042 K ; 729 °C), β (entre 1042 et 1350 K ; 729 °C et 1 077 °C), et γ (entre 1350 et 1449 K ; 1 077 °C et 1 176 °C). Il devient liquide à 1449 K (1 176 °C) et gazeux à 2284 K (2 011 °C).
Il existe de nombreux composés chimiques de l’américium :
- oxyde : AmO2 et Am2O3,
- halogénure : AmF3, AmF4, AmCl3, AmBr3 et AmI3,
- sulfure : AmS,
- hydrure : AmH2,
- carbure : Am2C3.
En milieu aqueux, l’américium est essentiellement à l’état d’oxydation +3. Le cation Am3+ est susceptible de se complexer avec différents ligands (CO32-, OH-, NO2-, NO3- et SO4-2) :
- hydroxyde : Am(OH)2+, Am(OH)2+, Am(OH)3,
- carbonate : AmCO3+, Am(CO3)2-, Am(CO3)33-,
- sulfate : AmSO4+, Am(SO4)2-,
- nitrate : AmNO32+.
Il existe également en milieu aqueux des complexes de l’ion américyle AmO2+ :
- AmO2CO3-, AmO2(CO3)23- et AmO2(CO3)35-.
Applications
La forte radiotoxicité de l’américium le rend peu compatible avec une utilisation en quantité importante, et il est uniquement utilisé pour des applications liées à son rayonnement ionisant. Il est conservé dans des sources scellées et conditionnées dans une double enveloppe cylindrique en acier inoxydable.
Les applications concernent surtout l’isotope 241Am, dont l’élaboration sous forme pure est la plus aisée.
L’américium a ainsi trouvé une application domestique :
- la plupart des modèles de détecteurs de fumée contiennent une petite quantité de 241Am, sous forme d’oxyde AmO2 dont les émissions alpha alimentent une chambre d’ionisation.
- Ce même isotope est également utilisé comme source de rayons gamma dans le domaine de la cristallographie.
- Enfin, mélangé au béryllium ou au bore, il constitue une source de neutrons indirects avec des applications dans la radiographie.
Dans la source 241Am-Be, les neutrons sont ainsi produits selon deux réactions successives :
L’américium 242 a aussi été utilisé dans la radiographie, mais son coût de production est très élevé.
Aspects sanitaires et environnementaux
L’américium 241 mesuré dans l’environnement provient soit d’un rejet direct, soit indirectement de la décroissance de l’isotope 241Pu.
On distingue 3 causes majeures de rejets[4]:
- Les essais nucléaires atmosphériques (estimées à 80 % du total).
- Les rejets des installations nucléaires lors du traitement du combustible.
- Et les rejets dus à des accidents (principalement l’explosion de la centrale de Tchernobyl en 1986).
Après dissémination dans l’environnement, l’américium peut être incorporé dans tous les constituants de la chaine alimentaire et présenter diverses formes chimiques plus ou moins solubles. L’américium est un composé moyennement transférable, qui se dépose principalement dans le squelette, le foie et les gonades, quelle que soit l’espèce considérée[5]. À ce titre, il a un comportement proche de ceux des autres éléments transuraniens. Il se distingue toutefois du plutonium par un temps de rétention dans les organes moins important et une toxicité moins prononcée. La CIPR retient une période biologique de 20 ans.
Références
- ↑ These fact sheets
- ↑ Universal Nuclide Chart and Radioactive Decay Applet, Institut des Transuraniens, http://www.nuclides.net/applets/radioactive_decay.htm
- ↑ Données des masses critiques d’après Challenges of Fissile Material Control, David Albright and Kevin O’Neill, ISIS 1999 (chap. 5).
- ↑ Fiche radionucléide : Américium 241 et environnement, IRSN, http://net-science.irsn.org/net-science/liblocal/docs/docs_DEI/fiches_RN/Americium_Am241_v1.pdf
- ↑ Fiche radionucléide : Américium 241 - aspects sanitaires, IRSN, http://net-science.irsn.org/net-science/liblocal/docs/docs_DPHD/fiches_RN_DPHD/Am241SAN.pdf
s1 s2 g f1 f2 f3 f4 f5 f6 f7 f8 f9 f10 f11 f12 f13 f14 d1 d2 d3 d4 d5 d6 d7 d8 d9 d10 p1 p2 p3 p4 p5 p6 1 H He 2 Li Be B C N O F Ne 3 Na Mg Al Si P S Cl Ar 4 K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Kr 5 Rb Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te I Xe 6 Cs Ba La Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po At Rn 7 Fr Ra Ac Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Lr Rf Db Sg Bh Hs Mt Ds Rg Cn Uut Uuq Uup Uuh Uus Uuo 8 Uue Ubn * Ute Uqn Uqu Uqb Uqt Uqq Uqp Uqh Uqs Uqo Uqe Upn Upu Upb Upt Upq Upp Uph Ups Upo Upe Uhn Uhu Uhb Uht Uhq Uhp Uhh Uhs Uho ↓ g1 g2 g3 g4 g5 g6 g7 g8 g9 g10 g11 g12 g13 g14 g15 g16 g17 g18 * Ubu Ubb Ubt Ubq Ubp Ubh Ubs Ubo Ube Utn Utu Utb Utt Utq Utp Uth Uts Uto Métalloïdes Non-métaux Halogènes Gaz rares Métaux alcalins Métaux alcalino-terreux Métaux de transition Métaux pauvres Lanthanides Actinides Superactinides Éléments non classés - Portail de la chimie
Catégories : Élément chimique | Actinide
Wikimedia Foundation. 2010.