- Tritium
-
 Pour les articles homonymes, voir Tritium Calcio 1908 .
Pour les articles homonymes, voir Tritium Calcio 1908 .Tritium (Hydrogène 3) 
Général Nom, Symbole tritium, triton, 3H Neutrons 2 Protons 1 Données Physiques Présence naturelle trace Demi-vie 12,32 ans ± 0,02 ans Produit de désintégration hélium 3 Masse atomique 3,016049200 uma u Spin 1/2+ Excès d'énergie 14 949,794 ± 0,001 keV Énergie de liaison 8 481,821 ± 0,004 keV Désintégration Énergie (MeV) Désintégration bêta 0,018590 Le tritium (T ou 3H) est - comme le deutérium - l'un des isotopes de l'hydrogène. Il possède 1 proton et 2 neutrons. Il a été mis en évidence en 1934, par Ernest Rutherford, dans la réaction nucléaire D+D→T+H.
À la différence du deutérium et de l'hydrogène 1, ce nucléide est radioactif. Il émet un rayonnement bêta (β-) (de faible énergie) en se transformant en hélium 3 (3He).
Sa période ou demi-vie est de 12,32 ans.
Son activité spécifique (ou activité massique) est de 3,59×1014 Bq/g (soit 359 TBq/g ou 359 PBq/kg) ou 9703 curies par gramme (soit 9,7 MCi/kg).
Sommaire
Propriétés
 Tubes radioluminescents : des tubes de verre dont la face interne est recouverte de phosphore et contenant du tritium gazeux brillent dans le noir (le tube ici photographié brillait depuis un an et demi). Le rayonnement bêta, de faible énergie (dit « mou »), est arrêté par le plastique ou le verre.
Tubes radioluminescents : des tubes de verre dont la face interne est recouverte de phosphore et contenant du tritium gazeux brillent dans le noir (le tube ici photographié brillait depuis un an et demi). Le rayonnement bêta, de faible énergie (dit « mou »), est arrêté par le plastique ou le verre.
Propriétés physiques
Un atome de tritium a une masse atomique de 3,0160492. Le tritium existe comme corps pur sous la forme de T2 gazeux dans les conditions normales de température et de pression.
La légère différence massique d'une même molécule selon qu'elle contienne des atomes d'hydrogène ou de tritium explique des différences de comportements, en particulier concernant l' eau tritiée lors des processus naturels de changement de phase (évaporation, condensation, cristallisation, etc.) source d'un faible enrichissement en tritium de la phase condensée par rapport à l’hydrogène (plus léger).Comme l'hydrogène, le tritium gazeux est difficile à stocker à température ambiante. De nombreux matériaux apparemment étanches sont poreux pour le tritium (car c'est une molécule très petite).
Propriétés chimiques
En s'oxydant en présence d'oxygène, même en milieu sec il produit de l'eau tritiée (HTO ou T2O), s'il y a une source de chaleur ou une étincelle.
Radioactivité
La demi-vie du tritium est de 12,32 ans[1].
Il se transforme en hélium 3 par la réaction :
 .
.
La réaction dégage une énergie maximale (Emax) de 18,6 keV et moyenne (Emoy) de 5,7 keV ; l'électron emportant en moyenne une énergie cinétique de 5,7 keV, le reste étant emporté par un antineutrino électronique (pratiquement indétectable). Son énergie particulièrement faible le rend difficile à détecter autrement que par scintigraphie.
La radioactivité β de faible énergie fait que les électrons émis sont rapidement arrêtés dans l'eau et dans les tissus biologiques, après avoir parcouru seulement 6 μm tout au plus (et en moyenne environ 0,56 μm)[2]. Un rayonnement externe est donc rapidement arrêté par la simple surface « morte » de la peau humaine.
Cependant, contrairement à leur rayonnement, la plupart des molécules tritiées comme par exemple l'eau tritiée sont facilement absorbées à travers la peau, des membranes ou tissus biologiques de tous les êtres vivants. Sa radioactivité ne le rend donc potentiellement dangereux que s'il est inhalé ou ingéré, et a priori uniquement dans les cellules vivantes qu'il aura pénétré.
Production
Réactions de production
Le tritium est naturellement issu de l'interaction entre le rayonnement cosmique et l'atmosphère. La réaction dominante est l'interaction entre un neutron rapide (de plus de 4 MeV) et un atome d'azote[3], par réaction (n,T) :
 .
.
Le tritium peut être abondamment produit par l'Homme en bombardant du lithium par un flux neutronique. C'est le cas dans le réacteur d'une centrale nucléaire. L'isotope léger (6Li), présent dans le lithium naturel à raison de 7,5 %, capture les neutrons et donne des noyaux d'hélium et de tritium suivant la réaction :
 .
.
Le lithium 7 exposé à des neutrons de haute énergie peut également subir une réaction (n, alpha) endothermique (réaction découverte lors de l'essai Castle Bravo ; explosion d'énergie 2,5 fois supérieure aux prévisions à cause de l'excès de tritium produit de cette manière).
 .
.
Dans un réacteur à eau pressurisée, de l'acide borique est utilisé comme « poison » consommable. Le bore 10 peut parfois occasionnellement[4] subir une fission ternaire (n, T, 2α), conduisant à deux atomes d'hélium et un de tritium[5] :
 .
.
Les réacteurs à eau lourde génèrent du tritium par capture d'un neutron par un atome de deutérium. Cette réaction n'a qu'une très faible section efficace (c'est pourquoi l'eau lourde est un bon modérateur) et ne produit que peu de tritium. La même réaction se produit sur la faible proportion de deutérium (0,015 %) dans les réacteurs où l'eau est utilisée comme caloriporteur[6].
 .
.
En milieu nucléaire, l'hélium 3 produit par la désintégration du tritium est lui-même réactivé en tritium par capture neutronique, facilité par sa grande section de capture :
 .
.
Le tritium est également produit dans les réacteurs nucléaires comme produit de fission, avec un rendement de l'ordre de 0,01 % (production d'un atome de tritium pour dix mille fissions). Un réacteur commercial produit ainsi chaque année 2 grammes de tritium[7].
Production industrielle
 La principale source civile de tritium dans le monde sont les réacteurs CANDU, modérés à l'eau lourde.
La principale source civile de tritium dans le monde sont les réacteurs CANDU, modérés à l'eau lourde.
La principale source civile de tritium dans le monde sont les réacteur CANDU, modérés à l'eau lourde, où il constitue un produit d'activation. Dans certains réacteurs, le tritium est périodiquement extrait du modérateur, et peut être disponible pour une utilisation industrielle.
Le tritium est extrait d'eau lourde au « Tritium Removal Facility » (TRF) en deux étapes : extraction catalytique en phase vapeur, puis distillation cryogénique. Le TRF produit annuellement 2,5 kg de tritium[8].
Le tritium à usages militaires est produit en réacteurs d'irradiations, par irradiation de lithium. C'est la méthode choisie par l'autre grand fournisseur de tritium civil, Reviss Services et envisagée pour le fonctionnement continu d'ITER.
C'est la source envisagée pour le démarrage d'ITER : la fusion thermonucléaire destinée à produire de l'énergie devrait bientôt utiliser le lithium dans une zone périphérique dite de couverture, enveloppant le cœur du réacteur, pour intercepter un maximum de neutrons produits par les réactions de fusion. Le tritium ainsi produit servirait à remplacer le tritium consommé par la réaction, ce qui limiterait le transport de matières radioactives.
Usages
Pour la fusion nucléaire
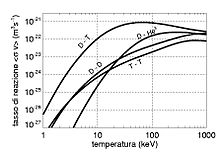
Le tritium est un élément clef de la fusion nucléaire, par la grande section efficace et l'énergie dégagée par sa réaction avec le deutérium :
 .
.
Tous les noyaux composés de neutrons et de protons sont chargés positivement, et se repoussent du fait de la force électrostatique qui en résulte. Cependant, quand la température et la pression sont suffisamment élevées, ils peuvent se rapprocher au point que l'interaction forte prenne le dessus et provoque la fusion en un atome plus gros.
Le noyau de tritium, formé d'un proton et de deux neutrons, a la même charge que les atomes d'hydrogène, et subit la même répulsion électrostatique. Mais les neutrons augmentent l'effet de l'interaction forte, permettant une fusion plus facile qu'entre atomes d'hydrogène.
Usage militaire
Les bombes nucléaires à fusion nucléaire sont de type tritium-tritium ou tritium-deutérium. La réaction est déclenchée par les température et pression extrêmes d'une réaction explosive de fission nucléaire d'uranium 235 ou de plutonium 239. Les neutrons dégagés par la fusion du tritium favorisent à leur tour la fission de l'uranium ou du plutonium résiduels.
Aucune publication officielle ne le dit, mais on estime que les têtes nucléaires contiennent environ 4 grammes de tritium, et qu'une bombe à neutrons en contient de 10 à 30 grammes[9].
Le tritium est une matière nucléaire dont la détention est réglementée en France (Article R1333-1 du code de la défense). Mais au plan international, il n'est pas considéré comme un « produit fissile » dans le TNP et ne fait pas l'objet de contrôles pour l'AIEA.
Article détaillé : Contrôle des matières nucléaires.Usages non-nucléaires
Les usages non-nucléaires n'impliquent que des traces de tritium, et ne concernent qu'une fraction très faible des quantités produites.
Le tritium gazeux est utilisé pour sa capacité à faire briller dans le noir le phosphore, avec bien moins de risque (norme ISO 3157:1991) qu'avec le radium (interdit pour la luminescence des montres et réveils en raison de sa dangerosité, notamment pour les travailleurs). Des tubes transparents emplis de gaz rendent lumineux des points (montres, chronomètres, systèmes de visée d'armes de chasse, guerre, ou tir sportif) ou des panneaux de sécurité (de type "sortie de secours" qui n'ont alors plus besoin de piles ou circuit d'alimentation, mais la plupart de ces objets peuvent perdre leur tritium en cas d'incendie).
Bien que cela soit interdit ou sévèrement réglementé dans certains pays (comme aux USA avec la nécessité d'une autorisation de l'US EPA), des capsules de tritium gazeux sont utilisées dans certaines montres ou gadgets (dits « trasers »), qui font l'objet d'un commerce illégal et éventuellement dangereux.
En France, cette pratique est soumise à autorisation de vente par le code de la santé publique[10] ; le décret 2002-450 du 4 avril 2002 dispose ainsi qu’est « interdite toute addition intentionnelle de radionucléides artificiels et naturels, y compris lorsqu’ils sont obtenus par activation, dans les biens de consommation et les produits de construction. (...) Sont également interdites l’importation et l’exportation, s’il y a lieu sous tout régime douanier, ainsi que le placement en magasin et aire de dépôt temporaire de tels biens et produits qui auraient subi cette addition ». (cf. article R. 43-2 du code de la santé publique).
Le tritium est également utilisé dans le fonctionnement des piles bêta-voltaïques que l'on peut déjà trouver dans certains satellites[réf. nécessaire]. Elle ne sont pas utilisées pour le grand public, mais les chercheurs tentent de les miniaturiser pour les utiliser dans les ordinateurs portables et les téléphones. Ce type de piles présente l'avantage de fournir en continu du courant pendant environ 30 ans, que l'on s'en serve ou non, et ce sans échauffement de la pile.
Tritium dans l'environnement
Dans le monde avec l’Agence internationale pour l’énergie atomique[11] ,[12] ,[13] ,[14], les scientifiques cherchent à mieux comprendre la cinétique environnementale du tritium.
On s'est intéressé au tritium dans l'environnement à partir des années 1950[15], après sa très large diffusion par les premières explosions nucléaires et par les essais nucléaires dans l'atmosphère.
Le tritium « naturel »
Il est produit (essentiellement dans la haute atmosphère) par spallation des atomes d’azote 14 (ainsi que d'oxygène et d'argon) par les rayons cosmiques.
Sa demi-vie courte (par rapport aux temps géologiques) fait que le tritium est en « quasi-équilibre » entre la production et la désintégration. Il ne peut pas s'accumuler dans l'atmosphère de manière significative.
En termes d'activité, l’UNSCEAR estime l’inventaire global du tritium naturel à environ 1,3×1018 Bq (soit 3,6 kg)[16].
- La production naturelle annuelle de tritium serait de 150 à 200 g, soit 5,01×1016 à 7,4×1016 Bq/an. (3 x1018 Bq, ou de 50.1015 et 70.1015 Bq selon le CEA[16])
- Une production tellurique (souterraine) existe, mal quantifiée mais qui semble très faible face à la production aérienne.
Le tritium anthropique
Il est émis dans l'air, l'eau et les sols par l'Homme depuis les années 1940, à des doses dépassant de loin les taux naturels, via deux sources principales : les installations nucléaires et les explosions nucléaires.
- Les essais thermonucléaires : de 1945 à 1963, les essais nucléaires des bombes A ou H ont rejeté dans l'atmosphère environ 650 kg de tritium[16]. Dans les années 1995, il devait en rester 65 kg[16]. En 2000, environ 90 % du rayonnement émis par ces essais avait disparu du fait de la décroissance radioactive selon l'IRSN[17].
- La production d'armes thermonucléaires émet aussi du tritium. Par exemple, en France, le seul centre de Valduc du CEA, a ainsi déclaré pour la seule année 1999 267 TBq d'activité (un peu moins d'un gramme, soit l'équivalent du rejet d'une trentaine de réacteurs de centrales nucléaires) pour ses rejets gazeux ; sous forme HTO (eau tritiée) pour environ 70 % et sous forme HT (dihydrogène tritié) pour 30 %[18].
- Les installations nucléaires : le rejet de tritium varie selon la puissance du réacteur, son combustible, et de son taux de burn-up (taux de « combustion»)[19]. Les réacteurs à eau sous pression en produisent par activation des éléments légers (Bore et Lithium) du circuit primaire. C'est aussi un produit de fission de la réaction elle-même (0,01 % des fissions). Un réacteur de 900 MWe rejette environ 10 TBq/an (soit 0,03 g/an). Les taux de production par fission sont similaires pour tous les types de réacteurs à neutrons thermiques et sont de l’ordre de 520 TBq.GWe-1.an-1 ; le taux de production dans les réacteurs à neutrons rapides est par contre un peu plus important, de l’ordre de 740 TBq.GWe-1.an-1, compte tenu des rendements de fission ternaire différents pour les isotopes de l’U et du Pu en spectre de neutrons rapides[20].
Réacteurs, usines de retraitement et production d'armes avaient de 1950 à 1997 déjà dispersé environ 297 PBq de tritium, auxquels il faut ajouter 2,8 PBq de carbone 14, selon l'évaluation faite par l'UNSCEAR en 2000[21]. Les installations nucléaires en produisaient 0,005 mSv/an selon l’UNSCEAR en 2000. Selon le CEA, de 1995 à 1997, les réacteurs à eau légère en ont rejeté chacun en moyenne 2,4.1012 Bq sous forme gazeuse et 1,9.1013 Bq sous forme d’eau tritiée par an (UNSCEAR 2000). La Hague en France produirait environ 10 x1015 Bq de tritium/an (pour 1 600 t de déchets retraités)[19]).
Rejets
 Usine de retraitement de la Hague - Les hautes cheminées permettent une meilleure dispersion du tritium dans l'atmosphère.
Usine de retraitement de la Hague - Les hautes cheminées permettent une meilleure dispersion du tritium dans l'atmosphère.
Le tritium est, avec le carbone 14, l'un des deux radionucléides les plus émis dans l’environnement par les installations nucléaires en fonctionnement normal. Selon l'Autorité de sûreté nucléaire, en France, bien que les « activités » des rejets d'autres radionucléides aient fortement diminué (d’un facteur 100 voire plus) des années 1985 aux années 2005, « les activités en tritium et en carbone 14 restent globalement constantes, voire augmentent pour certaines installations »[22]. Cela étant, « l’impact global de ses rejets, en France, est faible ; la dose efficace annuelle pour les groupes de référence est inférieure au ou de l’ordre du μSv. »[23]
Les réacteurs nucléaires et l'industrie nucléaire produisent du tritium :
- lors de réactions de fission ;
- par activation du circuit primaire (poison consommable au bore pour les PWR, eau lourde des réacteurs CANDU) ;
- par « dégazage » à partir du combustible « usé », notamment lors du retraitement des déchets nucléaires (principale source).
Sans valorisation économique envisageable, ce déchet radioactif réputé peu dangereux était en grande partie libéré dans l'air et l'eau. Futur combustible des projets de réacteurs ITER, il pourrait acquérir une valeur économique. Mais on ne connaît pas aujourd'hui de moyen raisonnablement coûteux, de filtrer, isoler ou stocker correctement le tritium. Cet atome étant actif et parmi les plus petits (sous forme gazeuse), il se diffuse par les porosités les plus fines, passant par exemple au travers du caoutchouc et se diffusant dans la plupart des types d'aciers. Il peut s'évaporer, se diluer dans de l'eau et pénétrer le béton s'il n'est pas protégé par une couche spéciale.
Arguant de sa faible radiotoxicité et de sa dilution isotopique aisée dans l'eau, les gros producteurs de tritium ont demandé (et obtenu) des normes leur permettant de disperser et de diluer le tritium dans l'environnement.
- Les usines de production de plutonium de la Hague ou de Sellafield ont des limites de rejets leur permettant de rejeter en mer ou dans l'air la quasi totalité du tritium qu'elles produisent ou doivent gérer.
- Les usines de retraitement de la Hague peuvent rejeter en mer 1 400 fois plus de tritium que ce qui est autorisé pour le réacteur de la centrale nucléaire de Gravelines, également situé en bord de la mer et à proximité de grandes zones de pêche, mais dans une zone plus urbanisée et avec des courants moins forts.
- L'usine de retraitement de la Hague a depuis 2007 une autorisation de rejet de 18 500 TBq (térabecquerels) par an sous forme liquide, et de 150 TBq par an sous forme gazeuse. Elle a par exemple rejeté, en 1997, environ 12 000 térabecquerels sous forme de rejets liquides (11 900 TBq de tritium et 1,8 TBq d’iode 129) et 300 000 TBq sous forme gazeuse (hors tritium, principalement du krypton 85)[24].
L'usine de la Hague a déclaré en 1999, 80 TBq (soit 0,22 g de tritium) et les rejets liquides à 13 000 TBq (soit 36 g). Pour l'année 2002, elle en a rejeté respectivement 11 900 TBq et 63,2 TBq (source Areva NC).
En 1997, les rejets gazeux de tritium de l'usine de Sellafield (GB) ont été de 170 TBq et les rejets liquides de 26 000 TBq (BNFL, 1997).
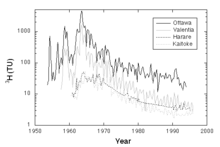
Marquage de l'environnement et pollutions au tritium
L’IRSN étudie l’activité du tritium dans l’air et l’eau de pluie sur le territoire français. Les niveaux habituellement observés dans l’environnement naturel, à l’écart de toute source d’émission de tritium, sont de 0,01 à 0,05 Bq/m³ dans l’air et de 1 à 4 Bq/L dans l'eau de pluie.
Dans l’environnement proche de sites nucléaires autorisés à rejeter du tritium dans l’atmosphère, les niveaux rencontrés se situent entre 0,5 et quelques Bq/m³ dans l'air, et de quelques Bq/L à quelques dizaines de Bq/L dans l'eau ; ponctuellement jusqu’à quelques centaines de Bq/L autour de certains sites[25].
Le tritium dans les végétaux varie de quelques dizaines à quelques centaines de Bq/kg frais[25].Même dans le cas d'une exposition permanente, il n'est pas possible de parler de pollution pour ces valeurs, qui restent très inférieures aux limites intéressant la santé publique : à la valeur guide de 10 000 Bq/L recommandée par l'OMS pour le tritium dans l’eau de boisson en cas de consommation permanente de l’eau (730 L/an pour un adulte) ; et à la limite indicative de 10 000 Bq/kg pour le tritium lié à la matière organique dans les denrées alimentaires fixée par le Codex Alimentarius (2006)[25], provoquée par une teneur moyenne de l'ordre de 100 Bq/m³ dans l'air[26].
Tritium dans l'eau potable
Article détaillé : Eau tritiée.L’eau tritiée est la forme majoritaire de transfert du tritium dans l’environnement et d’exposition humaine. C’est pourquoi des traces de tritium sont recherchées dans l’eau potable. En France, le tritium est suivi comme indicateur de radioactivité : si la concentration en tritium dépasse le niveau de référence de 100 Bq/l, il est procédé à la recherche de la présence éventuelle de radionucléides artificiels. Ce niveau n'est donc qu'une « référence de qualité » : le dépassement de cette valeur ne signifie pas que l’eau est non potable[27].
Les recommandations de l’OMS sur les critères de potabilité de l’eau de boisson sont que la dose reçue du fait de la présence d’un radionucléide dans l’eau de boisson ne dépasse pas 0,1 mSv/an. Cette dose pourrait être atteinte chez l’adulte par la consommation quotidienne de deux litres d’eau tritiée à hauteur de 7 800 Bq/l (valeur guide de l’OMS pour ce radioélément)[28].
L'eau fortement contaminée au tritium peut avoir une activité supérieure au kilo-Becquerel par litre (kBq/l). Une telle eau n'est pas jugée très toxique, mais est réputée « non potable ». Sous cette valeur, il est incorrect de parler de « pollution » ou de « contamination » pour une eau qui reste potable sans restriction de quantité ni de durée. On parlera plus correctement de « marquage au tritium » d'une eau, quand des traces de tritium peuvent y être mesurées sans incidence sur la potabilité (de 1 Bq/l à 1 000 Bq/l).
Par exemple, près de l'usine de retraitement de La Hague, la mer contient de 3 à 30 Bq/l malgré la forte capacité de dilution du tritium, soit 15 à 150 fois plus que la moyenne[29]. En France, les teneurs des eaux de surface et de nappe dépassent rarement 10 Bq/l même si elles grimpent localement et ponctuellement jusqu'à 20 Bq/l[30], voire plus (ie. près du site de Valduc, l’eau d’alimentation du site était en 1996 marquée à des taux atteignant plusieurs dizaines de Bq/l, voire près de 100 Bq/l, soit 10 % du seuil de non-potabilité).
Selon la CRIIRAD (1995), l'eau de pluie marquée en tritium par les tests nucléaires et par le tritium naturel est susceptible de marquer les nappes phréatiques jusqu'à 4 Bq/l. Au-delà, on peut suspecter qu'une autre source de tritium soit en cause, avec certitude au-dessus de 7 Bq/l.
La contamination totale moyenne par des traces de tritium reste environ 100 fois sous la limite donnée par l'OMS pour l'eau potable (10 000 Bq/l). Le facteur de dose pour l'eau tritiée étant de 1,8.10-11 Sv/Bq, il faudrait boire 100 m3 (ce qui prendrait trente ans à raison de dix litres par jour) d'une eau marquée à 10 000 Bq/l pour subir une exposition de 18 mili-sievert, dont l'effet biologique est en pratique indétectable.
Le marquage de l'eau au tritium constitue un enjeu médiatique et politique important, d'autant plus sensible que le tritium se répand facilement dans l'environnement, et que la radioactivité due au tritium est facilement décelée. Cet enjeu fort justifie que les rejets en tritium soient limités au strict nécessaire, indépendamment de son incidence effective (négligeable d'après les experts en radioprotection) sur la santé publique. Ainsi, le gouvernement de l'Ontario (Canada) a recommandé que le maximum de tritium toléré dans l'eau potable passe de 7 000 Bq/l à 20 Bq/l en 5 ans et que l'on vise une réduction plus importante[31].
Métabolisme des molécules tritiées
Formes du tritium dans la biosphère
Dans l'environnement, le tritium se présente sous 3 formes principales :
- T2 (tritium gazeux) ; HT (dihydrogène tritié) ; CH3T (méthane tritié) ;
- HTO (Eau tritiée) : 99 % environ du tritium produit prend rapidement cette forme, essentiellement dans l'océan mondial. En 1972, l'UNSCEAR estimait à 6,3×1019 Bq, contre 4,3×1019 Bq aujourd'hui[32]. Ce sont les océans qui en contiennent le plus, mais si dilué dans leur masse que le taux de tritium (0,2 Bq/L en moyenne) est bien plus bas que dans les eaux continentales (UNSCEAR, 1993), sauf en cas de proximité d'installations nucléaires ;
- OBT (pour « Organically Bounded Tritium » ; expression désignant le tritium intégré de manière covalente au sein de molécules organiques), dans les organismes vivants (biomasse), leurs cadavres (nécromasse) ou excréments et excrétats, dans la matière organique du sol et des sédiments...
Via le recyclage de la nécromasse ou plus généralement via la chaîne alimentaire, ces trois formes de tritium peuvent être transférées aux autres compartiments de l’écosystème.
Fixation biologique du tritium
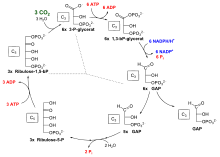 Fixation de l'hydrogène sur le carbone par la photosynthèse (cycle de Calvin) transformant le tritium en forme non échangeable.
Fixation de l'hydrogène sur le carbone par la photosynthèse (cycle de Calvin) transformant le tritium en forme non échangeable.
Il est essentiellement présent dans l'eau sous forme d’eau tritiée (liquide ou vapeur). On parle alors de tritium libre (par opposition au tritium incorporé dans une molécule organique, qui est dit « lié »). De même que l'hydrogène gazeux, le tritium gazeux (HT) n'est pratiquement pas métabolisé. Seul 0,01 % de l’activité inhalée est absorbé pour être ensuite oxydé rapidement en eau tritiée.
Parce que soluble dans l'eau et s'intégrant dans l'eau (eau tritiée), le tritium pénètre facilement dans les organismes par inhalation, ingestion ou à travers la peau ou les muqueuses. Le tritium ayant presque les mêmes propriétés chimiques que l'hydrogène, il s'y substitue, y compris en se liant à d'autres atomes, dans les molécules, notamment organiques, de la même manière que le ferait l'hydrogène, et l'eau tritiée se répartit sur l'ensemble du cycle de l'eau. Associé (passivement ou via le métabolisme bactérien ou d’autres espèces) à certaines molécules organiques, le tritium devient du « Tritium Organiquement Lié Echangeable » (dit TOL-E ou OBT-E) ; il s’est alors substitué à l'hydrogène de radicaux typiques (-OH, -SH, =NH, ...) et circule dans les organismes vivants en empruntant les voies de ces radicaux.
Les atomes de tritium de la fraction organique échangeable sont très labiles (liaisons covalentes faibles). Le tritium organique en position échangeable se met en fait en équilibre avec le tritium contenu dans l'eau cellulaire et subit les mêmes évolutions[33]. Sa période biologique est donc sensiblement la même que celle de l'eau tritiée.
De la forme liée en eau tritiée, le tritium est également incorporé à la matière organique lors de la photosynthèse.
Le tritium est qualifié de « Tritium Organiquement Lié Non-Echangeable » (TOL-NE ou OBT-NE) quand il s’est directement lié aux atomes de carbone des molécules organiques. Ces dernières molécules sont beaucoup plus stables car les liaisons carbone-hydrogène donnent des liaisons covalentes fortes qui nécessitent une combustion ou un crackage ou une hydrolyse enzymatique pour être cassées.Le tritium non échangeable peut avoir un comportement très différent de celui du tritium libre ou en solution dans l’eau dans l’organisme[34].
Sous forme organique liée non échangeable (OBT), la manière dont le tritium participe au métabolisme dépend de la molécule où il s'est fixé. De ce fait, le tritium montre dans la cellule une diffusion non homogène (ce qui en toute rigueur peut conduire à un niveau de dangerosité variant avec la forme de l'OBT).
Sa période radioactive de 12,3 ans lui permet d’avoir des effets sur un temps significatif du point de vue écotoxicologique.
Le tritium fixé participe à l'ensemble du métabolisme, y compris l'élaboration de l'ADN : Komatsu, en contaminant expérimentalement un réseau trophique constitué de diatomées (Chaetoceros gracilis), de petites crevettes (Artemia salina) et de poissons (Oryzias latipes), constatait qu'une part significative de ce tritium est incorporé dans l’ADN des artémies[35]. Cependant, sur des organismes à cycle de vie plus long, Kirchmann ne constatait pas de concentration particulière dans l’ADN[36].Sous forme fixée, il n'y a plus d'échanges avec l'eau cellulaire et les autres radicaux à liaison faible. Sa période biologique n'est plus liée à celle de l'eau tritiée, mais dépend du métabolisme associé à la molécule porteuse, laquelle peut être très stable dans l'organisme. La durée de l’incorporation de tritium dépend donc du turn-over de la molécule biologique : rapide pour des molécules qui participent au cycle énergétique, plus lente pour des molécules de structure ou des macromolécules comme l’ADN, ou bien des molécules de réserve énergétique[37]. C'est sous cette forme qu'il marque l'environnement de façon durable. C'est cette fixation qui permet par exemple de reconstituer les teneurs historiques en tritium par l'étude des cernes d'arbres[38].
Cinétique dans l'organisme
La période biologique (sensiblement égale à la période effective dans le cas du tritium) varie suivant la forme sous laquelle le tritium est fixé. Quelle que soit la forme de l’apport en tritium, la plus grande partie du tritium est réputée éliminée en 1 mois et la presque-totalité est éliminée en moins de 1 an. Sa période biologique est donc très inférieure à sa période radioactive.
Il est bien plus rare sous forme gazeuse que sous forme d'eau tritée. La part inhalée est réputée se répandre équitablement dans les tissus mous, et se met en équilibre avec la concentration extérieure. Le tritium gazeux est peu soluble, seul 0,01 % de l’activité inhalée est transféré dans le sang sous forme d’HTO[19]. L’assimilation sous forme de tritium gazeux est donc environ 10 000 fois plus faible que sous forme d’eau tritiée.
L'eau tritiée étant très semblable à de l'eau ordinaire, son importance en radiotoxicité dépasse celle du gaz tritium[39] parce qu'elle est assimilée par l'organisme.
L’eau tritiée suit la biocinétique de l’eau avec un équilibre rapide entre HTO et H2O. L'eau tritiée se mêle rapidement à toute l'eau du corps[31]. L’eau tritiée diffuse librement et rapidement à travers toutes les membranes cellulaires et s’équilibre avec les fluides corporels en quelques minutes[19].
L’eau tritiée est éliminée via la transpiration, la vapeur d'eau expirée et l'excrétion urinaire[40]. On admet qu’en moyenne le renouvellement de l’eau libre corporelle s’effectue avec une période biologique de 10 jours chez l’adulte[19]. Cette valeur reflète le cycle de l'eau dans l'organisme considéré. Les périodes biologiques varient en fonction de l’âge, pour la partie eau tritiée : de 3 jours à l’âge de 3 mois à 10 jours chez l’adulte[19]. Les 3 % qui passent sous forme de tritium organique (essentiellement sous forme lié échangeable) sont éliminés avec une période de demi-vie dans l'organisme de 40 jours : chez le rat buvant une eau tritiée, 97 % du tritium incorporé a une demi-vie biologique de 10 jours, et 3 % a une demi-vie de 40 jours.Si ce sont les aliments qui sont contaminants, le tritium peut être présent sous forme d'eau (tritiée) dans les tissus, d'OBT échangeable substitué à d'autres radicaux, ou d'OBT non échangeable. La part présente sous forme d'eau tritiée s'élimine avec une demi-vie de l'ordre de dix jours. En milieu marin, l'OBT a une demi-vie de 10 jours pour 70 % du tritium incorporé, et de 100 jours pour le 30 % restant[41],[42]. Les molécules organiques tritiées (OBT) apportées par l’alimentation sont dégradées par la digestion et transférées dans le sang sous forme d’eau tritiée, ou sous forme de molécules organiques tritiées de plus petite taille. La plupart des composés organiques absorbés (sucres, graisses, protides) sont utilisés et dégradés pour produire de l’énergie et de l’eau tritiée ; celle-ci rejoint le pool d’eau cellulaire. Cette eau est ensuite partiellement recyclée dans la synthèse des protéines, hormones, lait, graisses[19].
Sous forme organique (TBO)[40], sa période de demie-vie est de 40 jours chez l'adulte (contre 8 jours chez le nourrisson[19]).Une faible proportion du total (moins de 1 % du tritium absorbé) est présente sous forme organique beaucoup plus stable, avec une période biologique d'environ 450 jours (composés organiques de renouvellement lent)[40]. Le tritium lié (sous forme non échangeable) dans la matière organique est plus rare, mais plus dangereux car moins rapidement éliminé (période de 550 jours, soit 55 fois plus que les 10 jours de séjour de l'eau tritiée)[43].
Facteur de fixation
À l'équilibre, s'il n'y a pas de mécanisme favorisant la concentration de cette substance (ou son élimination), on s'attend à trouver la même concentration dans l'organisme et dans le milieu environnant, c'est-à-dire une absence de bioconcentration et un facteur de concentration égal à l'unité. Trouver un facteur différent peut être l'indice d'une bioaccumulation, mais peut également provenir d'autres causes de déséquilibre.
- Au sens strict du terme, la bioaccumulation résulte d’un phénomène d’accumulation progressive d’un contaminant ou d’une substance toxique dans un organisme, à partir de diverses sources, y compris l’atmosphère, l’eau et les aliments, jusqu’à l’obtention d’une concentration dans l’organisme supérieure à celle des sources de contamination.
- Il peut s'agir de la rémanence d'une contamination passée dans certains de ses tissus, induisant un déséquilibre apparent par rapport à la concentration actuelle du contaminant dans l’environnement, plus faible qu’autrefois.
- Il peut également s'agir d'un déséquilibre entre les différentes sources : par exemple, si le tritium est répandu dans le milieu marin sous forme OBT et est incorporé par voie alimentaire, la concentration attendue le long de la chaîne métabolique de l'OBT sera différente de celle de l'eau[44],[45].
- Il peut enfin s'agir d'une migration le long de la chaîne alimentaire, les proies dont s'alimente l'organisme contaminé ayant pu croître dans un milieu distant et plus fortement contaminé que le milieu ambiant.
Dans les organismes ayant été exposés à un pic de concentration importante en tritium, le tritium sous forme de gaz ou d'eau tritiée se remet rapidement en équilibre avec l'environnement, contrairement à l'OBT. Dans les milieux à concentration variable, c'est donc sous forme organique (OBT) qu'on le trouve fixé en plus grande quantité (90 à 95 % du tritium trouvé dans les organismes marins autour de Cardiff, 80 à 90 % autour de Sellafield. Autour de Hartlepool, l'OBT constitue 70 % du tritium accumulé par les moules et sa proportion est encore plus élevée (90 %) chez les bigorneaux[45].
On sait depuis les années 1970 au moins que la contamination nutritionnelle par des formes organiquement liées est prépondérante[46]. Par exemple, Rodgers en 1986 montrait chez des juvéniles de truite arc-en-ciel que la quantité (maximale à l'équilibre) de tritium organique correspondait à 80 % de la quantité de tritium ingérée[42]. Kirchmann en 1971 montrait que sur des prairies contaminées au tritium, le lait contenait 10 fois plus de tritium organique via l'alimentation que via l'eau d'abreuvage[47]. L'incorporation dans le lait était plus rapide par voie directe, et plus lente via l'herbe avec un maximum après 4 jours[47]. Kirchmann constatait que chez des veaux et porcs contaminés par du tritium via diverses voies (injections intra péritonéales, ingestions d’eau tritiée, de lait, de poudre de lait et de pommes de terre), l’incorporation augmentait (5,6 fois plus chez les porcs et 15 fois plus chez les veaux) quand le tritium était présent dans la poudre de lait (comparée à la voie eau). Elle était 15,6 fois plus élevée chez les porcs nourris de pomme de terre contaminée[36]. Des rats exposés via l'eau de boisson ou des molécules organiques (leucine, lysine, glucose, glucosamine, thymidine et uridine) bioaccumulent 4 à 9 fois plus de tritium que lié à l’eau. Komatsu, en contaminant expérimentalement un réseau trophique constitué de diatomées (Chaetoceros gracilis), de petites crevettes (Artemia salina) et de poissons (Oryzias latipes), constatait que la fixation du tritium est bien plus forte avec le tritium contenu dans la nourriture, que dans l’eau.
À cause de cette différence dans la période biologique, la part d’irradiation due au tritium organique est le double de celle due à l’eau tritiée[48]. Pour en tenir compte, l'Agence Health Protection Agency, a proposé de réévaluer à 6 x 10-11Sv.Bq-1 le facteur de dose pour le tritium apporté par les poissons plats de la baie de Cardiff[49].
Bioaccumulation du tritium
La possibilité d'une bioamplification du tritum a été avancée par certaines ONG (Crii-Rad, Greenpeace, ACRO…) qui dénoncent depuis les années 1980 les larges autorisations de rejets industriels de tritium et de carbone 14, en s'appuyant sur l'idée que des organismes filtreurs (ou biointégrateurs) peuvent métaboliser ou reconcentrer de nombreux toxiques dilués dans l'environnement (par exemple, une moule peut concentrer 700 000 fois, voire jusqu'à environ 1 million de fois, l'iode qui est si faiblement réparti en mer qu'il n'est souvent pas quantifiable dans l'eau). Affirmer l'existence d'une bioamplification (quand les études scientifiques ne mettent en évidence qu'une bioconcentration) permet à ces organisations de défendre l'idée que toute concentration dans l'environnement est potentiellement nuisible pour le sommet de la chaîne alimentaire. De ce fait, c'est une question discutée et très polémique, notamment suite à des études publiées dans les années 2000, qui mettent en évidence dans certains organismes une concentration en tritium supérieure à celle de l'eau de mer où ils évoluent. Ainsi dans l’estuaire de la Severn[50] et le canal de Bristol, les poissons (flet et sole) vivant au contact du sédiment et s'y alimentant étaient bien plus contaminés que le sprat, pélagique et planctonophage[50].
Dans le cas du tritium, cependant, l'accumulation ne porte pas sur une substance chimique, mais sur un isotope : s'il y a une bioaccumulation, elle ne peut résulter que d'une séparation isotopique, dont les rendements sont toujours faibles dans les systèmes vivants[51]. De petites différences de comportement entre tritium et hydrogène sont néanmoins connues. Dès 1990, Alpen note[52] que le tritium étant trois fois plus lourd que l'hydrogène et d'une taille atomique très supérieure, une discrimination biologique est envisageable, d'autant qu'on admet que les réactions enzymatiques incorporent proportionnellement moins vite le tritium que l’hydrogène et que les liaisons tritium-carbone sont plus fortes que les liaisons hydrogène-carbone : ces différences dans le métabolisme devraient impacter sa cinétique environnementale[52] et conduire à des écarts de bioconcentration quand le métabolisme modifie la liaison hydrogène[53]. Cependant, ces différences physico-chimiques des molécules résultantes restent très faibles : l'eau tritiée est physiquement si proche de l'eau qu'elle se comporte chimiquement comme elle dans tout son cycle, sans facteur de séparation du tritium possible ou significatif[54]. De plus, une fois que l'atome de tritium est lié, le facteur de séparation de la molécule dans son ensemble est d'autant plus faible que la molécule est lourde.
En milieu aquatique marin et continental, il est acquis que le transfert du tritium de l’eau ambiante aux organismes aquatiques conduit très rapidement à un équilibre entre l’eau tritiée du milieu d’exposition et le tritium libre des tissus biologiques. Pour des invertébrés marins, des facteurs de concentration OBTorganisme/HTOeau supérieurs à 1 ont été relevés en diverses situations par des auteurs (cas de la baie de Cardiff notamment) ; ils peuvent s’expliquer par l’origine et la forme physico-chimique du tritium incorporé (ingestion de molécules organiques tritiées)[55]. L'IRSN considère qu'il y a situation d’« équilibre-vrai » et que le tritium ne s'accumule pas préférentiellement dans tel ou tel composant environnemental ou biologique[56]. En France, en 2008, des membres de l'IRSN, et de la SFRP estiment que les différences entre tritium et hydrogène ne justifient pas un relèvement des seuils estimés de dangerosité[57]. L'étude de 2 algues marines (Dunaliella bioculata & Acetabularia mediterranea) avait dès 1983 suggéré une possibilité de bioaccumulation sélective[58] mais ce résultat non conclusif n'a pas été confirmé depuis.
Radiotoxicité
Le tritium est un isotope aux caractéristiques inhabituelles : très facilement incorporé à l’eau (eau tritiée ou « HTO »), avec un trajet court des électrons (ß) : < Ø noyau, une densité d’ionisation élevée (mais peu de cellules touchées)[59], pouvant provoquer des dommages à l’ADN, avec une inhomogénéité des doses et fixations intra cellulaire quand il est présent sous forme d’OBT (tritium organiquement lié) alors que la répartition est homogène pour l’eau tritiée, et pour ces raisons une efficacité biologique plus grande que d’autres radionucléide[60],[61].
Efficacité biologique relative
Jusqu'en 2008, les autorités sanitaires considéraient[62] que l'EBR (Efficacité biologique relative) du tritium était de 1. Cependant, la littérature scientifique disponible, incluant les études récentes lancées en 2007 en Grande-Bretagne à partir du rapport RIFE 11 (Radioactivity In Food and the Environment) des agences environnementales et sanitaires britanniques, et des études du groupe AGIR (HPA) suggérait un besoin de réévaluer l'impact biologique du tritium sur l’Homme suite à une possible sous-estimation de l'efficacité biologique relative du rayonnement du tritium).
En 2008, le Groupe d'experts de l’Article 31 du Traité Euratom a recommandé de la réévaluer ; « Sur la base des données scientifiques actuelles, un relèvement de 1 à 2 de la valeur du facteur de pondération lié au rayonnement (wR) du tritium devrait être envisagé »[63]. L'Autorité française de sûreté nucléaire (ASN) a créé en 2008 2 groupes de réflexion, mandatés pour analyser les risques posés par le tritium en termes de santé environnementale. Après 2 ans de travail, ces groupes ont produit avec l'ASN en 2010 un Livre blanc sur le tritium[64] concluant que les risques liés au tritium ont dans le passé été probablement sous-estimés. Le groupe de travail, présidé par M. Smeesters, préconise de multiplier par deux le facteur de pondération du tritium pour les rayonnements (wR) (2 au lieu de 1) pour le calcul du risque individuel[65].
Effet biologique et cancérogénéité
Du fait de sa période radioactive relativement courte, le tritium a une activité spécifique élevée (3,58.1017 Bq/kg). Autrement dit, une masse de tritium très faible correspond à un nombre de désintégrations par seconde élevé. Cependant, parce que l'hydrogène est un élément chimique majeur, entrant dans la plupart des molécules existant naturellement et en particulier l'eau, le tritium ne peut pas exister dans l'environnement à l'état pur et n'apparaît jamais que comme une très faible fraction de l'hydrogène, en masse ou nombre d'atomes.
L'énergie moyenne émise lors d'une désintégration est l'une des plus faibles des radionucléides (5,7 keV), soit de l'ordre de 100 à 1 000 fois plus faible que d'autres radionucléides bien connus tels que l'iode 131, le césium 137 ou la plupart des émetteurs alpha, ce qui en fait un radionucléide de très faible radiotoxicité.
Pour le tritium (émetteur beta pur), le dépôt d'énergie s'effectue sur le parcours de ses électrons, soit au maximum 6 µm et en moyenne 0,56 µm, à comparer à la taille des cellules, de 2 à 200 µm. La radiotoxicité du tritium ne se manifeste donc qu'après incorporation (ingestion, inhalation ou dans une moindre mesure par passage transcutané d'eau). Les effets des désintégrations dans les cellules dépendent de la répartition des atomes de tritium en leur sein et en particulier de la distance aux molécules d'ADN. Il est connu que des molécules marquées particulières incorporées à l'ADN ont un effet notablement supérieur à celui de l'eau tritiée, de répartition beaucoup plus homogène. Inversement, des désintégrations hors noyau n'auront pas d'incidence. Enfin, les périodes biologiques des molécules contenant du tritium sont en très grande majorité courtes (de 10 jours pour l'eau tritiée, 40 jours en moyenne pour les molécules organiques, et pour les plus stables d'entre elles jusqu'à quelques années). Ceci réduit considérablement le nombre de désintégrations se réalisant effectivement dans un organisme vivant après incorporation et renforce le caractère très faiblement radiotoxique de ce radionucléide.
L’eau tritiée (HTO) diffuse de manière homogène dans toutes les cellules, traverse aisément la barrière placentaire et participe à la composition des cellules du fœtus en croissance[40]. Par les biosynthèses, le tritium pourra être incorporé dans toutes les molécules organiques des cellules de l'embryon (végétal, animal ou fongique de quelques cellules), y compris celles de l’ADN. L'inexistence d'une discrimination (positive ou négative) entre les isotopes de l'hydrogène n'est pas prouvée. Une discrimination positive augmenterait le risque de mutation (et indirectement de fausse-couche chez la femme).
Les molécules organiques tritiées présentes dans le sang de la mère traversent elles aussi la barrière placentaire, et sont soit consommées soit utilisées ou transformées dans les cellules du fœtus. Selon la molécule considérée, la répartition peut ne pas être homogène[40]. De plus, quand il était inclus dans une molécule (eau, matière organique, protéine, etc.), sa désintégration (qui le transmute en un atome d’hélium) transforme la molécule hôte par la perte d'un hydrogène, avec des conséquences biologiques encore mal évaluées (mutations possibles).
Des effets sur la santé n'ont été rapporté chez l'Homme qu’à fortes doses[40]. Des mutations, mort cellulaire, modifications chromosomiques ont été observées, mais seulement au-delà de plusieurs kBq/mL ; Chez l’animal ; des excès de cancers ont été observés, mais à doses élevées (à partir de 0,1-0,2 Gy, soit 100-200 mSv)[19]. C'est pourquoi l'effet biologique du tritium, émetteur bêta, a longtemps été considéré comme similaire à celui d’une exposition externe gamma.
Facteur de dose
Les facteurs de doses sont toujours faibles, mais la radiotoxicité diffère suivant que le tritium est absorbé sous forme gazeuse, d'eau, ou de molécules organiques (OBT: organically bound tritium ou tritium organique lié).
Facteurs de dose :
- tritium gazeux : 1,8.10-15 Sv/Bq. Le tritium gaz étant très difficile à capter, la technique d'épuration de l'air rejeté consiste à le transformer en eau et à piéger cette eau avant rejet. Le fait que le facteur de dose de l'eau tritiée soit très supérieur à celui du gaz diminue l'intérêt de cette technique ;
- eau tritiée : 1,8.10-11 Sv/Bq ;
- tritium organiquement lié (OBT) : 4,1.10-11 Sv/Bq (facteur s'appliquant à l'ensemble des molécules du bol alimentaire et non à des molécules organiques particulières, dont la répartition au sein des cellules peut être inhomogène[63]).
Le tritium fait règlementairement[66] partie du groupe de radiotoxicité le plus faible (groupe 4). Compte tenu de sa très faible radiotoxicité, des excès de cancers ne sont attendus que pour des expositions de l'ordre du giga-becquerel.Le tritium ne délivre (en moyenne, par personne au voisinage des installations concernées) qu'une dose annuelle d'environ 1 microsievert (µSv), soit mille fois moins que le seuil limite pour le public qui est de 1 millisievert[64]. Aux doses habituellement rencontrées, les études épidémiologiques ne mettent pas en évidence d’excès de cancers attribuables au tritium[62]. Christian Bataille, dans son rapport[67] sur la gestion des déchets nucléaires affirmait cependant que le tritium « présente pour la santé humaine des dangers incontestables qu’il convient de ne jamais oublier. »
Radioprotection
Sa radiotoxicité (et par suite son écotoxicité) pourraient être revue à la hausse pour plusieurs raisons :
- les rejets de chaque centrale sont faibles (ex : environ 40 gr/an en France), mais elles seront de plus en plus nombreuses selon l'industrie nucléaire, et en aval le retraitement du combustible est une source plus importante de rejet ;
- ces rejets devraient fortement augmenter en France et dans le monde avec les nouvelles générations de centrales (2 réacteurs EPR en cours de construction ou prévus à Flamanville et Penly en France). Le projet ITER (réacteur à fusion thermonucléaire) en produira également plus que les actuels réacteurs à eau pressurisée[68] ;
- ces rejets sont localement très significatifs (aux points de rejet à La Hague par exemple, dans l’eau et dans l’air) ;
- des données récentes évoquent une bioaccumulation possible voire fréquente, dont pour des formes organiques du tritium, dans les sols ou sédiments, et dans certains végétaux[69],[70] consommés par l’homme (radis[71], riz[72],[73] ou laitue par exemple), à partir de l’air ou du sol[74], plus rapidement en période de croissance exponentielle du végétal[75].
Mesure, dosage
Il a fallu attendre les années 2000 pour mieux le doser[76]. Les techniques d'analyses sont les suivantes :
- une chambre d'ionisation des gaz permet de mesurer des concentrations importantes, de même que la microcalorimétrie pour des solides (sous forme d'hydrures par exemple) ;
- l'eau tritiée, ou des liquides (extraits par distillation azéotropique de plantes, animaux, champignons, sols) peuvent être analysés facilement par scintillation liquide ;
- vers 1980 sont apparus des compteurs à très bas bruit de fond détectant le tritium à partir de 5 Bq/l. De nouveaux flacons de comptage ainsi que des « cocktails scintillants » spéciaux ont permis de le détecter à partir de 1 Bq/l[77] ;
- la spectrométrie de masse de cet isotope est encore plus précise, mais plus longue (délais d'attente pour les analyses). Le tritium de l'air doit être analysé dans l'eau, après y avoir été solubilisé. Le tritium peut dégazer d'un échantillon liquide pour s'enfuir dans l'atmosphère. Les échantillons sont donc conservés en flacons étanches et avec une pellicule d'huile minérale sur le liquide ;
- une eau faiblement tritiée peut être « enrichie » pour analyse en profitant du fait que, lors de l'électrolyse, le tritium se dégage à la cathode plus lentement que l’hydrogène ordinaire (car ce dernier est plus léger). Cette technique permet d’accroître les seuils d'analyse de 0,2 jusqu’à 0,02 Bq/l ;
- les échantillons de sols ou de tissus vivant sont congelés et si possible traités dans leurs récipents d'échantillonnages qui doivent être étanches.
Surveillance
Il est surveillé dans l'air et les pluies depuis les années 1950. On sait mieux le doser depuis les années 2000[76], mais sa cinétique et l'impact de ce tritium dans le réseau trophique est encore discuté et mal compris (notamment pour ses formes organiques).
On s'y est intéressé chez les lichens réputés bons biointégrateurs et bioindicateurs de certains stress environnementaux, particulièrement résistants à la radioactivité, l'algue symbiote du lichen fixant le tritium et le carbone 14 via la photosynthèse, pour ensuite l'inclure dans des composés organiques, dans l'algue et le champignon-partenaire. Le lichen arboricole permet un suivi des eaux météoritiques (pluie, vapeur, rosée, etc.) sans contamination par le tritium du sol ou par le tritium de l'eau du sol. L'analyse des lichens anciens ou de lichens transférés autour de sites civils ou militaires permet de cartographier, parfois de manière spectaculaire, les retombées provenant de ces installations[78]. L'analyse des cernes du bois d'arbre[79] permet par ailleurs d'estimer les variations annuelles d'absorption par les arbres.
En France : dans les années 2000-2010, chaque année, plus de 20 000 mesures de tritium étaient faites dans l'eau et l'air autour des centrales[80], et on commence à chercher à évaluer son impact autour des centrales[81].
Gestion des déchets tritiés
La loi du 28 juin 2006 relative à la gestion durable des matières et déchets radioactifs, imposait aux autorités responsable de ces déchets « la mise au point pour 2008 de solutions d'entreposage des déchets contenant du tritium permettant la réduction de leur radioactivité avant leur stockage en surface ou à faible profondeur ».
Plan d'actions de l’ASN (France)
Au vu des données récentes, et par « précaution », l'ASN a demandé à l'IRSN, à l'Agence nationale de sécurité sanitaire, au CEA et à la Commission Internationale de Protection Radiologique d’étudier plus finement les effets du tritium sur l’environnement, l’embryon et le fœtus.
L’ASN engage les acteurs concernés à harmoniser les méthodes d'évaluation des doses selon l’espèce physico-chimique du tritium, et selon la voie de contamination (inhalation, ingestion, passage percutané, etc.), et non plus seulement selon la durée d'exposition.
L'ASN a demandé des investigations sur d'éventuels effets cancérigènes ou héréditaires (études épidémiologiques chez les travailleurs...).
L'ASN doit créer un comité de suivi de ce plan. L'agence invite aussi les exploitants d'installations nucléaires (Areva, EDF) à mieux maîtriser leurs rejets du tritium et mettre en place une veille technologique en matière de « détritiation » des rejets.
Notes et références
Bibliographie
- Raskob, W, Strack S, FZK-Autoren, U.A. Tritium in the food chain. Comparaison of predicted and observed behaviour. A. Re-emission from soil and vegetation. B. Formation of organically bound tritium in grain of spring wheat, Biomovs II Technical Report n° 13, sept 96.
- Raskob, W, Strack S, FZK-Autoren, U.A. Tritium in the food chain.Intercomparison of model predictions of contamination in soil, crops, milk and beef after a short exposure to ttitiated water vapour in air, Biomovs II Technical Report n° 8, sept 96.
- Raskob, W, Diabate S, Strack S, A new approch for modelling teh formation and translocation of organically bound tritium in accident consequence assessment, codes Internat. Symp on Ionizing Radiation: Protection ot the natural Environment, Stockholm, S, may 20-24, 1996.
Références
- Comprehensive Review and Critical Evaluation of the Half-Life of Tritium, National Institute of Standards and Technology
- Fiche tritium du CEA
- (en)An Evaluation of the Neutron and Gamma-ray Production Cross Sections for Nitrogen, Los Alamos Scientific Laboratory.
- Nuclear Weapons Frequently Asked Questions
- Fusion Science and Technology, Volume 54, Number 2, August 2008
- (en) Long-Lived Activation Products in Reactor Materials, NUREG/CR-3474, accessible en ligne
- Argonne National Laboratory, fact sheet on Tritium
- http://www.nuclearfaq.ca/cnf_sectionD.htm#x5
- Hisham Zerriffi "Tritium: The environmental, health, budgetary, and strategic effects of the Department of Energy's decision to produce tritium". Institute for Energy and Environmental Research.
- Article R 43-2
- IAEA, 2008 Données sur le tritium (sur le site de l’AIEA)
- HPA 2007, Review of Risks from Tritium, in “Report of the independent Advisory Group on Ionising Radiation (AGIR)”, Health Protection Agency, Radiation, Chemical and Environmenta Hazards, United Kingdom.
- IAEA, 2003. Modelling the environmental transport of tritium in the vicinity of long term atmospheric and sub-surface sources, in “BIOsphere Modelling and ASSessment (BIOMASS) program”. Tritium Working group. Vienna, Austria
- IAEA, 2007a. Definition of Organically Bound Tritium (OBT), in “Environmental Modelling for Radiation Safety (EMRAS) program”. Tritium and C-14 Working Group. Vienna, Austria
- Grosse, A.V., Johnston, W.M., Wolfgang, R.L., Libby, W.F., 1951. Tritium in Nature. Science, 113 (1-2)
- Sources de tritium, CEA, consulté 2010/07/16
- Voir fiche radionucléide déjà citée.
- Voir fiche radionucléide déjà citée, page 3.
- [http://www-carmin.cea.fr/espace-pedagogique/rayonnements-ionisants-et-sante/les-radionucleides/le-tritium-3h Fiche CEA Rayonnement ionisants et santé, consulté 2010/07/14
- Sources de production et gestion du tritium produit par les installations nucléaires (IRSN) in Le livre blanc du tritium.
- Sources and effects of ionizing radiation - United Nations Scientific Committee on the Effects of Atomic Radiation. UNSCEAR 2000 Report to the General Assembly.
- Revue de l'ASN n° 117 (Voir page 79, article "Tritium, carbone 14 : mythe ou réalité ?")
- Livre blanc sur le tritium - ASN.
- Source : "Rejets dans l'environnement" (CEA)
- Note d'information du 2 décembre 2010, Synthèse des résultats des mesures de tritium effectuées par l’IRSN depuis le 5 novembre dans l’environnement du bâtiment de l’entreprise 2M Process à Saint-Maur-des-Fossés (94)
- Fiche radionucléide Tritium et environnement, IRSN 2001.
- Décret n° 2001-1220 du 20 décembre 2001 - JORF du 22 décembre 2001, p. 20392.
- Fiche de synthèse sur le Tritium (A. Comte CEA / EDF Décembre 2005)
- Fiche IRSN déjà citée, page 5 sur 15.
- OPRI, Tableaux mensuels de mesure, Office de Protection contre les rayonnements ionisants, Le vésinet, 1995.
- ACES, 1994
- (UNSCEAR, 1993)
- Fusion magnétique : Le tritum, CEA
- En particulier au cœur même de l'ADN, rappelle M. Smeesters, expert en radioprotection pour la Commission européenne. Le Dr Patrick Smeesters est « Expert senior radioprotection, AFCN », Maître de conférences (UCL, ULB), Président du groupe de travail RIHSS (Research Implications on Health Safety Standards) du groupe d'experts de l'article 31 du Traité Euratom.
- Komatsu K., Higushi M., Sakka M. (1981). Accumulation of tritium in aquatic organisms through a food chain with three trophic levels. J. Radiat. Res., 22, 226-241
- Kirchmann R., Charles P., Van Bruwaene R., Remy J., Koch G., Van Den Hoek J. (1977). Distribution in the different organs of calves and pigs after ingestion of various tritiated feeds. Curr. Top. Radiat. Res. Q., 12, 291-312.
- Fiches de synthèse radionucléides sur le Tritium, CEA
- http://www-dase.cea.fr/public/dossiers_thematiques/analyse_du_tritium_organiquement_lie_dans_des_echantillons_biologiques/description.html
- 25 000 fois plus, selon une étude de l'AIEA - AIEA 1991
- Aspects radiotoxicologiques du tritium Dr Laurence Lebaron-Jacobsdsv / dir / Prositon CEA de Cadarache ; Nucléaire et Santé Paris 30 janvier 2009, PPT, 13 pages
- Hodgson A., Scott J.E., Fell T.P., Harrison J.D. (2005). Radiation doses from the consumption of Cardiff Bay flounder containing organically bound tritium (OBT). J. Radiol. Prot., 25, 149-159 (Résumé).
- Une exposition chronique de truites par l’eau environnante conduit à une période biologique d’environ 10 jours alors qu'une contamination par l'alimentation allonge cette période à 18 à 32 jours : Rodgers D. (1986). Tritium dynamics in juvenile rainbow trout, Salmo gairdneri. Health Phys., 50, 89-98.
- Fairlee, 1992.
- L'ACRO fait remarquer que le suivi des algues est un mauvais indicateur pour le passage du tritium vers la faune marine, car à Cardiff, où le tritium est rejeté sous forme libre (HTO) et organiquement liée (OBT), la teneur en tritium (3H organique et 3H total) dans les flétans et les moules était 100 fois plus élevée que dans le fucus Fucus serratus [RIFE (Radioactivity In Food and the Environment) ; rapports des agences environnementales et sanitaires britanniques, de 1996 à 2008]
- Des FC atteignant 500 ont été constatés chez des poissons et mollusques vivant autour de Cardiff, avec un record de 6 000 et des facteurs avoisinant les 10 autour de Sellafield et de Hartlepool communication orale de Stuart Jenkinson (Cefas) à la SFRP (septembre 2009), citée par le livre blanc de l'ASN sur le tritium
- Koranda J.J., Martin J.R. (1972). Movement of tritium in ecological systems. Nucl. Sci. Abstr., 26, 9485
- Kirchmann R., Van Den Hoek J., Lafontaine A. (1971). Transfert et incorporation du tritium dans les constituants de l’herbe et du lait, en conditions naturelles. Health Physics, 21, 61-66.
- Takeda H. (1991). Incorporation and distribution of tritium in rats after chronic exposure to various tritiated compounds. Int. J. Radiat. Biol., 59, 843-853.
- Hodgson A, Scott JE, Fell TP, Harrison JD ; Doses from the consumption of Cardiff Bay flounder containing organically bound tritium ; J Radiol Prot. 2005 Jun;25(2):149-59. Epub 2005 Jun 7 (Résumé)
- McCubbin D., Leonard K.S., Bailey T.A., Williams J., Tossell P. (2001). Incorporation of organic tritium (3H) by marine organisms and sediment in the Severn estuary/Bristol Channel (UK). Mar. Pollut. Bull., 42, 852-863.
- C'est précisément à cause de cette absence générale de sélectivité isotopique significative que les radionucléides artificiels sont de bons traceurs pour l'étude des processus biologiques.
- Alpen E.L. (1990). Radiation Biophysics. Academic Press, New York, 517 p.
- C'est pour cette même raison que l'eau lourde est un toxique chimique à forte concentration, alors que l'eau ne l'est évidemment pas
- Même pour des molécules aussi simples que l'eau, le facteur de séparation pour la distillation de l'eau lourde n'est que de 1,053 à 50 °C. Des facteurs de séparation plus notables ne sont observés pour les isotopes de l'hydrogène que sur les échanges chimiques avec la forme gazeuse, par exemple l'équilibre NH3 / H2 qui présente un facteur de séparation de 6 pour le deutérium, ou la conversion spontanée du tritium en eau tritiée).
- Livre blanc sur le tritium, p. 44
- Fiche "Radionucléide ; Tritium et environnement, produite par l'IRSN en 2001 (voir page 10 et 11 sur 15)
- F. Paquet et H. Métivier Les risques liés aux expositions au tritium sont-ils sous-évalués ? ; Radioprotection 2008, Vol. 43, n° 2, pages 193 à 201 DOI:10.1051/radiopro:2008015
- Strack S, Kirchmann R, Luttke A et Bonotto S (1983). Selective accumulation of organically bound tritium in the marine unicellular algae Dunaliella bioculata & Acetabularia mediterranea. Int J Appl Radiat Isot, 34(5): 865-869. Cité par la fiche de l'IRSN sur le Tritium
- (TLE3H: 11,5 keV/μm / TLEα= 80 keV/μm)
- D. Goodhead
- Guétat, P., Douche, C., Hubinois, J.C., 2008a. Le tritium et l’environnement : sources, mesures et transferts. Radioprotection, 43 (4): 547-569
- CEA, fiche sur le tritium.
- Colloque A.N.C.L.I. ; 4-5 novembre 2008, Orsay « Les risques sanitaires de l'exposition au tritium: conclusions du séminaire scientifique des experts "article 31" Euratom (qui assiste la Commission européenne dans la préparation des Normes de radioprotection et directives européennes concernées)» (voir notamment diapositive n° 10). Voir aussi les actes des séminaires RIHSS sur le site de la CE
- Livre blanc du tritium, Autorité de sûreté nucléaire, 2010/07/08
- Le Tritium : un risque sous-estimé, 'in' le livre blanc du tritium.
- Au sens du décret 66-450 de 1966 modifié par le décret 88-521-1988.
- Rapport L’évolution de la recherche sur la gestion des déchets nucléaires à haute activité (Tome II)
- Gulden, W., Raskob, W., 2005. Environmental release targets for fusion power plants. Fusion engineering and Design, 75-79: 1211-1216.
- Boyer C., Vichot L., Fromm M., Losset Y., Tatin-Froux F., Guétat P., Badot P.M., Tritium in plants: a review of the current knowledge, Environmental and Experimental Botany Volume 67, Issue 1, Novembre 2009, p. 34-51
- Vichot L., Boyer C., Boissieux T., Losset Y., Pierrat D., Organically bound tritium (OBT) for various plants in the vicinity of a continuous atmospheric tritium release, Journal of Environmental Radioactivity, Volume 99, Issue 10, October 2008, p. 1636-1643
- Choi, Y.H., Lim, K.M., Lee, W.Y., Park, H.G., Choi, G.S., Keum, D.K., Lee, H., Kim, S.B., Lee, C.W., 2005. Tritium levels in Chinese cabbage and radish plants acutely exposed to HTO vapor at different growth stages. Journal of Environmental Radioactivity, 84: 79-94
- Choi, Y.H., Kim, K.M., Park, H.K., Lee, W.Y., 2000. Incorporation into organically bound tritium and the underground distribution of HTO applied to a simulated rice field. Journal of Environmental Radioactivity, 47: 279-290
- Choi, Y.H., Lim, K.M., Lee, W.Y., Diabaté, S., Strack, S., 2002. Tissue free water tritium and organically bound tritium in the rice plant acutely exposed to atmospheric HTO vapour under semi-outdoor conditions. Journal of environmental Radioactivity. 58: 67-85.
- Vichot L., Boyer C., Boissieux T., Losset Y., Pierrat D., Organically-bound tritium in the environment: first investigation of environmental survey in the vicinity of a French research centre, Fusion Science and Technology, Volume 54, Issue 1, July 2008, p. 253- 256 (Résumé) ; doi:10.1016/j.jenvrad.2008.05.004
- Cécile Boyer Résumé, et thèse« Étude des transferts du tritium atmosphérique chez la laitue: étude cinétique, état d'équilibre et intégration du tritium sous forme organique lors d'une exposition atmosphérique continue] », Thèse en Sciences de la vie et de l'environnement, Universite de Franche-Comté, UFR Sciences et Techniques, 2009, 312 p.
- Galeriu, D., Davis, P., Raskob, W., Melintescu, A., 2008. Recent progresses in tritium radioecology and dosimetry. Fusion Science and Technology, 54 (1): 237-242.
- Belot Y, Roy M et Metivier H, Le tritium, de l'Environnement à l'Homme., Éditions de Physique, Paris, 1996.
- Daillant, O., Boilley, D., Gerzabek, M., Porstendörfer, J., Tesch, R., 2004a. Metabolised tritium and radiocarbon in lichens and their use as biomonitors. Journal of Atmospheric Chemistry, 49: 329-341 ; doi:10.1007/s10874-004-1245-4
- Olivier Daillant, David Boilley, Martin Gerzabek, Justin Porstendörfer et Roland Tesch, Metabolised Tritium and Radiocarbon in Lichens and Their Use as Biomonitors, Journal of Atmospheric Chemistry, Éditeur : Springer Netherlands, ISSN:0167-7764 (Print) ISSN:1573-0662 (Online), vol. 49, Numbers 1-3 / novembre 2004, DOI:10.1007/s10874-004-1245-4, p. 329 à 341
- Source : ASN, conférence de presse
- Le Guen, B., 2008. Impact du tritium autour des centrales nucléaires EDF. Radioprotection, 43 (2): 177-191.
Liens internes
Liens externes
- Livre blanc du tritium, Autorité de sûreté nucléaire, juillet 2010.
- Fiche de synthèse du CEA sur la radiotoxicité du tritium.
- Guide pratique radioprotection du tritium
- Graphe de retombées de tritium liées aux essais nucléaires atmosphériques des années 1950-60, et idem pour le canada
- (en)[PDF] Review of Risks from Tritium, report of the independent advisory group on ionising radiation to the Health Protection Agency. November 2007.
Catégories :- Radioisotope
- Matériau nucléaire
- Fusion nucléaire
- Déchet radioactif
- Toxicologie
- Écotoxicologie
Wikimedia Foundation. 2010.