- Rayon Atomique
-
Rayon atomique
Le rayon atomique est une longueur qui caractérise le volume occupé par le nuage électronique d'un atome. Il peut être défini de plusieurs façons selon le contexte.
Sommaire
Définitions et méthodes de calcul du rayon atomique
Dans un solide
On défini le rayon atomique comme la moitié de la distance qui sépare les noyaux de deux atomes contigus dans un solide ou dans une molécule. La formule pour déterminer le rayon atomique est
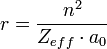
Où: n est le nombre quantique principal de la couche de valence, Zeff désigne la charge effective du noyau et a0 le rayon de l’atome de Bohr qui sert ici de référence pour le calcul et qui équivaut à 0,0529 nm.
Dans des atomes impliqués dans une liaison chimique
Si une liaison covalente est formée entre deux non-métaux, il sera question d’un type spécifique de rayon atomique nommé rayon covalent. Si une liaison métallique est formée entre deux métaux, il sera question d’un type spécifique de rayon atomique nommé rayon métallique.
Cette longueur, mesurée à l'aide d'un diffractomètre à rayons X, permet de déterminer de manière approximative la taille d'un atome, même si les nuages d'électrons des deux atomes se mélangent.
Comparaisons d'évolution suivant les propriétés du nuage électronique
Lorsqu'on compare des atomes isovalents, si les électrons se situent tous sur la même couche chez chaque atome, l'atome ayant le plus de protons (donc le plus lourd) sera le plus petit puisque l'attraction est plus grande.
Lorsqu'on compare des atomes isoélectroniques, la même logique s'applique, l'atome ayant le plus de protons aura le plus petit rayon atomique puisque le noyau exercera une plus grande attraction sur les électrons.
Lorsqu'on compare des atomes isoprotoniques, il faut regarder le nombre d'électrons. Moins il y a d'électrons dans l'atome, plus la force d'attraction du noyau exercée sur chacun sera grande et plus le rayon atomique sera petit.
Évolutions au sein du tableau périodique
Dans un tableau périodique, plus on va vers la droite sur une même période, plus le rayon atomique sera petit. Cette propriété périodique est directement reliée à l’augmentation de la charge effective car, lors du déplacement de gauche vers la droite sur une période, le nombre de protons et d’électrons de valence augmentent, mais l’effet d’écran causé par les électrons internes reste sensiblement le même. Cette croissance traduit une augmentation de l’attraction entre le noyau et les électrons de valence et donc à une diminution de la distance entre les noyaux des deux atomes.
Plus on va vers le bas sur une même colonne, plus le rayon atomique sera grand. L’explication de cette tendance périodique est relativement simple: le nombre quantique principal n, porté au carré, augmente plus rapidement que le Zeff dans la formule du rayon atomique. En termes physiques, ceci signifie que de haut en bas dans une famille, le nombre de protons et le nombre d’électrons internes augmentent, mais le nombre d’électrons de valence reste constant. L’effet d’écran est donc de plus en plus important et les électrons de valences sont moins fortement retenus par le noyau. L’augmentation du rayon atomique est alors causée par une « dilatation du nuage électronique ».
Notes et références
Annexes
Articles connexes
Liens externes
Bibliographie
- P. Atkins et L. Jones, Chimie Générale: Molécules, Matière, Métamorphoses, Éditions De Boeck Université, 1998.
- J. L. Rosenberg, Chimie Générale – Cours et Problèmes, McGraw-Hill, 1984.
- S. S. Zumdahl, Chimie Générale, éditions CEC inc, 1998.
- Portail de la chimie
- Portail de la physique
Catégories : Propriété chimique | Atome
Wikimedia Foundation. 2010.
