- Cesium
-
Césium
 Pour les articles homonymes, voir Cs.
Pour les articles homonymes, voir Cs.Le césium est un élément chimique de symbole Cs et de numéro atomique 55.
C'est un métal alcalin argent-doré dont le point de fusion est suffisamment proche de la température ambiante (CATP) pour qu'il soit possible de l'obtenir à l'état liquide à cette température grâce à la surfusion. Il en est de même pour le gallium et le rubidium, le mercure étant le seul métal liquide à CATP.
Sommaire
Histoire
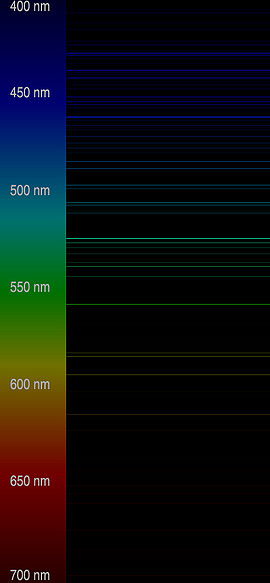
Le nom dérive du latin « caesius », ce qui signifie « bleu ciel », attribué du fait de la couleur bleu clair des deux lignes caractéristiques de son spectre d'émission[1].
La présence du césium a été décelée, quelques mois après la découverte du rubidium - en 1861, par Robert Wilhelm Bunsen et par Gustav Robert Kirchhoff par spectroscopie de la lépidolite.
Isotopes
Article détaillé : césium 137.Le césium naturel est constitué du seul isotope stable 133Cs.
Les déchets radioactifs, les retombées d'essais nucléaires atmosphériques ou de l'accident de Tchernobyl peuvent contenir du césium 135 à très longue période de demi-vie, du césium 134 (demi-vie de 2 ans), ou du césium 137 (demi-vie de 30 ans).
Utilisation
- Horloge atomique : l'isotope stable 133Cs permet d'obtenir une exactitude de 2×10-14 s (soit une seconde sur 1 600 000 ans). La seconde est définie depuis 1967 comme la durée de 9 192 631 770 périodes de la radiation correspondant à la transition entre deux niveaux hyperfins de l'état fondamental de l'atome de césium 133.
- Photomultiplicateurs : ces tubes à vide utilisent l'émission par une photocathode, puis la multiplications d'électrons par une succession d'électrodes (dynodes) - jusqu'à 12 ou 14. La photocathode comprend souvent des composés de césium, notamment dans l'infrarouge. Par rapport aux détecteurs à semi-conducteurs, le photomultiplicateur est beaucoup plus encombrant et délicat à utiliser.
- L'isotope 137Cs est utilisé :
- dans les laboratoires d'étude de la physique, comme source de radioactivité pour les Compteurs de Radioactivité Beta (C.R.A.B.) qui comptent les impulsions correspondant au nombre de désintégrations de noyaux de césium 137, lors d'expériences visant à démontrer l'aspect aléatoire de la désintégration radioactive.
- comme indicateur de retombées d'essais nucléaires, d'accidents de l'industrie nucléaire, dont de fuite des centrales nucléaires ; il a par exemple été libéré, entre autres éléments radioactifs, en quantités importantes lors des essais nucléaires atmosphériques au début des années 1960, puis lors de l'accident de Tchernobyl.
- en médecine, comme source de rayonnement radioactif pour traiter le cancer du col de l'utérus et le cancer de la vessie.
- Le chlorure de césium est désormais utilisé comme remède en médecine alternative. Cette utilisation fait suite à la théorie faisant un lien entre la progression des métastases cancéreuses et le pH intracellulaire. Ainsi, cet élément alcalin pénètre la cellule cancéreuse par la Na+K+ATPase et bloque le glucose tentant d'entrer par la membrane plasmique. La dose journalière est de 0,5 à 3 grammes de chlorure de césium en solution afin de créer l'effet de saturation létal aux cellules fermentatrices cancéreuses.
Comportement du césium dans l'environnement
La cinétique des isotopes du césium (radio-élements) dans l'environnement est étudiée avec intérêt depuis la catastrophe de Tchernobyl.
Le radiocésium est fortement absorbé dans les argiles pures du sol, et donc peu mobile vers les eaux profondes ou superficielles (hormis en présence d'érosion). Il peut être absorbé par les racines et les mycéliums des champignons, dont les champignons à fructification souterraine (truffes, truffe du cerf) qui peuvent le concentrer et le véhiculer via la rhizosphère et les Mycorhizes vers les plantes. L'INRA de Montpellier a tenté de modéliser la circulation du césium via les plantes et le sol dans les années 1990, sur la base de données montrant que le taux et la vitesse d'absorption par les plantes dépendaient des espèces considérées, mais aussi de la concentration en potassium du sol, de la densité racinaire et de la distribution profonde des racines.
La présence de matière organique dans l'argile diminue la fixation du césium dans le sol et favorise son transfert vers la plante (jusqu'à 90 % en plus). Siobhan Staunton de l'INRA (ENSAM) notait néanmoins en 1996[2] qu'une grande part du césium pompé par la plante est excrétée et non transférée vers les parties supérieures. Peu après une pollution de surface, ce sont les plantes à racines superficielles qui sont contaminées, puis 20 ans après en moyenne, ce sont les plantes se nourrissant plus profondément ou certains champignons. On ignore encore si les arbres seront concernés après quelques décennies ou quelques siècles.Cinétique dans l'organisme humain
Sur le long terme, la contamination se fait surtout par ingestion et absorption gastro-intestinale. Le césium est ensuite transporté par le sang et tend à se fixer à la place de son analogue chimique, le potassium.
Toxicité du césium
Pour le 137Cs, les effets des fortes doses ont été étudiés, mais les effets des faibles doses et des expositions chroniques étaient mal documentés. L'étude des conséquences de Tchernobyl a permis de montrer que :
- La charge corporelle en 137Cs est corrélée avec celle de l'alimentation[3].
- En zone contaminée, le lait maternel contient du 137Cs, et celui-ci passe dans le sang et l'organisme du nouveau-né[4]' [5]. En zone contaminée de Biélorussie, la part du 137Cs ingéré par une mère transférée au bébé allaité est d'environ 15 %[6].
- Il existe une corrélation entre charge corporelle en césium et dérèglement de l'immunité humorale et cellulaire, selon une étude portant sur des enfants vivant en zone contaminée[7]. Le césium peut contaminer le lait maternel et avoir des effets délétères chez l'enfant[8].
- Y. I. Bandazhevsky et d'autres ont plusieurs années après l'accident détecté une augmentation des pathologies cardiovasculaires[9].
- Une radiotoxicité est démontrée pour le foie[10] et le rein[11], ce qui explique probablement les troubles du métabolisme de la vitamine D associés à de faibles doses de 137Cs (également observé chez le rat exposé au 137Cs en laboratoire. Ces troubles pourraient augmenter le risque de rachitisme et de défaut de la minéralisation (problèmes osseux, dentaires..)[12]. Chez le rat, alors que les faibles doses semblent sans effet sur le squelette de l'adulte, une contamination in utero des embryons, via une exposition chronique de la mère (à de faibles doses) durant la grossesse semble perturber le métabolisme de la vitamine D, tant au niveau hormonal que moléculaire et contrairement à ce qui avait été observé chez le modèle adulte, des troubles de la calcification du squelette sont observés[13].
Références
- ↑ Image des Raies spectrales d'émission du césium. Voir juste ici à droite :
- ↑ Paris, Le sol, un patrimoine menacé ? Le point scientifique, Congrès : Forum, Paris, 24 octobre 1996
- ↑ Handl, J., D. Beltz, W. Botsch, S. Harb, D. Jakob, R. Michel, and L. D. Romantschuk. 2003. Evaluation of radioactive exposure from 137Cs in contaminated areas of Northern Ukraine. Health Phys 84:502-17
- ↑ Johansson, L., A. Björeland, and G. Agren. 1998. Tranfer of 137Cs to infants via human breast milk. Radiat Prot Dosimetry 79:165-67.
- ↑ Thornberg, C., and S. Mattsson. 2000. Increased 137Cs metabolism during pregnancy. Health Phys 78:502-6.
- ↑ Johansson, L., A. Björeland, and G. Agren. 1998. Tranfer of 137Cs to infants via human breast milk. Radiat Prot Dosimetry 79:165-67.
- ↑ Titov, L. P., G. D. Kharitonic, I. E. Gourmanchuk, and S. I. Ignatenko. 1995. Effects of radiation on the production of immunoglobulins in children subsequent to the Chernobyl disaster. Allergy Proc 16:185-93.
- ↑ Document de 6 pages intitulé "Effets du césium 137 sur le métabolisme de la Vitamine D3 (ou Cholécalciférol) après une contamination chronique via le lait maternel", Emilie Tissandié, 3e année de thèse (Thèse : Effets des radionucléides sur le métabolisme de la vitamine D3 chez le rat)
- ↑ Bandazhevskaya, G. S., V. B. Nesterenko, V. I. Babenko, T. V. Yerkovich, and Y. I. Bandazhevsky. 2004. Relationship between caesium (137Cs) load, cardiovascular symptoms, and source of food in 'Chernobyl' children -- preliminary observations after intake of oral apple pectin. Swiss Med Wkly 134:725-9.
- ↑ Stojadinovic, S., and M. Jovanovic. 1966. Activity of transaminases in the rat serum after internal contamination with 137Cs and 90Sr. Strahlentherapie 131:633-6.
- ↑ Nikula, K. J., B. A. Muggenburg, W. C. Griffith, W. W. Carlton, T. E. Fritz, and B. B. Boecker. 1996. Biological effects of 137CsCl injected in beagle dogs of different ages. Radiat Res 146:536-47.
- ↑ Tissandié, E., Y. Gueguen, J. M. Lobaccaro, J. Aigueperse, P. Gourmelon, F. Paquet, and M. Souidi. 2006a. Chronic contamination with 137Cesium affects Vitamin D3 metabolism in rats. Toxicology 225:75-80.
- ↑ Document déjà cité d'Emilie Tissandié, intitulé "Effets du césium 137 sur le métabolisme de la Vitamine D3 après une contamination chronique via le lait maternel", page 5-6.
Voir aussi
Liens externes
- (en) Réaction d'un mélange de Césium & d'eau en vidéo
- (en) Toxicological Profile for Cesium, ATSDR, U.S. Department of Health and Human Services.
- (en) Images du césium sous différentes formes
Images (le césium et un de ses minerais)
s1 s2 g f1 f2 f3 f4 f5 f6 f7 f8 f9 f10 f11 f12 f13 f14 d1 d2 d3 d4 d5 d6 d7 d8 d9 d10 p1 p2 p3 p4 p5 p6 1 H He 2 Li Be B C N O F Ne 3 Na Mg Al Si P S Cl Ar 4 K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Kr 5 Rb Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te I Xe 6 Cs Ba La Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po At Rn 7 Fr Ra Ac Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Lr Rf Db Sg Bh Hs Mt Ds Rg Cn Uut Uuq Uup Uuh Uus Uuo 8 Uue Ubn * Ute Uqn Uqu Uqb Uqt Uqq Uqp Uqh Uqs Uqo Uqe Upn Upu Upb Upt Upq Upp Uph Ups Upo Upe Uhn Uhu Uhb Uht Uhq Uhp Uhh Uhs Uho ↓ g1 g2 g3 g4 g5 g6 g7 g8 g9 g10 g11 g12 g13 g14 g15 g16 g17 g18 * Ubu Ubb Ubt Ubq Ubp Ubh Ubs Ubo Ube Utn Utu Utb Utt Utq Utp Uth Uts Uto Métalloïdes Non-métaux Halogènes Gaz rares Métaux alcalins Métaux alcalino-terreux Métaux de transition Métaux pauvres Lanthanides Actinides Superactinides Éléments non classés - Portail de la chimie
Catégories : Élément chimique | Métal alcalin
Wikimedia Foundation. 2010.