- L'aluminium
-
Aluminium
L’aluminium est un élément chimique, de symbole Al et de numéro atomique 13. C’est un élément important sur la Terre avec 1,5 % de la masse totale.
C’est un métal argenté et malléable. Il est remarquable pour sa résistance à l’oxydation et sa faible densité.
En fait, il est très oxydable mais à l’air, il se forme une couche de quelques micromètres d’alumine, un oxyde imperméable de formule Al2O3 qui protège le reste du métal et se reforme très rapidement. On parle alors d’une protection cinétique contrairement à la protection thermodynamique car l’aluminium reste très oxydable.
Il est principalement extrait d’un minerai appelé bauxite où il est présent sous forme d’oxyde hydraté dont on extrait l’alumine. Il pourrait également être extrait d’autres minéraux : néphéline, leucite, sillimanite, andalousite, muscovite.
L’aluminium est employé dans beaucoup d’industries pour faire de nombreux produits différents et il est très important pour l’économie mondiale. La Chine est un important pays producteur, devant l’Amérique du Nord (États-Unis et Canada).
Les composants structuraux faits à partir d’aluminium sont essentiels à l’industrie aérospatiale et très importants dans d’autres secteurs du transport et de la construction où sa faible densité, sa longévité et sa résistance sont nécessaires.
Sommaire
Histoire
En 1807, Humphry Davy, après avoir découvert que le sodium et le potassium entraient dans la composition de l’alun, suppose qu’il s’y trouve aussi un autre métal, qu’il baptise « aluminium » (en latin, « alun » se dit alumen). Pierre Berthier découvre dans une mine près des Baux-de-Provence en 1821 un minerai contenant plus de 50 % d’oxyde d’aluminium. Ce minerai sera appelé bauxite.
On attribue généralement la découverte et l’isolement de l’aluminium à Friedrich Wöhler en 1827. Toutefois, deux ans plus tôt, le chimiste et physicien danois Hans Christian Ørsted avait réussi à produire une forme impure du métal. Wöhler fut le premier à mettre en évidence les propriétés chimiques et physiques de l’aluminium, dont la plus notable est la légèreté.
Le chimiste français Henri Sainte-Claire Deville améliore en 1846 la méthode de Wöhler en réduisant le minerai par le sodium. Il publie ses recherches dans un livre en 1856. Cette méthode est utilisée à travers toute l’Europe pour la fabrication de l’aluminium, mais elle reste extrêmement coûteuse. Le métal est d’ailleurs utilisé pour fabriquer des bijoux, dont la valeur sera évidemment réduite à néant quelques décennies plus tard.
- 1855 : Les nouveaux métaux sont exposés à l’exposition universelle de Paris.
- Le premier site industriel producteur d’aluminium au monde s’installe à Salindres dans le Gard, et commence son activité dès 1860.
- 1876 : William Frishmuth réalise la première coulée d’aluminium. En 1884, il réalise la coiffe du Washington Monument en ce métal.
- 1886 : de manière indépendante, Paul Héroult et Charles Martin Hall découvrent une nouvelle méthode de production de l’aluminium en remarquant qu’il est possible de dissoudre l’alumine et de décomposer le mélange par électrolyse (procédé Héroult-Hall) pour donner le métal brut en fusion. Pour cette découverte, Hall obtient un brevet (400655) la même année. Ce procédé permet d’obtenir de l’aluminium de manière relativement économique. La méthode mise au point par Héroult et Hall est toujours utilisée aujourd’hui.
- 1887 : Karl Josef Bayer décrit une méthode connue sous le nom de procédé Bayer pour obtenir de l’alumine à partir de la bauxite. Cette découverte permet de faire entrer l’aluminium dans l’ère de la production de masse.
- 1888 : les premières sociétés de production d’aluminium sont fondées en Suisse, France et aux États-Unis.
Propriétés
Propriétés physiques
L’aluminium est un métal mou, léger, mais résistant avec un aspect argent-gris mat, dû à une mince couche d’oxydation de cinq à dix nanomètres qui se forme rapidement quand on l’expose à l’air et qui empêche la corrosion de progresser dans des conditions normales d’exposition chimiques. Ce film appelé alumine se forme spontanément très rapidement quand l’aluminium est mis en contact avec un milieu oxydant comme l’oxygène de l’air. À la différence de la plupart des métaux, il est utilisable même s’il est oxydé en surface. On peut même dire que sans cette couche d’oxyde, il serait impropre à la plupart de ses applications. Il est possible d’augmenter artificiellement l’épaisseur de cette couche d’oxydation par anodisation, ce qui permet d’augmenter la protection et de décorer les pièces en colorant la couche d’oxyde. Contrairement à l’aluminium qui est un très bon conducteur, l’oxyde d’aluminium est un excellent isolant.
L’aluminium a une densité (2,7) environ trois fois plus faible que celle de l’acier ou du cuivre ; il est malléable, ductile et facilement usiné et moulé. Il possède une excellente résistance à la corrosion et une grande longévité. Il est également non magnétique et ne provoque pas d’étincelles. C’est le deuxième métal le plus malléable et le sixième le plus ductile.
Bombardé par un laser à électrons libres, l’aluminium devient transparent dans les ultraviolets extrêmes[4].
Propriétés chimiques
En solution, l’aluminium se trouve le plus généralement sous la forme d’ions Al3+. Il s’oxyde lentement à froid et rapidement à chaud pour former l’alumine Al2O3. L’action des acides sur l’aluminium produit l’ion cité plus haut.
La réaction de Al avec NaOH produit de l’aluminate hydraté de sodium NaAl(OH)4 et du gaz dihydrogène H2, selon l’équation :
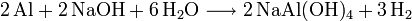
Les hydroxydes d’aluminium s’obtiennent en général en précipitant une solution contenant des cations Al3+ à l’aide d’une base. Cette méthode permet de former selon les conditions de précipitation différentes phases cristallographiques tel que la bayerite, la boehmite, la gibbsite.
L’aluminium est aussi utilisé en tant que réducteur fort, notamment en pyrotechnie. Par exemple pour l’Aluminothermie, ou pour les feux d’artifices, où il joue un rôle similaire au magnésium, à moindre coût et avec une puissance plus grande.
Toxicologie
L’aluminium est reconnu pour ses effets néfastes à haute dose sur le système nerveux (il est cependant un oligo-élément essentiel, sa carence entraînant un retard intellectuel). Des personnes exposées à des taux élevés d’aluminium (suite à une ou plusieurs vaccinations[5],[6] ou un traitement de dialyse) peuvent développer des complications au niveau du système nerveux central, l’encéphalopathie, l’épilepsie et des troubles de mémoire. L’accumulation d’aluminium dans l’organisme peut aussi jouer un rôle dans d’autres maux comme le psoriasis, les insuffisances hépatorénales chroniques, l’anémie, l’ostéomalacie (os cassants ou mous), l’intolérance au glucose et les arrêts cardiaques chez les humains. Les cellules du cerveau des patients atteints d’Alzheimer contiennent de 10 à 30 fois plus d’aluminium que la normale[7]. L’Institut de la Veille sanitaire a réalisé en 2003 une étude poussée qui montre le manque de données suffisantes pour confirmer ou infirmer les conséquences de l’aluminium sur la santé. Les études ont porté surtout sur la qualité des eaux utilisées pour la boisson, mais pas sur les effets des emballages en aluminium[8].
On peut trouver de l’aluminium dans les aliments, l’eau, les déodorants, les vaccins et les médicaments. Les ustensiles de cuisine et le papier d’aluminium peuvent également en libérer (en quantité généralement négligeable) dans les aliments. C’est pourquoi son utilisation dans la fabrication de conduites d’eau est prohibée dans plusieurs pays.
 Une des premières statues coulées en aluminium (1893), l’Ange de la charité chrétienne souvent appelé Eros trônant sur le Shaftesbury Memorial situé à Piccadilly Circus, à Londres
Une des premières statues coulées en aluminium (1893), l’Ange de la charité chrétienne souvent appelé Eros trônant sur le Shaftesbury Memorial situé à Piccadilly Circus, à Londres
 Lingot d’aluminium
Lingot d’aluminium
Alliages remarquables et utilisations
En tonnage et en valeur, l’aluminium est le métal le plus utilisé après le fer, grâce à sa légèreté et sa bonne conductivité électrique et thermique. L’aluminium pur est mou et fragile, mais avec des petites quantités de cuivre, magnésium, manganèse, silicium et d’autres éléments, il peut former des alliages aux propriétés variées.
Parmi les secteurs utilisant l’aluminium, on peut citer :
- les transports (automobiles, avions, camions, trains, bateaux, etc.) ;
- l’emballage (boîtes de conserve, papier aluminium, canettes, barquettes, aérosols, etc.) et notamment les emballages alimentaires ;
- la construction (fenêtres, portes, gouttières, etc.) ;
- les biens de consommation (appareils, ustensiles de cuisine etc.) ;
- les fils électriques (la conductivité de l’aluminium ne représente que 60 % de celle du cuivre, mais l’aluminium est plus léger et moins cher) ;
- de l’aluminium très pur (99,980 à 99,999 %) est employé en électronique et pour les CD.
Outil de datation
- En géomorphologie et paléosismologie, l’isotope 26Al, créé par les rayons cosmiques, est utilisé pour la datation par isotopes cosmogéniques de surfaces ou la détermination de taux d’érosion.
- Le système solaire provient d'une nébuleuse où le 26 AL était autrefois réparti de manière homogène (à ± 10% ; ceci est démontré par l'analyse des chondres des météorites les plus anciennes). Il se désintègre en magnésium avec une demie-vie de 0,73 millions d'années, ce qui constitue un étalon pour évaluer la date de formation des premiers solides du systèmes solaire[9]. Ceci pourra aider à mieux connaître le calendrier de la formation des premiers solides du système solaire.
Gisements
L’aluminium est un élément abondant dans la croûte terrestre mais il se trouve rarement sous sa forme pure[10]. C’est le troisième élément le plus abondant dans la croûte terrestre (8 % de la masse) après l’oxygène et le silicium. L’aluminium est très difficile à extraire des roches qui le contiennent et a donc été longtemps très rare et précieux.
Le principal minerai d’aluminium est la bauxite.
Production
Articles détaillés : Extraction de l'alumine, Production de l'aluminium par électrolyse et Liste de producteurs d'aluminium.La bauxite contient de l’alumine (Al2O3), qu’il faut d’abord extraire. Pour cela la bauxite doit être traitée par une solution de soude.
On obtient un précipité de Al(OH)3 qui donne de l’alumine par chauffage. L’aluminium est extrait par électrolyse : l’alumine est introduite dans des cuves d’électrolyse avec des additifs comme la cryolithe (Na3AlF6), le fluorure de calcium (CaF2), le fluorure de lithium et d’aluminium (Li3AlF6) et le fluorure d’aluminium (AlF3) afin d’abaisser le point de fusion de 2 040 °C à 960 °C.
La production d’une tonne d’aluminium nécessite de quatre à cinq tonnes de bauxite. Elle nécessite entre 13 000 et 17 000 kWh (entre 47 et 61 GJ). Lors de l’électrolyse, sont émis des gaz tels que du dioxyde de carbone, (CO2), du monoxyde de carbone (CO), des hydrocarbures aromatiques polycycliques (HAP), et des fluorures gazeux. Dans les meilleures usines, le monoxyde de carbone (CO) et les hydrocarbures aromatiques polycycliques (HAP) sont brulés ou recyclés comme source de carbone, et les fluorures sont retournés dans le bain d’électrolyse.
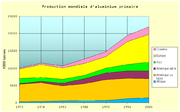
Statistiques de production[11]
La production mondiale d’aluminium secondaire à partir du recyclage s’est élevée à 7,6 Mt en 2005, soit 20 % de la production totale de ce métal.
Année Afrique Amérique
du NordAmérique
latineAsie Europe
et RussieOcéanie Total 1973 249 5 039 229 1 439 2 757 324 10 037 1978 336 5 409 413 1 126 3 730 414 11 428 1982 501 4 343 795 1 103 3 306 548 10 496 1987 572 4 889 1 486 927 3 462 1 273 12 604 1992 617 6 016 1 949 1 379 3 319 1 483 14 763 1997 1 106 5 930 2 116 1 910 6 613 1 804 19 479 2003 1 428 5 945 2 275 2 457 8 064 2 198 21 935 2004 1 711 5 110 2 356 2 735 8 433 2 246 22 591 Production d’aluminium en milliers de tonnes Recyclage
L’aluminium a une excellente recyclabilité. Pour recycler l’aluminium, on le fait simplement fondre. En plus des bénéfices environnementaux, le recyclage de l’aluminium est beaucoup moins coûteux que l’extraction à partir du minerai de bauxite. Il nécessite 95 % d’énergie en moins et une tonne d’aluminium recyclé permet d’économiser quatre tonnes de bauxite. En sautant l’étape de l’électrolyse, qui réclame beaucoup d’énergie, on évite les rejets polluants qui lui sont associés. L’aluminium est quasi recyclable à l’infini sans perdre ses qualités, à condition de ne pas fondre dans un même bain des alliages de composition différente.
Le recyclage de l’aluminium est pratiqué depuis les années 1900 et ne cesse de progresser : dans la consommation d’aluminium en Europe, la part d’origine recyclage est passée de 50 % en 1980 à plus de 70 % en 2000. Il existe différentes filières industrielles de récupération de l’aluminium. En France, l’aluminium ménager est récupéré avec les emballages dans le cadre du tri sélectif. Dans les centres de tri, l’aluminium est trié manuellement ou plus couramment grâce à des machines de tri par courants de Foucault. Il est ensuite broyé avant d’être refondu par des affineurs d’aluminium pour redonner du métal utilisable, appelé aluminium de seconde fusion. L’aluminium de seconde fusion est utilisé essentiellement pour la fabrication de pièces de fonderie pour l’automobile (blocs moteur, culasses, pistons, etc.)
Après la Seconde Guerre mondiale la pénurie a conduit à refondre des alliages d’aluminium pour en faire des pièces n’exigeant pas de caractéristiques mécaniques précises, et en particulier des ustensiles de cuisine. La composition des alliages obtenus n’était pas appréciée des fondeurs qui les qualifiaient de « cochonium ». Les casseroles ainsi réalisées se piquaient (corrosion par piqûre), sous l’effet de l’acidité des aliments. Les conséquences d’une alimentation polluée ont déjà été évoquées.
Dans certains pays en voie de développement, le recyclage non contrôlé de matières à base d’aluminium conduit encore de nos jours à réaliser des ustensiles alimentaires avec des teneurs en éléments nocifs (nickel, cuivre, etc.).
Néanmoins, le recyclage des alliages d’aluminium, effectué sérieusement, avec un contrôle précis de la composition, donne d’excellents résultats.
Les cinq premiers producteurs mondiaux
Les cinq principaux producteurs mondiaux sont, et en 2006[12] :
Pollution
Deux types de pollutions sont engendrées par la production de l’aluminium :
- – une pollution fluorée lors de la transformation de l’alumine en aluminium ;
- – des rejets gazeux au-dessus des cuves d’électrolyse doivent être captés.
Notes et références
- ↑ a , b et c ALUMINIUM EN POUDRE, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- ↑ ESIS. Consulté le 1 février 2009
- ↑ Numéro index dans le tableau 3.1 de l’annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- ↑ L'aluminium peut devenir transparent aux ultraviolets, 2 août 2009 (ref. Nature Physics ?)
- ↑ Vaccine Ingredients
- ↑ CANV - Composition des vaccins
- ↑ HARRINGTON CR et col. « Alzheimer’s disease-like changes. » Lancet 1994-343-993, 7
- ↑ IVS, 2003, Aluminium - Quels risques pour la santé ?
- ↑ Villeneuve, Johan; Chaussidon, Marc; Libourel, Guy ; « Homogeneous Distribution of 26Al in the Solar System from the Mg Isotopic Composition of Chondrules » ; Revue Science, Volume 325, Issue 5943, pp. 985- (2009) (En savoir plus)
- ↑ Photo d’un fragment naturel de roche contenant de l’aluminium
- ↑ (en) International Aluminium Institute
- ↑ Les Échos, 24 décembre 2007, p. 26.
Voir aussi
Articles connexes
- Métallurgie extractive de l’aluminium
- Alliage d’aluminium
- Transformation de l’aluminium
- Fonderie d’aluminium
- Fabrication des feuilles et bandes d’aluminium
- Fabrication de semi-produits en alliage d’aluminium : tôles, profilés et pièces de fonderie.
Liens externes
- Alu-Scout - La plateforme interactive d`information et d’échange du domaine de l`aluminium
- Micrographies comparant la surface brillante et la surface mate du papier aluminium
- aluMATTER - un site web librement accessible qui vise à fournir des outils de formation en ligne innovants et interactifs relatifs à la science et aux technologies de l’aluminium
- Site de l’Institut pour l’histoire de l’aluminium (IHA).
- un dossier pluridisciplinaire sur l’aluminium
- Caractérisation de l’aluminium par Henri Sainte-Claire Deville (1854), article analysé sur le site BibNum.
- Le brevet Héroult d’électrolyse de l’aluminium (1886) en ligne et analysé sur le site BibNum.
- (en) Institut international de l’aluminium, avec données mensuelle de production par zone géographique.
s1 s2 g f1 f2 f3 f4 f5 f6 f7 f8 f9 f10 f11 f12 f13 f14 d1 d2 d3 d4 d5 d6 d7 d8 d9 d10 p1 p2 p3 p4 p5 p6 1 H He 2 Li Be B C N O F Ne 3 Na Mg Al Si P S Cl Ar 4 K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Kr 5 Rb Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te I Xe 6 Cs Ba La Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po At Rn 7 Fr Ra Ac Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Lr Rf Db Sg Bh Hs Mt Ds Rg Cn Uut Uuq Uup Uuh Uus Uuo 8 Uue Ubn * Ute Uqn Uqu Uqb Uqt Uqq Uqp Uqh Uqs Uqo Uqe Upn Upu Upb Upt Upq Upp Uph Ups Upo Upe Uhn Uhu Uhb Uht Uhq Uhp Uhh Uhs Uho ↓ g1 g2 g3 g4 g5 g6 g7 g8 g9 g10 g11 g12 g13 g14 g15 g16 g17 g18 * Ubu Ubb Ubt Ubq Ubp Ubh Ubs Ubo Ube Utn Utu Utb Utt Utq Utp Uth Uts Uto Métalloïdes Non-métaux Halogènes Gaz rares Métaux alcalins Métaux alcalino-terreux Métaux de transition Métaux pauvres Lanthanides Actinides Superactinides Éléments non classés - Portail de la chimie
Catégories : Produit chimique facilement inflammable | Aluminium | Colorant alimentaire
Wikimedia Foundation. 2010.