- Acide ribonucléique
-
 « ARN » redirige ici. Pour les autres significations, voir ARN (homonymie).
« ARN » redirige ici. Pour les autres significations, voir ARN (homonymie).L'acide ribonucléique, ou ARN, est une molécule biologique trouvée dans pratiquement tous les organismes vivants, y compris certains virus. L'ARN est une molécule très proche chimiquement de l'ADN et il est d'ailleurs en général synthétisé dans les cellules à partir d'une matrice d'ADN dont il est une copie. Les cellules vivantes utilisent en particulier l'ARN comme un support génétique intermédiaire de nos gènes pour fabriquer les protéines dont elles ont besoin. L'ARN peut remplir de nombreuses autres fonctions et en particulier intervenir dans des réactions chimiques de la cellule.
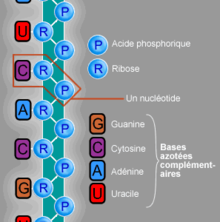
Chimiquement, l'ARN est un polymère linéaire constitué d'un enchaînement de nucléotides. Chaque nucléotide contient un groupement phosphate, un sucre, le ribose et une base azotée. Les nucléotides sont liés les uns aux autres par des liaisons phosphodiester. On trouve quatre bases azotées dans l'ARN, l'adénine, la guanine, la cytosine et l'uracile. L'ARN a de nombreuses similarités avec l'ADN, avec cependant quelques différences importantes : sur le plan de la structure, l'ARN contient un ribose à la place du désoxyribose de l'ADN, ce qui rend l'ARN chimiquement plus instable et la thymine de l'ADN y est remplacée par l'uracile, qui possède les mêmes propriétés d'appariement de base avec l'adénine. Sur le plan fonctionnel, l'ARN est le plus souvent trouvé dans les cellules sous forme de simple brin, tandis que l'ADN est présent sous forme de deux brins complémentaires, formant une double hélice. Enfin les molécules d'ARN trouvées dans les cellules sont plus courtes (de quelques dizaines à quelques milliers de nucléotides) que l'ADN du génome (de quelques millions à quelques milliards de nucléotides).
Dans la cellule, l'ARN est produit par transcription à partir de l'ADN situé dans le noyau. L'ARN est donc une copie d'une région de l'un des brins de l'ADN. Les enzymes qui effectuent cette copie ADN→ARN s'appellent des ARN polymérases. Les ARN ainsi produits peuvent avoir trois grands types de fonctions, ils peuvent être support de l'information génétique d'un ou plusieurs gènes codant pour des protéines (on parle alors d'ARN messagers), ils peuvent adopter une structure secondaire et tertiaire stable et accomplir des fonctions catalytiques (par exemple l'ARN ribosomique), ils peuvent enfin servir de guide ou de matrice pour des fonctions catalytiques accomplies par des facteurs protéiques comme c'est le cas par exemple des microARN.
Sommaire
Structure de l'ARN
Article détaillé : Structure de l'ARN.Ribonucléotides
Structure chimique
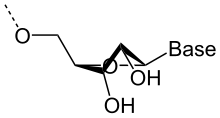
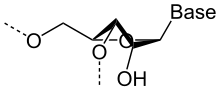
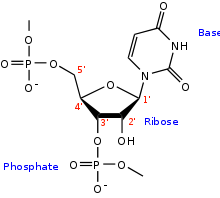 Structure d'un brin d'ARN. Les atomes du ribose sont numérotés. La base représentée est l'uracile, qui n'est présente naturellement que dans l'ARN, à la place de la thymine, présente dans l'ADN.
Structure d'un brin d'ARN. Les atomes du ribose sont numérotés. La base représentée est l'uracile, qui n'est présente naturellement que dans l'ARN, à la place de la thymine, présente dans l'ADN.
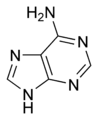
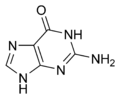
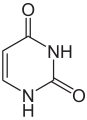
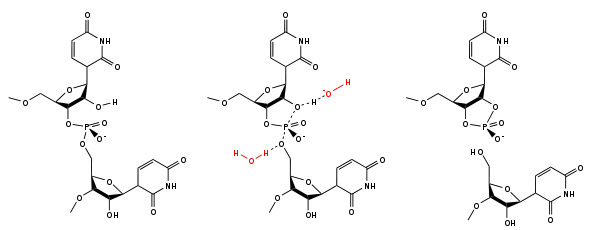
L'ARN est un acide nucléique, c'est-à-dire une molécule constituée d'un enchaînement de nucléotides. Chaque nucléotide de l'ARN est constitué d'un pentose, le ribose, dont les atomes de carbone sont numérotés de 1' à 5', d'une base azotée et d'un groupement phosphate. La base azotée est reliée par un atome d'azote au carbone 1' du ribose. Les nucléotides sont liés les uns aux autres par des groupements phosphate, par l'intermédiaire de liaisons phosphodiester au niveau des carbones 3' et 5'. L'ARN possède quatre bases azotées différentes : l'adénine (notée A), l'uracile (noté U), la cytosine (notée C) et la guanine (notée G). La thymine de l'ADN est remplacée par l'uracile dans l'ARN[2]. La différence entre ces deux bases est le remplacement d'un groupement méthyle en position 5 de la thymine par un hydrogène dans l'uracile. Cette modification de structure ne change pas les propriétés d'appariement avec l'adénine[3],[4].
Stéréochimie
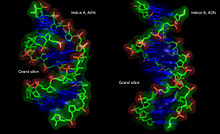
Sur le plan structural, la présence d'un oxygène sur la position 2' du ribose influence la conformation du cycle furanose du ribose. Ce cycle à cinq atomes n'est pas plan, ce qui conduit à deux conformères principaux du sucre, appelés C2'-endo ou C3'-endo. Dans l'ARN qui comporte un oxygène en position 2', la position C3'-endo est privilégiée[5], ce qui modifie profondément la structure des doubles hélices comportant des brins ARN. Ces duplex d'ARN forment une hélice de type A, différente de celle qui est observée de façon majoritaire dans l'ADN classique qui est une hélice de type B, où le désoxyribose est en conformation C2'-endo[6].
Double hélice d'ARN
L'hélice de type A qu'adopte l'ARN lorsqu'il forme un duplex, a des propriétés géométriques assez différentes de celles de l'hélice de type B. Tout d'abord le nombre de paires de bases par tour d'hélice est de 11 au lieu de 10 pour l'ADN en forme B. Le plan des paires de bases n'est plus perpendiculaire à l'axe de l'hélice, mais forme un angle d'environ 75 degrés avec celui-ci[9],[10]. Il en résulte un déplacement de l'axe de l'hélice qui ne passe plus par le centre de l'appariement des bases, mais à l'intérieur du grand sillon. Ceci induit une augmentation du diamètre de l'hélice qui passe d'environ 20 Å pour l'ADN en forme B à environ 26 Å pour l'ARN en forme A[11]. Enfin, la géométrie des deux sillons est profondément affectée : le petit sillon devient très accessible, tandis que le grand sillon devient très profond, étroit et pincé. Ceci a un impact sur la manière dont l'ARN en duplex apparié peut interagir avec des protéines, car l'étroitesse du grand sillon est une barrière à l'accessibilité de ligands protéiques[12].
Structure in vivo
La plupart des ARN naturels sont présents sous forme simple brin dans la cellule, contrairement à l'ADN qui est sous forme d'un double-brin apparié[2]. Les ARN simple brin se replient le plus souvent sur eux-mêmes, formant une structure intramoléculaire qui peut être très stable et très compacte. La base de cette structure est la formation d'appariements internes, entre bases complémentaires (A avec U, G avec C et, parfois, G avec U). La description des appariements internes entre les bases d'un ARN s'appelle la structure secondaire. Cette structure secondaire peut être complétée par des interactions à longue distance qui définissent alors une structure tridimensionnelle ou structure tertiaire.
La formation de la structure des ARN est très souvent dépendante des conditions physico-chimiques environnantes et en particulier de la présence de cations divalents, comme le magnésium Mg2+, dans la solution. Ces cations interagissent avec les groupements phosphate du squelette et stabilisent la structure, en particulier en faisant écran à la répulsion électrostatique entre les charges négatives de ces phosphates[13].
L'existence de structure tertiaire dans les ARN est à la base de la richesse de ses fonctions et en particulier de sa capacité à catalyser des réactions chimiques (ribozymes).
Structure secondaire
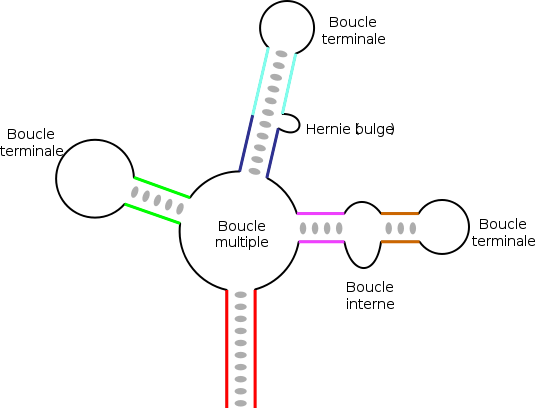
La structure secondaire d'un ARN est la description de l'ensemble des appariements internes au sein d'une molécule simple brin[14]. Cet ensemble d'appariements induit une topologie particulière, composée de régions en hélice (tiges) et de régions non-appariées (boucles). Par extension, la structure secondaire recouvre également la description de cette topologie.
L'élément moteur de la formation de structures secondaires au sein d'un ARN simple brin est l'existence de régions contenant des séquences répétées inversées, qui peuvent s'apparier pour former localement une structure en double hélice. Par exemple, si l'ARN contient les deux séquences suivantes : --GUGCCACG----CGUGGCAC--, celles-ci forment un motif répété inversé, les nucléotides du second segment étant les complémentaires de ceux du premier, après inversion de leur sens de lecture. Ces deux segments peuvent donc s'apparier de manière antiparallèle pour former une région localement en duplex. La région entre les deux segments forme alors une boucle reliant les deux brins du duplex. On parle alors de structure en tige et boucle ou en « épingle à cheveux ».
Dans des ARN de longueur plus importante, il peut exister des structures plus complexes qui résultent de l'appariement de plusieurs régions complémentaires ou séquences répétées inversées. En fonction de la manière dont sont « emboîtées » ces différentes régions, on obtient des éléments topologiques variés, avec des tiges ou régions appariées, et divers types de boucles[15] :
- les boucles terminales, situées à l'extrémité d'une tige ;
- les boucles internes, qui connectent deux tiges ;
- les boucles multiples, qui connectent trois tiges ou plus et constituent des points de branchement de la structure ;
- les hernies (en anglais bulge), ou boucles latérales, qui sont sur un seul des deux brins d'une hélice. La continuité de l'hélice n'est en général pas affectée et les bases restent empilées de manière coaxiale, de part et d'autre de la hernie.
Il n'existe pas toujours une structure unique stable pour une séquence donnée et il arrive que certains ARN puissent adopter plusieurs conformations alternatives en fonction de la liaison d'un ligand (protéine, petite molécule…) ou des conditions physico-chimiques (force ionique, pH). On peut en général suivre la formation ou la fusion de la structure secondaire d'un ARN par des mesures spectroscopiques. Ainsi, par exemple, l'absorption dans l'ultraviolet des bases de l'ARN est plus importante à l'état déplié qu'à l'état replié (phénomène d'hyperchromicité)[16].
Structure tertiaire
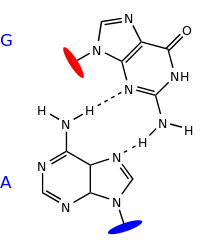 Exemple d'appariement non canonique : la paire G:A en cisaille (sheared). Celle-ci est par exemple présente dans la structure de l'ARN ribosomique 5S.
Exemple d'appariement non canonique : la paire G:A en cisaille (sheared). Celle-ci est par exemple présente dans la structure de l'ARN ribosomique 5S.
Appariements non canoniques
Au-delà de la topologie des boucles et des hélices composées de paires de bases standard, un ARN peut adopter une structure tridimensionnelle compacte, ou structure tertiaire, comme une protéine. À l'intérieur de cette structure, les hélices canoniques sont complétées par des appariements non canoniques, c'est-à-dire distincts des appariements classiques, de type Watson-Crick (A-U et G-C) et bancals (wobble, G-U). On a observé une grande variété de ces appariements dans les structures tridimensionnelles d'ARN résolues par cristallographie ou par résonance magnétique nucléaire. On trouve par exemple des appariements Hoogsteen[17] et des appariements « en cisaille » (sheared)[18]. Il existe également des interactions base-ribose, notamment avec le 2'-hydroxyle, qui peut former des liaisons hydrogènes. Une nomenclature systématique de toutes ces interactions a été proposée par Eric Westhof et ses collaborateurs[19]. Plus de 150 types d'appariements ont été observés et ont été regroupés en douze grandes familles. Ces appariements non canoniques impliquent toujours des liaisons hydrogènes entre les bases, qui sont coplanaires, comme dans les paires Watson-Crick.
Interactions à longue distance
Des appariements canoniques ou non canoniques peuvent intervenir entre des régions distantes de la structure secondaire, souvent localisées dans des boucles, ce qui permet de stabiliser un repliement compact de la structure.
Parmi ces interactions non canoniques à longue distance figurent :
- les pseudonœuds, structures formées par l'interaction d'une boucle avec une région située à l'extérieur de la tige qui la délimite[20] ;
- les triplex de brin, qui surviennent lorsqu'une région simple brin vient s'insérer dans le grand sillon d'une région en hélice ;
- les interactions tétraboucle-récepteur : interactions entre boucles hyperstables de quatre nucléotides (tétraboucles) et structures en duplex ou quasi-duplex[21].
Similitudes et différences entre l'ADN et ARN
Les principales différences entre les deux molécules sont que :
- l'ARN a pour composant un sucre ribose là où l'ADN a un désoxyribose ;
- la base uracile a un rôle pour l'ARN qui est rempli par la thymine dans l'ADN ;
- l'ARN existe généralement sous la forme d'un simple brin (monocaténaire), sauf chez quelques virus comme les reovirus[22], tandis que l'ADN est double brin (bicaténaire) avec une structure en double hélice ;
- l'ARN est court : de quelques dizaines à quelques milliers de nucléotides pour les ARN cellulaires (ARNm ou ARN structurés), contre quelques millions à quelques centaines de millions dans l'ADN qui constitue le génome de la cellule.
Les trois premières différences donnent à l'ARN une stabilité bien moindre que celle de l'ADN :
- le ribose possède un groupement hydroxyle en position 2', qui est absent dans le désoxyribose de l'ADN. Cette fonction 2'-OH a des incidences multiples sur la structure de l'ARN. Tout d'abord sur le plan chimique, cette fonction alcool rend l'ARN sensible à l'hydrolyse alcaline. La présence des deux oxygènes en cis sur les positions 2' et 3' rend possible la cyclisation du phosphate sur les positions 2' et 3', qui se produit très rapidement lorsqu'une base vient arracher le proton du 2'-OH. Cette cyclisation du nucléotide provoque une coupure de la chaîne ribose-phosphate et libère des extrémités 5'-OH et 2', 3' phosphate cyclique[23] ;
- l'uracile est moins coûteux énergétiquement à produire pour les organismes vivants que la thymine, puisqu'il nécessite une étape de synthèse de moins, qu'est la méthylation par la thymidylate synthase. La présence de thymine dans l'ADN permet à la cellule de détecter des lésions spontanées de la cytosine qui est sensible à l'oxydation. La désamination spontanée de la cytosine en présence d'oxygène convertit cette dernière en uracile. La présence de désoxyuracile dans l'ADN est anormale, puisque le désoxyribonucléotide complémentaire du A est la thymidine. Grâce à cette distinction thymine/uracile, la machinerie de réparation par excision de base peut détecter et corriger le défaut. Dans l'ARN, la désamination des cytosines produit des uraciles et n'est pas réparée. L'ARN a une durée de vie beaucoup plus courte que celle de l'ADN, il est dégradé et recyclé ;
- si un brin d'ARN monocaténaire est endommagé, la lésion n'est pas réparée et le dommage est irréversible ; en revanche, si un des deux brins d'ADN est endommagé, la cellule peut utiliser l'information portée par le brin complémentaire intact pour réparer la lésion.
D'un point de vue évolutif, certains éléments permettent de penser que l'ARN serait antérieur à l'ADN comme support de l'information génétique, ce qui expliquerait ses fonctions plus étendues et sa généralisation. L'ADN serait apparu plus tard et n'aurait supplanté l'ARN que pour le rôle de stockage à long terme, en raison de sa plus grande stabilité[24].
Synthèse de l'ARN à partir de l'ADN
Article détaillé : Transcription (biologie).Article connexe : ARN polymérase.La synthèse d'une molécule d'ARN à partir de l'ADN s'appelle la transcription. C'est un processus complexe qui fait intervenir une enzyme de la famille des ARN polymérases ainsi que des protéines associées. Les différentes étapes de cette synthèse sont l'initiation, l'élongation et la terminaison. Le processus de synthèse des ARN est sensiblement différent chez les organismes procaryotes et chez les cellules eucaryotes[25]. Enfin, après la synthèse proprement dite, l'ARN peut subir un processus de maturation, qui conduit à la modification de la séquence et/ou de la structure chimique de l'ARN (voir plus bas).
Initiation
Le démarrage de la transcription d'un ARN par une ARN polymérase s'effectue au niveau d'une séquence spécifique sur l'ADN, appelée promoteur. Ce promoteur comporte un ou plusieurs éléments de séquence conservés[26] sur lesquels se fixent en général des protéines spécifiques, les facteurs de transcription. Juste en amont du site de démarrage de la transcription, l'élément proximal est en général riche en nucléotides T et A, appelé boîte TATA[27] chez les eucaryotes ou boîte de Pribnow chez les bactéries[28]. Les facteurs de transcription favorisent le recrutement de l'ARN polymérase sur le promoteur et l'ouverture du duplex d'ADN. Il se forme alors ce qu'on appelle une « bulle de transcription » avec l'ADN ouvert, dont l'un des brins (la matrice) est hybridé avec l'ARN en cours de synthèse.
Élongation
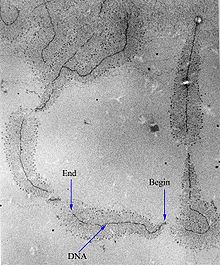 Vue en microscopie électronique des « arbres de Noël » ou « arbres de Miller » produits par la transcription d'un gène actif[29]. Le « tronc » de l'arbre est constitué de l'ADN et les branches sont les différentes molécules d'ARN en cours de synthèse. Celles-ci sont plus courtes vers le début de la région transcrite et plus longues vers la fin.
Vue en microscopie électronique des « arbres de Noël » ou « arbres de Miller » produits par la transcription d'un gène actif[29]. Le « tronc » de l'arbre est constitué de l'ADN et les branches sont les différentes molécules d'ARN en cours de synthèse. Celles-ci sont plus courtes vers le début de la région transcrite et plus longues vers la fin.
Une fois l'ARN polymérase fixée sur le promoteur et la bulle de transcription formée, elle synthétise les premiers nucléotides de manière statique sans quitter la séquence du promoteur. Les facteurs de transcription se détachent et l'ARN polymérase devient processive[30]. Elle transcrit alors l'ARN de 5' vers 3', en utilisant l'un des deux brins de l'ADN comme matrice et des ribonucléotides triphosphates (ATP, GTP, CTP et UTP) comme précurseurs. In vivo, chez Escherichia coli, la vitesse d'allongement de l'ARN polymérase est d'environ 50 à 90 nucléotides par seconde[31].
Terminaison
La terminaison de la transcription de l'ARN procède selon des mécanismes complètement différents chez les bactéries et chez les eucaryotes.
Chez les bactéries, le mécanisme principal de terminaison fait intervenir une structure particulière de l'ARN, le terminateur, composé d'une tige-boucle stable suivie d'une série d'uridines (U). Lorsque l'ARN polymérase synthétise cette séquence, le repliement de la tige d'ARN provoque une pause de la polymérase[32]. L'ARN, qui n'est plus apparié à l'ADN matrice que par une série d'appariements A-U faibles, se détache, sans intervention d'autres facteurs protéiques. La terminaison peut aussi se faire via l'intervention d'un facteur protéique spécifique, le facteur Rho[33].
Chez les eucaryotes, la terminaison de la transcription par l'ARN polymérase II est couplée à la polyadénylation. Deux complexes protéiques, CPSF (Cleavage and Polyadenylation Specificity factor) et CStF (Cleavage Stimulation Factor) reconnaissent les signaux de polyadénylation (5'-AAUAAA-3') et de coupure de l'ARN. Ils clivent l'ARN, induisent le détachement de la polymérase de l'ADN et recrutent la poly-A polymérase qui va ajouter la queue poly-A[34] (voir plus bas).
Maturation
La maturation des ARN comprend un ensemble de modifications chimiques postérieures à l'étape de transcription proprement dite par l'ARN polymérase. Ces modifications sont principalement observées chez les eucaryotes et jouent un rôle important dans le devenir de l'ARN maturé. Les principales modifications sont, l'adjonction d'une coiffe en 5', la polyadénylation en 3', l'épissage, l'introduction de modifications chimiques au niveau de la base ou du ribose et enfin l'édition.
Coiffe
Article détaillé : Coiffe (biologie).La coiffe ou 5'-cap est un nucléotide modifié qui est ajouté à l'extrémité 5' de l'ARN messager dans les cellules eucaryotes. Elle se compose d'une guanosine méthylée reliée par une liaison 5'-5' triphosphate au premier nucléotide transcrit par l'ARN polymérase[35]. Cette modification est introduite dans le noyau de la cellule, par l'action successive de plusieurs enzymes : triphosphatase, guanylyltransférase, méthyltransférases.
La coiffe joue plusieurs rôles : elle augmente la stabilité de l'ARN en le protégeant contre la dégradation par des exonucléases 5'-3', elle permet aussi le recrutement de facteurs d'initiation de la traduction nécessaires à la fixation du ribosome sur les ARN messagers cellulaires. La coiffe est donc essentielle à la traduction de la plupart des ARNm.
Polyadénylation
Article détaillé : Polyadénylation.La polyadénylation consiste en l'addition d'une extension à l'extrémité 3' de l'ARN composée exclusivement de ribonucléotides de type adénosine (A). Pour cette raison, l'extension est appelée queue poly (A). Bien que composée de nucléotides standard, cette queue poly (A) est ajoutée post-transcriptionnellement par une enzyme spécifique appelée poly (A) polymérase[36] et n'est pas codée dans l'ADN génomique. La queue poly (A) est trouvée principalement à l'extrémité des ARN messagers. Chez les eucaryotes, la polyadénylation des ARNm est nécessaire à leur traduction par le ribosome et participe à leur stabilisation. La queue poly (A) est en particulier reconnue par la PABP (« poly (A) binding protein », protéine de liaison de la poly (A)).
Chez les bactéries et dans certaines mitochondries, la polyadénylation des ARN est au contraire un signal de dégradation[37].
Épissage
Article détaillé : Épissage.L'épissage est une modification post-transcriptionnelle qui consiste en l'élimination des introns et la suture des exons dans les ARN messagers et dans certains ARN structurés comme les ARNt[2]. Présents chez les organismes eucaryotes, les introns sont des segments d'ARN qui sont codés dans le génome et transcrits dans l'ARN précurseur, mais qui sont éliminés du produit final. Dans la plupart des cas, ce processus fait intervenir une machinerie spécifique complexe appelée le splicéosome[38]. L'épissage se produit dans le noyau des cellules eucaryotes, avant l'export de l'ARN maturé vers le cytoplasme.
Nucléotides modifiés
Après leur transcription par l'ARN polymérase, certains ARN subissent des modifications chimiques sous l'action d'enzymes spécifiques. Les principaux ARN subissant des modifications sont les ARN de transfert et les ARN ribosomiques. On peut également considérer que les méthylations intervenant dans la synthèse de la coiffe sont des modifications de nucléotide particulières. Dans le cas général, les modifications peuvent porter soit sur la base, soit sur le ribose. Les principales modifications rencontrées sont :
- sur le ribose : des O-méthylations de la position 2'-OH ;
- sur la base :
- l'isomérisation des uridines qui donne des pseudouridines[39],
- des méthylations, soit sur des atomes de carbone (ribothymidine), soit sur des atomes d'azote (7-méthyl-guanosine, ...),
- une réduction, qui transforme les uridines en dihydrouridine,
- des thiolations,
- des modifications plus complexes (isopenténylation, thréonyl-carbamoylation...)
Dans les ARN de transfert, l'introduction de nucléotides modifiés contribue à augmenter la stabilité des molécules[40].
Édition
Article détaillé : Édition (biologie).L'édition des ARN consiste en une modification de la séquence de l'acide ribonucléique, postérieure à la transcription par l'ARN polymérase. À l'issue du processus d'édition, la séquence de l'ARN est donc différente de celle de l'ADN. Les changements opérés peuvent être la modification d'une base, la substitution d'une base ou encore l'ajout d'une ou plusieurs bases. Ces modifications sont effectuées par des enzymes qui agissent sur l'ARN, comme par exemple les cytidines déaminases, qui transforment chimiquement les cytidines en uridines.
Fonction dans la cellule
Article connexe : Liste d'ARN.Dans les cellules, les ARN remplissent quatre rôles distincts et complémentaires :
- Support temporaire de l'information génétique. C'est l'ARN messager qui remplit ce rôle, il est utilisé par la cellule pour transmettre l'information correspondant à un gène donné à l'extérieur du noyau, puis pour synthétiser des protéines à partir de ces informations ;
- Catalyseur enzymatique. Comme les protéines, les ARN peuvent se replier en trois dimensions pour former des structures complexes. Ces structures permettent à certains ARN de se comporter comme des enzymes, on parle alors de ribozyme. Le ribosome, la ribonucléase P et certains introns sont des ribozymes. Il existe des arguments indirects indiquant que la machinerie d'épissage des ARN messagers (le splicéosome) est également aussi un ribozyme[41], même si la démonstration formelle n'en a pas encore été apportée ;
- Guide pour des enzymes. Certains ARN sont utilisés comme cofacteurs par des protéines pour permettre leur ciblage vers des séquences spécifiques. Parmi ceux-ci, on peut citer les petits ARN nucléolaires (snoARN), qui guident les enzymes de modification de l'ARN ribosomique, l'ARN télomérique, qui est un cofacteur de la télomérase, l'enzyme qui fabrique les extrémités des chromosomes, ou encore les ARN interférents ;
- Régulateurs de l'expression génétique. Certains ARN non codants jouent un rôle dans la répression de l'expression de certains gènes ou groupes de gène. C'est le cas par exemple des ARN antisens qui s'apparient à un ARN cible et en bloquent la traduction par le ribosome.
Une classe particulière d'ARN, les ARN de transfert, se trouve à l'interface de plusieurs de ces fonctions en guidant les acides aminés lors de la traduction.
Enfin, le génome de certains virus est exclusivement constitué d'ARN et pas d'ADN. C'est en particulier le cas des virus de la grippe, du SIDA, de l'hépatite C et de la poliomyélite. Suivant les cas, la réplication de ces virus peut passer par un intermédiaire ADN (rétrovirus), mais peut aussi se faire directement d'ARN en ARN.
L'ARN est donc une molécule très polyvalente, ce qui a conduit Walter Gilbert, co-inventeur du séquençage de l'ADN à proposer en 1986 une hypothèse selon laquelle l'ARN serait la plus ancienne de toutes les macromolécules biologiques[24]. Cette théorie, dite du « RNA World » (le monde de l'ARN), permet de s'affranchir d'un paradoxe de l'œuf et de la poule qui survient lorsqu'on cherche à savoir qui des protéines (catalyseurs) et de l'ADN (information génétique) sont apparus en premier. Dans ce modèle, l'ARN, capable de combiner à la fois les deux types de fonctions, serait le précurseur universel.
ARN messagers
Article détaillé : Acide ribonucléique messager.L'information génétique contenue au sein de l'ADN n'est pas utilisée directement par la cellule pour fabriquer des protéines. Celle-ci utilise pour cela des copies transitoires de l'information génétique que sont les ARN messagers ou ARNm[42]. Chaque ARN messager porte un ou, parfois, plusieurs cistrons, c'est-à-dire les instructions pour former une seule protéine. Il correspond donc à la copie d'un seul des gènes du génome (on parle alors d'ARNm monocistronique) ou parfois de quelques-uns (ARNm polycistronique)[43].
L'ARN messager ne contient la copie que d'un seul des deux brins de l'ADN, celui qui est codant, et pas la séquence complémentaire. Par rapport à la séquence du gène contenue dans l'ADN du génome, celle de l'ARNm correspondant peut contenir des modifications et en particulier l'épissage (voir plus haut), qui élimine les régions non codantes. L'ARN messager synthétisé dans le noyau de la cellule est exporté dans le cytoplasme pour être traduit en protéine[2]. Contrairement à l'ADN, qui est une molécule pérenne, présente pendant toute la vie de la cellule, les ARN messagers ont une durée de vie limitée, de quelques minutes à quelques heures, après quoi ils sont dégradés et recyclés.
Un ARN messager comporte trois régions distinctes : une région 5' non-traduite ou 5'-UTR, située en amont du ou des cistrons qu'il porte ; une région codante correspondant à ce ou à ces cistrons ; et enfin, une région 3' non-traduite[44].
La fonction des ARN messagers est multiple. Ils permettent d'une part de préserver la matrice d'ADN originale, qui n'est pas directement utilisée pour la traduction, la cellule ne travaillant que sur la copie d'ARNm. L'existence d'ARN messagers offre surtout à la cellule un mécanisme crucial de régulation du cycle de production des protéines à partir du génome. Le besoin cellulaire en telle ou telle protéine peut varier en fonction de l'environnement, du type de cellule, du stade de développement. La synthèse protéique doit donc être activée ou arrêtée en fonction des conditions cellulaires. La régulation de la transcription de l'ADN en l'ARNm répond à une nécessité et est contrôlée par des facteurs de transcription spécifiques agissant sur les promoteurs des gènes cibles. Lorsque la quantité d'une protéine donnée est suffisante, la transcription d'ARNm est inhibée, celui-ci est progressivement dégradé et la production protéique cesse. Il est donc important que l'ARNm soit une molécule transitoire, afin de pouvoir réaliser cette régulation essentielle.
ARN de transfert
Article détaillé : ARN de transfert.Les ARN de transfert ou ARNt sont de courts ARN, longs d'environ 70 à 100 ribonucléotides, impliqués dans l'adressage des acides aminés vers les ribosomes lors de la traduction[45]. Les ARN de transfert ont une structure caractéristique en feuille de trèfle, composée de quatre tiges appariées. L'une de ces tiges est terminée par une boucle qui contient l'anticodon, le triplet de nucléotides qui s'apparie au codon lors de la traduction d'un ARNm par le ribosome[46]. À l'autre extrémité, l'ARNt porte l'acide aminé correspondant attaché par une liaison ester à son extrémité 3'-OH. Cette estérification est catalysée par des enzymes spécifiques, les aminoacyl-ARNt synthétases. En trois dimensions, la structure en feuille de trèfle se replie en « L », avec l'anticodon à une extrémité et l'acide aminé estérifié à l'autre extrémité[47].
Toutes les cellules vivantes contiennent un ensemble d'ARNt différents portant les différents acides aminés et capable de lire les différents codons.
Les ARN de transfert sont parfois désignés comme des « adapteurs » entre le code nucléique et le code protéique. C'est Francis Crick qui a proposé l'existence de ces adapteurs, avant même leur découverte en 1958[48].
ARN catalytiques ou ribozymes
Article détaillé : Ribozyme.La découverte d'ARN possédant des capacités catalytiques a été faite dans les années 1980, en particulier par l'équipe de Thomas Cech, qui travaillait sur les introns du gène de l'ARN ribosomique du protozoaire cilié Tetrahymena[49], et celle de Sidney Altman, qui étudiait la ribonucléase P, l'enzyme de maturation de l'ARNt[50]. Cech et Altman ont été récompensés par le prix Nobel de chimie en 1989 pour cette découverte.
Dans ces deux cas, l'ARN seul est capable de catalyser une réaction de coupure ou de transestérification spécifique, en l'absence de protéine. Ces ARN catalytiques ont été appelés ribozymes, car ce sont des enzymes constituées d'acide ribonucléique. Dans le cas de l'intron de Tetrahymena, il s'agit d'un auto-épissage, l'intron étant son propre substrat, tandis que la ribonucléase P est une enzyme agissant en trans, sur des substrats multiples.
Depuis ces découvertes initiales, d'autres ribozymes naturels ont été identifiés :
- les ARN de viroïdes ou de virus satellites (virusoïdes) qui sont capables de se cliver eux-mêmes[51] ;
- il existe aujourd'hui des arguments très forts, basés sur la résolution de sa structure 3D, pour affirmer que ribosome, la machinerie cellulaire responsable de la traduction de l'ARNm en protéines, est lui-même un ribozyme[52]. Les deux sites actifs du ribosome, le centre de décodage sur la petite sous-unité et le centre peptidyl-transférase qui forme les liaisons peptidiques, sont en effet exclusivement composés de segments d'ARN ribosomique ;
- le splicéosome, qui catalyse l'épissage des ARNm cytoplasmiques eucaryotes, est probablement aussi un ribozyme[41] ;
- certains riboswitchs, des régions régulatrices structurées portées par des ARN messagers, ont une activité catalytique de coupure en présence d'un ligand[53] ;
- il existe enfin des ribozymes synthétiques, qui ont été isolés par des méthodes d'évolution in vitro, comme la technique SELEX[54]. On a ainsi pu isoler des ARN catalytiques synthétiques capables de catalyser une grande variété de réactions chimiques et de fixer des ligands très divers, ce qui a été interprété comme un argument en faveur de l'hypothèse du monde à ARN. De tels ARN synthétiques sont parfois appelés des aptamères, puisqu'ils sont « aptes » à réaliser une tâche donnée.
De manière générale, dans tous ces ribozymes, c'est leur repliement spécifique qui leur permet d'effecteur la reconnaissance de leur substrat et la catalyse, comme dans le cas des enzymes protéiques.
ARN guides
Les ARN guides sont des ARN qui s'associent à des enzymes protéiques et servent à en guider l'action sur des ARN ou des ADN de séquence complémentaire. L'ARN guide s'apparie à l'acide nucléique substrat et permet de cibler l'activité de l'enzyme. On a identifié plusieurs types :
- les petits ARN nucléolaires. On trouve, dans le nucléole des cellules eucaryotes, des ARN guides appelés petits ARN nucléolaires, ou snoARN, qui dirigent l'action d'enzymes de modification de l'ARN ribosomique, en particulier les 2'-O-méthylations par les snoARN C/D et les pseudouridylations par les snoARN H/ACA [55]. Ce mécanisme permet à la cellule de modifier spécifiquement de multiples positions de l'ARNr, avec une seule enzyme en utilisant différents snoARN comme guides. Les snoARN sont souvent codés par des séquences introniques[56] ;
- les microARN sont également des ARN guides qui interviennent dans le processus d'interférence ARN. Associé à un complexe protéique appelé RISC (RNA induced silencing complex), ces petits ARN provoquent soit une dégradation de l'ARNm cible auquel ils s'apparient, soit une répression de sa traduction[57] ;
- TERC (« telomerase RNA component »), la sous-unité ARN de la télomérase. Cet ARN structuré est associé à la transcriptase inverse qui synthétise les télomères, extrémités des chromosomes. Il contient une séquence qui sert de substrat à la télomérase pour synthétiser l'ADN télomérique de séquence complémentaire[58]. Il guide donc l'activité de l'enzyme, mais en servant de matrice, plutôt qu'en formant un appariement avec le substrat.
- chez les mammifères, les lincARN sont de larges ARN intergéniques, non codants, mais transcrits comme les ARNm par l'ARN polymérase II. Leur longueur leur permet d'adopter une structure complexe tridimensionnelle. Ces structures complexes permettent leur intéraction avec différent cofacteurs transcriptionnels tel que hnRNP-K ou PRC2 (principalement des inhibiteurs de la transcription). Ces complexes sont ensuite guidés grâce aux lincARN sur les séquences régulatrices des gènes afin d'inhiber leur expression. La liaison des lincARN avec l'ADN impliquerait un appariement des bases ARN avec les bases ADN correspondante après désappariement de la double hélice d'ADN, voir la formation de triple hélice ADN-ADN-ARN[59]. ;
ARN régulateurs
Articles connexes : ARN interférent et petit ARN interférent. Chatte au pelage tricolore, dit écaille de tortue, lié à une inactivation du chromosome X par l'ARN Xist. Seules les femelles XX présentent ce pelage mélangé.
Chatte au pelage tricolore, dit écaille de tortue, lié à une inactivation du chromosome X par l'ARN Xist. Seules les femelles XX présentent ce pelage mélangé.
Certains ARN jouent un rôle de régulateurs directs de l'expression génétique. C'est en particulier le cas d'ARN non codants possédant des régions complémentaires d'ARN messagers cellulaires et qui peuvent donc s'y apparier pour former localement un duplex d'ARN. Ces ARN antisens peuvent être issus du même locus génétique que leur ARN cible, par transcription du brin complémentaire, on parle alors d'ARN cis-régulateurs. Ils peuvent aussi être issus de la transcription d'une autre région du génome, ce sont alors des ARN trans-régulateurs.
L'appariement de l'ARN régulateur avec son ARN messager cible peut agir sur la capacité de ce dernier à être traduit par le ribosome ou sur sa stabilité, ce qui aboutit à une régulation de la traduction du ou des gènes portés par l'ARN messager. Chez les bactéries, il existe ainsi de nombreux exemples d'ARN antisens cis- ou trans-régulateurs qui bloquent le site de démarrage de la traduction[60]. Par exemple, le gène codant pour la porine OmpF est régulé par un ARN antisens appelé MicF.
Chez les eucaryotes, il existe aussi de grands ARN régulateurs, qui interviennent dans des processus de régulation épigénétique. L'exemple le mieux connu est celui de l'ARN Xist chez les mammifères. Celui-ci inactive non pas un gène, mais un chromosome entier. Xist recouvre l'un des deux chromosomes X de chaque cellule chez les individus femelles qui devient ainsi inactif[61]. Un seul des deux chromosomes de la paire XX est ainsi actif, ce qui permet d'avoir le même taux d'expression des gènes portés par le chromosome X que chez les individus mâles, qui n'en ont qu'un. L'inactivation du X est un processus aléatoire, ce qui peut conduire à l'expression de différents phénotypes par différentes cellules, chez la même femelle. C'est par exemple le cas pour la couleur du pelage chez les chattes.
Utilisations thérapeutiques et biotechnologiques
L'ARN est utilisé aujourd'hui dans un certain nombre d'applications en biologie moléculaire, en particulier grâce au processus d'interférence ARN, qui consiste en l'introduction dans des cellules eucaryotes de courts fragments d'ARN double-brin appelés « petits ARN interférents ». Longs d'une vingtaine de paires de bases, ces petits ARN interférents (pARNi) sont utilisés par une machinerie cellulaire capable de dégrader les ARNm de manière spécifique. Seul les ARNm contenant une séquence correspondant à celle de l'pARNi sont dégradés, ce qui permet de diminuer sélectivement l'expression d'une protéine donnée[62]. Cette approche technologique est beaucoup plus simple et rapide que l'établissement de lignées murines inactivées (knock-out) et s'appelle un knock-down.
Des essais d'utilisation de cette technique à des fins thérapeutiques sont envisagés, par exemple en ciblant des gènes viraux pour lutter contre des infections, ou des oncogènes, dans le cas de cancers[63]. Ils nécessitent cependant de stabiliser les petits ARN interférents (pARNi) pour éviter leur dégradation par des ribonucléases et de cibler leur action vers les cellules concernées.
Historique
Les acides nucléiques ont été découverts en 1868 par Friedrich Miescher[64]. Miescher appela la nouvelle substance « nucléine » car elle se trouvait dans le noyau des cellules. La présence d'acides nucléiques dans le cytoplasme de la levure fut identifiée en 1939[65] et leur nature ribonucléique fut établie, contrairement aux chromosomes qui contenaient de l'ADN avec des désoxyriboses. À la fin des années 1950, Severo Ochoa parvint à synthétiser in vitro des molécules d'ARN au moyen d'une enzyme spécifique, la polynucléotide phosphorylase, ce qui permit l'étude des propriétés chimiques et physiques de l'ARN. Le rôle de l'ARN comme « messager » intermédiaire entre l'information génétique contenue dans l'ADN et les protéines fut proposé en 1960 par Jacques Monod et François Jacob[66] à la suite d'une discussion avec Sydney Brenner et Francis Crick[67]. Ensuite, le déchiffrage du code génétique fut réalisé par Marshall Nirenberg dans la première moitié des années 1960. Il utilisa pour cela des ARN synthétiques de séquence nucléotidique connue dont il étudia les propriétés de codage.
Les ribosomes furent observés pour la première fois par le biologiste belge Albert Claude au début des années 1940. Par des techniques de fractionnement subcellulaire et de microscopie électronique, il mit en évidence des « petites particules » de nature ribonucléoprotéique, présentes dans tous les types de cellules vivantes. Il les baptisa « microsomes »[68], plus tard renommés ribosomes.
La structure secondaire des ARNt fut établie par Robert Holley, qui parvint à purifier et à analyser la séquence de l'ARNt spécifique de l'alanine en 1964[46]. Ce fut un progrès majeur dans la compréhension du déchiffrage du message génétique porté par les ARN messagers. La structure tridimensionnelle d'un ARNt fut résolue en 1974, indépendamment, par les équipes de Aaron Klug et Alexander Rich[47], montrant pour la première fois la structure complexe d'un ARN. L'existence de propriétés catalytiques des ARN fut montrée indépendamment par Sidney Altman et Tom Cech en 1982, sur la ribonucléase P[50] d'une part et sur les introns autoépissables d'autre part[49]. La résolution de la structure des sous-unités individuelles du ribosome en 2000 par les équipes de Tom Steitz, Ada Yonath et Venki Ramakrishnan[69],[70],[71], puis celle du ribosome entier par l'équipe de Harry Noller en 2001[72], constituèrent un progrès essentiel dans la compréhension du mécanisme central de la biologie qu'est la traduction des ARNm en protéines. De plus, cela permit de montrer, entre autres, que le ribosome était aussi un ribozyme.
Notes et références
- (en) Rebecca K. Montange et Robert T. Batey, « Structure of the S-adenosylmethionine riboswitch regulatory mRNA element », dans Nature, vol. 441, no 7097, 29 juin 2006, p. 1172-1175 [texte intégral, lien PMID]
- H. Lodish, A. Berk, P. Matsudaira, C.A. Kaiser, M. Krieger, M.P. Scott, L. Zipursky et J. Darnell, Biologie moléculaire de la cellule, Bruxelles, de Boeck, 2005, 3e éd. (ISBN 978-2804148027)
- (en) Wolfram Saenger, Principles of nucleic acid structure, Springer, 1984 (ISBN 0-387-90762-9)
- (en) Jan Barciszewski et Brian Frederic Carl Clark, RNA biochemistry and biotechnology, Springer, 1999, 73–87 p. (ISBN 0-7923-5862-7) (OCLC 52403776)
- (en) M. Sudaralingam, « Stereochemistry of nucleic acids and their constituents. IV. Allowed and preferred conformations of nucleosides, nucleoside mono-, di-, tri-, tetraphosphates, nucleic acids and polynucleotides », dans Biopolymers, vol. 7, no 6, 1969, p. 821-860 [texte intégral]
- (en) R. Langridge et P.J. Gomatos, « The Structure of RNA. Reovirus RNA and transfer RNA have similar three-dimensional structures, which differ from DNA. », dans Science, vol. 141, no 4, 1963, p. 694-698 [lien PMID]
- (en) H.R. Drew, R.M. Wing, T. Tanako, C Broka, S Tanaka, K Itakura et R.E. Dickerson, « Structure of a B-DNA dodecamer: conformation and dynamics. », dans Proc. Natl. Acad. Sci. USA, vol. 78, no 4, avril 1981, p. 2179-2183 [texte intégral, lien PMID]
- (en) Peter S. Klosterman, Sapan A. Shah et Thomas A. Steitz, « Crystal structures of two plasmid copy control related RNA duplexes: An 18 base pair duplex at 1.20 A resolution and a 19 base pair duplex at 1.55 A resolution. », dans Biochemistry, vol. 38, no 45, 1999, p. 14784-14792 [texte intégral, lien PMID]
- (en) J.M. Rosenberg, N.C. Seeman, J.J. Kim, F.L. Suddath, H.B. Nicholas et A. Rich, « Double helix at atomic resolution. », dans Nature, vol. 243, no 5403, 1973, p. 150-154 [texte intégral, lien PMID (pages consultées le 6 novembre 2009)]
- (en) R.O. Day, N.C. Seeman, J.M. Rosenberg et A. Rich, « A Crystalline Fragment of the Double Helix: The Structure of the Dinucleoside Phosphate Guanylyl-3',5'-Cytidine. », dans Proc. Natl. Acad. Sci. USA, vol. 70, no 3, mars 1973, p. 849-853 [texte intégral, lien PMID (pages consultées le 6 novembre 2009)]
- (en) Alexander Rich et David R. Davies, « A new two stranded helical structure: Polyadenylic acid and polyuridylic acid », dans J. Am. Chem. Soc., vol. 78, no 14, 1956, p. 3548-3549 [texte intégral (page consultée le 6 novembre 2009)]
- (en) D.E. Draper, « Protein-RNA recognition », dans Annu. Rev. Biochem., vol. 64, 1995, p. 593-620 [texte intégral, lien PMID (pages consultées le 6 novembre 2009)]
- (en) S.A. Woodson, « Metal ions and RNA folding: a highly charged topic with a dynamic future », dans Curr. Opin. Chem. Biol., vol. 9, no 2, avril 2005, p. 104-9 [texte intégral, lien PMID (pages consultées le 6 novembre 2009)]
- (en) P. Doty, H. Boedtker, J.R. Fresco, R. Haselkorn et M. Litt, « Secondary Structure in Ribonucleic Acids », dans Proc. Natl. Acad. Sci. USA, vol. 45, no 4, 1959, p. 482-499 [lien PMID]
- F. Dardel et F. Képès, Bioinformatique : génomique et post-génomique, Editions de l'Ecole Polytechnique, 2002, 153-180 p. (ISBN 978-2730209274)
- (en) A.M. Michelson, « Hyperchromicity and nucleic acids. », dans Nature, vol. 182, no 4648, 1958, p. 1502-1503 [lien PMID]
- (en) K. Hoogsteen, « The crystal and molecular structure of a hydrogen-bonded complex between 1-methylthymine and 9-methyladenine. », dans Acta Cryst., vol. 16, 1963, p. 907-916 [lien DOI]
- (en) H.A. Heus et Pardi, « Structural features that give rise to the unusual stability of RNA hairpins containing GNRA loops. », dans Science, vol. 253, no 5016, 1991, p. 191-194 [lien PMID]
- (en) N.B. Leontis et E. Westhof, « The non-Watson-Crick base pairs and their associated isostericity matrices. », dans Nucleic Acids Res., vol. 30, no 16, 2002, p. 3497-3531 [lien PMID]
- (en) D.W. Staple et S.E. Butcher, « Pseudoknots: RNA Structures with Diverse Functions. », dans PloS Biol., vol. 3, 2005, p. e213 [texte intégral, lien PMID]
- (en) M. Costa et F. Michel, « Frequent use of the same tertiary motif by self-folding RNAs », dans EMBO J., vol. 14, 1995, p. 1276–1285 [texte intégral, lien PMID]
- (en) P.J. Gomatos et I. Tamm, « The secondary structure of reovirus RNA », dans Proc. Natl. Acad. Sci. USA, vol. 49, no 5, 1963, p. 707-714 [lien PMID]
- (en) R. Markham et J.D. Smith, « The Structure of Ribonucleic Acids 1. Cyclic nucleotides produced by ribonuclease and by alkaline hydrolysis », dans Biochem. J., vol. 52, no 4, 1952, p. 552-557 [texte intégral, lien PMID]
- Walter Gilbert, « The RNA World », Nature 319, 1986, p.618
- Biochimie de Harper, Harold A Harper,A Harold
- (en) S.T. Smale et J.T. Kadonaga, « The RNA polymerase II core promoter », dans Ann. Rev. Biochem., vol. 72, 2003, p. 449-479 [texte intégral, lien PMID]
- (en) R.P. Lifton, M.L. Goldberg, R.W. Karp et D.S. Hogness, « The organization of the histone genes in Drosophila melanogaster: functional and evolutionary implications », dans Cold Spring Harb. Symp. Quant. Biol., vol. 42, 1978, p. 1047-1051 [texte intégral, lien PMID]
- (en) D. Pribnow, « Nucleotide sequence of an RNA polymerase binding site at an early T7 promoter », dans Proc. Natl. Acad. Sci. USA, vol. 72, 1975, p. 784-788 [texte intégral, lien PMID]
- (en) B.A. Hamkalo et O.L. Miller, « Electronmicroscopy of genetic activity », dans Annu. Rev. Biochem., vol. 42, 1973, p. 376-396 [lien PMID]
- (en) W.R. McClure et Y. Chow, « The kinetics and processivity of nucleic acid polymerases », dans Methods Enzymol., vol. 64, 1980, p. 277-297 [texte intégral, lien PMID]
- (en) H. Bremer et P.P. Dennis, « Modulation of chemical composition and other parameters of the cell by growth rate », dans F.C Neidhardt, R Curtiss, III, J.L Ingraham, E.C.C Lin, K.B Low, B Magasanik, W.S Reznikoff, M Riley, M Schaechter et H.E Umbarger, Escherichia coli and Salmonella typhimurium Cellular and Molecular Biology, Washington, DC, ASM Press, 1996 (ISBN 0-914826-89-1) [lire en ligne], p. 1553-1569
- (en) S. Adhya et M. Gottesman, « Control of transcription termination », dans Annu. Rev. Biochem., vol. 47, 1978, p. 967-996 [texte intégral, lien PMID]
- (en) M.S. Ciampi, « Rho-dependent terminators and transcription termination », dans Microbiology, vol. 152, 2006, p. 2515-2528 [texte intégral, lien PMID]
- (en) M. Edmonds, « A history of poly A sequences: from formation to factors to function », dans Prog. Nucleic Acid res. Mol. Biol., vol. 71, 2002, p. 285-389 [texte intégral, lien PMID]
- (en) A.K. Banerjee, « 5'-terminal cap structure in eucaryotic messenger ribonucleic acids », dans Microbiol. Rev, vol. 44, 1980, p. 175-205 [texte intégral, lien PMID]
- (en) M. Edmonds et R. Abrams, « Polynucleotide biosynthesis: formation of a sequence of adenylate units from adenosine triphosphate by an enzyme from thymus nuclei », dans J. Biol. Chem., vol. 235, 1960, p. 1142-1149 [texte intégral, lien PMID]
- (en) M. Dreyfus et P. Régnier, « The poly(A) tail of mRNAs: bodyguard in eukaryotes, scavenger in bacteria », dans Cell, vol. 111, 2002, p. 611-613 [texte intégral, lien PMID]
- (en) J.P. Staley et C. Guthrie, « Mechanical devices of the spliceosome: motors, clocks, springs, and things », dans Cell, vol. 92, 1998, p. 315-326 [texte intégral, lien PMID]
- (en) W.E. Cohn, « Pseudouridine, a carbon-carbon linked ribonucleoside in ribonucleic acids: isolation, structure, and chemical characteristics », dans J. Biol. Chem., vol. 235, 1960, p. 1488-1498 [texte intégral, lien PMID]
- (en) J.A. Kowalak, J.J. Dalluge, J.A. McCloskey et K.O. Stetter, « The role of posttranscriptional modification in stabilization of transfer RNA from hyperthermophiles. », dans Biochemistry, vol. 28, 1994, p. 7869-7876 [lien PMID]
- (en) S. Valadkhan, A. Mohammadi, Y. Jaladat et S. Geisler, « Protein-free small nuclear RNAs catalyze a two-step splicing reaction. », dans Proc. Natl. Acad. Sci. USA, vol. 106, 2009, p. 11901-11906 [lien PMID]
- (en) S. Brenner, F. Jacob et M. Meselson, « An unstable intermediate carrying information from genes to ribosomes for protein synthesis. », dans Nature, vol. 190, 1961, p. 576-581
- (en) B.N. Ames et R.G. Martin, « Biochemical aspects of genetics: The operon. », dans Annu. Rev. Biochem., vol. 33, 1964, p. 235-258 [lien PMID]
- (en) C. Yanofsky, « Establishing the triplet nature of the genetic code. », dans Cell, vol. 128, 2007, p. 815-818 [lien PMID]
- (en) M.B. Hoagland, M.L Stephenson, J.F. Scott, H.I. Hecht et P.C. Zamecnik, « A soluble ribonucleic acid intermediate in protein synthesis », dans J. Biol. Chem., vol. 231, 1958, p. 241-257 [lien PMID]
- (en) R.W. Holley, J. Apgar, G.A. Everett, J.T. Madison, A. Zamir, S.H. Merrill et J.R. Penswick, « Structure of a ribonucleic acid », dans Science, vol. 147, 1965, p. 1462-1465 [lien PMID]
- (en) J.D. Robertus, J.E. Ladner, J.T. Finch, D. Rhodes, R.S. Brown, B.F. Clark et A. Klug, « Structure of yeast phenylalanine tRNA at 3 A resolution. », dans Nature, vol. 250, 1974, p. 546–551 [lien PMID], (en) S.H. Kim, F.L. Suddath, G.J. Quigley, A. McPherson, J.L. Sussman, A.H. Wang, N.C. Seeman et A. Rich, « Three-dimensional tertiary structure of yeast phenylalanine transfer RNA. », dans Science, vol. 250, 1974, p. 546–551 [lien PMID]
- (en) Francis H. Crick, « On protein synthesis », dans Symp. Soc. Exp. Biol., vol. 12, 58, p. 138-163 [texte intégral, lien PMID]
- (en) Kruger, P.J. Grabowski, A.J. Zaug, J. Sands, D.E. Gottschling et T.R. Cech, « Self-splicing RNA: autoexcision and autocyclization of the ribosomal RNA intervening sequence of Tetrahymena. », dans Cell, vol. 31, 1982, p. 147-157 [lien PMID]
- (en) C. Guerrier-Takada, K. Gardiner, T. Marsh, N. Pace et S. Altman, « The RNA moiety of ribonuclease P is the catalytic subunit of the enzyme. », dans Cell, vol. 35, 1983, p. 849-857 [lien PMID]
- (en) A.C. Forster, Davies, C.J. Hutchins et R.H. Symons, « Characterization of self-cleavage of viroid and virusoid RNAs. », dans Methods Enzymol., vol. 181, 1990, p. 583-607 [lien PMID]
- (en) T.R. Cech, « Structural biology. The ribosome is a ribozyme. », dans Science, vol. 289, 2000, p. 878-879 [lien PMID]
- (en) J.E. Barrick, K.A. Corbino, W.C. Winkler, A. Nahvi, M. Mandal, J. Collins, M. Lee, A. Roth, N. Sudarsan, I. Jona, J.K. Wickiser et R.R. Breaker, « New RNA motifs suggest an expanded scope for riboswitches in bacterial genetic control. », dans Proc. Natl. Acad. Sci. USA, vol. 101, 2004, p. 6421-6426 [lien PMID]
- (en) A.D. Ellington et J.W. Szostak, « In vitro selection of RNA molecules that bind specific ligands. », dans Nature, vol. 346, 1990, p. 818-822 [lien PMID]
(en) C. Tuerk et L. Gold, « Systematic evolution of ligands by exponential enrichment: RNA ligands to bacteriophage T4 DNA polymerase. », dans Science, vol. 249, 1990, p. 505-510 [lien PMID] - (en) Z. Kiss-László, Y. Henry, J.P. Bachellerie, M. Caizergues-Ferrer et T. Kiss, « Site-specific ribose methylation of preribosomal RNA: a novel function for small nucleolar RNAs. », dans Cell, vol. 85, 1996, p. 1077-1088 [lien PMID]
- (en) J. Liu, « Novel intron-encoded small nucleolar RNAs. », dans Cell, vol. 75, 1993, p. 403-405 [lien PMID]
- (en) B. Sollner-Webb, « Control of protein synthesis and mRNA degradation by microRNAs. », dans Curr. Opin. Cell Biol., vol. 20, 2008, p. 214-221 [lien PMID]
- (en) D. Shippen-Lentz et E.H. Blackburn, « Functional evidence for an RNA template in telomerase. », dans Science, vol. 247, 1990, p. 546-552 [lien PMID]
- (en) M. Huarte, T. Jacks et J.L. Rinn, « A Large Intergenic Noncoding RNA Induced by p53 Mediates Global Gene Repression in the p53 Response », dans Cell, vol. 142, 2010, p. 409-419 [lien PMID]
- (en) E.G. Wagner et R.W. Simons, « Antisense RNA control in bacteria, phages, and plasmids. », dans Annu. Rev. Microbiol., vol. 48, 1994, p. 713-742 [lien PMID]
- (en) E. Heard, « Recent advances in X-chromosome inactivation. », dans Curr. Opin. Cell Biol., vol. 16, 2004, p. 247-255 [lien PMID]
- (en) A. Fire, S. Xu, M. Montgomery, S. Kostas, S. Driver et C. Mello, « Potent and specific genetic interference by double-stranded RNA in Caenorhabditis elegans. », dans Nature, vol. 391, 1998, p. 806-811
- Claude Hélène, « Les promesses de l'ARN thérapeutique = Genetic interference by RNA. », dans Le Concours Médical, vol. 124, 2002, p. 2550-2552
- (en) R Dahm, « Friedrich Miescher and the discovery of DNA », dans Dev. Biol., vol. 278, no 2, 2005, p. 274–88 [lien PMID, lien DOI]
- (en) T. Caspersson et J. Schultz, « Pentose nucleotides in the cytoplasm of growing tissues », dans Nature, vol. 143, 1939, p. 602–3 [lien DOI]
- (en) F. Jacob et J. Monod, « Genetic regulatory mechanisms in the synthesis of proteins. », dans J. Mol. Biol., vol. 3, 1961, p. 318–356 [lien PMID]
- François Jacob, La statue intérieure, Gallimard, 1990 (ISBN 978-2-07-038246-0)
- (en) A. Claude, « The constitution of protoplasm », dans Science, vol. 97, no 2525, 1943, p. 451–456 [lien PMID, lien DOI]
- (en) N. Ban, P. Nissen, J. Hansen, P.B. Moore et T.A. Steitz, « The complete atomic structure of the large ribosomal subunit at 2.4 A resolution. », dans Science, vol. 289, 2000, p. 905-920 [lien PMID]
- (en) D. Schluenzen, A. Tocilj, R. Zarivach, J. Harms, M. Gluehmann, Janell, A. Bashan, H. Bartels, I. Agmon, F. Franceschi et A. Yonath, « Structure of functionally activated small ribosomal subunit at 3.3 angstroms resolution. », dans Cell, vol. 102, 2000, p. 615–623 [lien PMID]
- (en) D.E. Brodersen, A.P. Carter, R.J. Morgan-Warren, B.T. Wimberly et V. Ramakrishnan, « Structure of the 30S ribosomal subunit. », dans Nature, vol. 407, 2000, p. 1143-1154 [lien PMID]
- (en) M.M. Yusupov, G.Z. Yusupova, A. Baucom, K. Lieberman, T.N. Earnest, J.H. Cate et H.F. Noller, « Crystal structure of the ribosome at 5.5 A resolution. », dans Nature, vol. 292, 2001, p. 883-896 [lien PMID]
Voir aussi
Articles connexes
- Liste des différents types d'ARN
- Acide ribonucléique messager
- Ribosome
- Ribozyme
- ARN double-brin
- microARN
- ARN interférent
- Liste d'abréviations de biologie cellulaire et moléculaire
Liens externes
- RNA World à l'Institut Fritz Lipman Collection de liens sur le « monde de l'ARN » (structures, sequences, outils, publications)
- Nucleic Acid Database Base de donnée structurale sur les acides nucléiques à l'Université Rutgers.
- Portail de la biologie cellulaire et moléculaire
Wikimedia Foundation. 2010.