- Proton
-
Proton 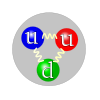 Représentation schématique de la composition en quarks de valence d'un proton, avec deux quarks u et un quark d. L'interaction forte est transmise par des gluons (représentés ici par un tracé sinusoïdal). La couleur des quarks fait référence aux trois types de charges de l'interaction forte : rouge, verte et bleue. Le choix de couleur effectué ici est arbitraire, la charge de couleur circulant à travers les trois quarks.
Représentation schématique de la composition en quarks de valence d'un proton, avec deux quarks u et un quark d. L'interaction forte est transmise par des gluons (représentés ici par un tracé sinusoïdal). La couleur des quarks fait référence aux trois types de charges de l'interaction forte : rouge, verte et bleue. Le choix de couleur effectué ici est arbitraire, la charge de couleur circulant à travers les trois quarks.Propriétés générales Classification Particule composite (baryon) Composition 2 quarks u
1 quark dFamille Fermion Groupe Baryon (nucléon) Interaction(s) Forte, électromagnétique, faible, gravitation Symbole p, p+
Antiparticule Antiproton Propriétés physiques Masse 938,272 MeV.c-2
(1,672 623×10-27 kg)Charge électrique 1,602 176 53×10-19 C Rayon de charge 0,84184 fm Moment dipôlaire <5,4×10−24 e Cm Polarisabilité électrique 1,2(6)×10−3 fm³ Moment magnétique 2,792847351(28) μN Polarisabilité magnétique 1,9(5)×10−4 fm³ Charge de couleur 0 Spin ½ Isospin ½ Parité +1 Durée de vie Stable (supérieure à 1030 ans, voire à 1033ans) Historique Prédiction William Prout, 1815 Découverte 1918 Découvreur Ernest Rutherford Le proton est une particule subatomique portant une charge électrique élémentaire positive.
Les protons sont présents dans le noyau des atomes, éventuellement liés avec des neutrons par l'interaction forte (le noyau de l'isotope le plus répandu de l'hydrogène, H+, est un simple proton) ; le proton est également stable par lui-même, en dehors du noyau atomique.
Le proton n'est pas une particule élémentaire, étant composé de trois autres particules : deux quarks up et un quark down.
Sommaire
Caractéristiques physiques
Description
Le proton est un fermion de spin ½. Il est composé de trois quarks de valence, ce qui en fait un baryon. Les deux quarks up et le quark down du proton sont liés par l'interaction forte, transmise par des gluons. En plus de ces trois quarks de valence (qui déterminent les nombres quantiques de la particule) et des gluons, le proton, comme les autres hadrons, est constitué d'une « mer » de paires de quarks-antiquarks virtuels qui apparaissent et disparaissent en permanence. Les nombres quantiques de ces paires virtuelles s'annulent en moyenne ne contribuent pas à ceux du proton ; en revanche, la masse du proton provient principalement de la masse de ces paires virtuelles.
Tout comme le neutron, le proton est un nucléon et peut être lié à d'autres nucléons par la force nucléaire à l'intérieur d'un noyau atomique. Le noyau de l'isotope le plus courant de l'hydrogène est un simple proton. Le noyau des isotopes plus lourds, le deutérium et le tritium contiennent un proton lié à un et deux neutrons, respectivement. tous les autres noyaux atomiques sont composés de deux protons ou plus et d'un certain nombre de neutrons. Le nombre de protons d'un noyau détermine les propriétés chimiques de l'atome et donc quel élément chimique il représente.
La masse du proton est égale à environ 1,007276 u, soit à peu près 938,2720 MeV ou 1,673×10-27 kg[1]. La masse du proton est environ 1 836,15 fois celle de l'électron. Sa charge électrique est très exactement égale à une charge élémentaire positive (e), soit +1,602176×10-19 C ; l'électron possède une charge électrique négative, de valeur opposée à celle du proton. La charge électrique du proton est égale à la somme des charges électriques de ses quarks : celle de chaque quark up vaut 2/3e et celle du quark down vaut -1/3e et sa taille est d'environ 84fm .
Le rayon de charge du proton, c'est-à-dire le rayon moyen quadratique de sa distribution de charge, est de l'ordre de 0,84184 fm[2].
Stabilité
Le proton semble être stable. Sa demi-vie est expérimentalement mesurée comme supérieure à 6,6×1035 ans[3]. Sa durée de vie moyenne est au minimum de l'ordre de 2,1×1029 ans[1],[4].
En revanche, les protons peuvent se transformer en neutrons par capture électronique. Ce processus n'est pas spontané et nécessite un apport d'énergie. La réaction émet un neutron ainsi qu'un neutrino électronique :
Le processus est réversible : les neutrons peuvent se transformer en protons par désintégration bêta, une forme de désintégration radioactive. De fait, un neutron libre se désintègre de cette façon avec une durée de vie moyenne d'environ 15 minutes.
Chimie
En chimie et en biochimie, le terme proton peut se référer à l'ion hydrogène en solution aqueuse (c'est-à-dire, l'ion hydronium). Dans ce contexte, un donneur de proton est un acide et un accepteur de proton est une base (voir les réactions acido-basiques). En effet, l'atome d'hydrogène dans son isotope ultra-majoritaire se compose d'un noyau formé d'un unique proton et sans neutron, et d'un cortège électronique d'un seul électron. Un atome d'hydrogène ayant perdu un électron est donc un proton libre. Dans une solution aqueuse, on ne peut pas vraiment distinguer l'ion hydronium H3O+ et le proton H+, ce dernier ayant tendance à former constamment des liaisons avec les molécules d'eau (et les molécules d'eau étant ultra-majoritaires, il est inutile de tenir compte de la formation des ions H3O+ pour calculer le nombre de molécules d'eau).
Un acide 'monoprotique' (chlorure d'hydrogène, acide éthanoïque, acide nitrique) ne peut céder qu'un seul proton par molécule.
Historique
Le concept d'une particule analogue à l'hydrogène, constituant des autres atomes, s'est graduellement développée au cours du XIXe siècle et du début du XXe siècle. Dès 1815, William Prout émet l'hypothèse que tous les atomes sont composés d'atomes d'hydrogène, sur la base d'interprétations des valeurs des masses atomiques ; cette hypothèse se révèle fausse lorsque ces valeurs sont mesurées avec plus de précision.
En 1886, Eugen Goldstein découvre les rayons canaux et montre qu'ils sont composés de particules chargés positivement (des ions) produits par des gaz. Cependant, comme les ions produits par différents gaz possèdent des rapports charge/masse différents, ils ne sont pas identifiés comme une simple particule, à la différence de l'électron découvert par Joseph Thomson en 1897.
À la suite de la découverte du noyau atomique par Ernest Rutherford en 1911, Antonius van den Broek émet l'hypothèse que la place de chaque élément dans la classification périodique est égale à la charge de son noyau. Cette hypothèse est confirmée expérimentalement par Henry Moseley en 1913.
En 1919, Rutherford prouve que le noyau de l'atome d'hydrogène est présent dans les autres noyaux. Il remarque que lorsque des particules alpha sont envoyées dans un gaz d'azote, ses détecteurs de scintillation indiquent la signature de noyaux d'hydrogène. Il détermine ensuite que cet hydrogène ne peut provenir que de l'azote. Ce noyau d'hydrogène est donc présent à l'intérieur d'un autre noyau. Rutherford baptise la particule correspondante du nom de proton, d'après le neutre singulier du mot grec pour « premier », πρῶτον.
Voir aussi
Articles connexes
Liens et documents externes
- (fr) Analyse de la mesure du rayon d'un proton sur le site du CNRS
- [PDF] (en) Caractéristiques du proton (Particle Data Group)
Références
- (en) [PDF] p, Particle Data Group, 2009
- (en) Randolf Pohl et al., « The size of the proton », dans Nature, vol. 466, 8 juillet 2010, p. 213-216 (ISSN 0028-0836) [lien DOI]
- (en) H. Nishino et al., « Search for Proton Decay via p → e+ π0 and p → μ+ π0 in a Large Water Cherenkov Detector », dans Phys. Rev. Lett., vol. 102, no 14, 8 avril 2009, p. 141801-141805 [lien DOI]
- (en) S.N. Ahmed et al., « Constraints on nucleon decay via invisible modes from the Sudbury Neutrino Observatory », dans Phys. Rev. Lett., vol. 92, 10 mars 2004, p. 102004-102007 [lien DOI]
Wikimedia Foundation. 2010.


