- Di-guanosine monophosphate cyclique
-
Di-guanosine monophosphate cyclique 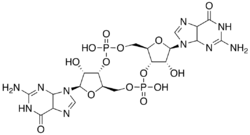
Structure de la di-guanosine monophosphate cycliqueGénéral Synonymes di-GMP cyclique, di-GMPc,
c-di-GMPNo CAS PubChem ChEBI SMILES InChI Propriétés chimiques Formule brute C20H24N10O14P2 [Isomères] Masse molaire[1] 690,4107 ± 0,0239 g·mol-1
C 34,79 %, H 3,5 %, N 20,29 %, O 32,44 %, P 8,97 %,Unités du SI & CNTP, sauf indication contraire. La di-guanosine monophosphate cyclique, également appelée diguanylate cyclique, est un second messager utilisé par de nombreuses bactéries[2], mais ne semble pas être utilisé par les archées ni par les eucaryotes. La structure de cette molécule correspond à un minuscule fragment d'ARN cyclique à deux résidus guanine, liés par deux résidus ribose-5-phosphate, formant un cycle à deux nucléotides.
Chez les bactéries, certains signaux sont transmis en produisant ou en dégradant de la di-GMP cyclique. Celle-ci est synthétisée par des enzymes ayant une activité diguanylate cyclase, protéines possédant un motif Gly-Gly-Asp-Glu-Phe, séquence de cinq acides aminés conservée dans toutes ces protéines. La dégradation de la di-GMP cyclique est réalisée par des phosphodiestérases présentant des motifs Glu-Ala-Leu ou His-Asp-Xxx-Gly-Tyr-Pro. La formation des biofilms, la motilité, la production de certains polysaccharides extracellulaires et le comportement multicellulaire déterminant la virulence des germes sont des processus dont on sait qu'ils sont modulés notamment par la di-GMP cyclique, du moins chez certains organismes.
La concentration intracellulaire de di-GMP cyclique est régulée à travers différents mécanismes. De nombreuses protéines présentant les séquences caractéristiques Gly-Gly-Asp-Glu-Phe, Glu-Ala-Leu ou His-Asp-Xxx-Gly-Tyr-Pro possèdent également d'autres domaines susceptibles de recevoir des signaux, tels que des domaines PAS. Les enzymes qui produisent ou dégradent la di-GMP cyclique se localiseraient dans des régions spécifiques des cellules, où elles agiraient sur les récepteurs au sein d'un volume réduit[2]. La di-GMP cyclique est un inhibiteur allostérique de certaines diguanylate cyclases et d'une cellulose synthase à GDP de Gluconacetobacter xylinus. Chez cette dernière, la di-GMP cyclique se lie au domaine PilZ de la protéine, celui-ci étant vraisemblablement déterminant dans le processus de régulation[3].
De récentes études ont établi que la structure des domaines PilZ de deux espèces de bactéries change complètement de conformation en se liant à la di-GMP cyclique[4],[5]. Ces résultats suggèrent assez fortement que les changements de conformation des domaines PilZ jouent un rôle déterminant dans la régulation allostérique des enzymes cibles de la di-GMP cyclique.
Notes et références
- Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
- (en) R. Tamayo, J. T. Pratt, A. Camilli,, « Roles of cyclic diguanylate in the regulation of bacterial pathogenesis », dans Annu. Rev. Microbiol., vol. 61, 2007, p. 131-148 [lien PMID, lien DOI]
- (en) Dorit Amikam et Michael Y. Galperin, « PilZ domain is part of the bacterial c-di-GMP binding protein », dans Bioinformatics, Life Sciences, Oxford Journals, vol. 22, n° 1, octobre 2005, p. 3-6. DOI:10.1093/bioinformatics/bti739
- (en) J Benach, « The structural basis of cyclic diguanylate signal transduction by PilZ domains », dans The EMBO Journal, European Molecular Biology Organization, vol. 26, no 24, 2007, p. 5153-5166 [lien PMID, lien DOI]
- (en) K. Junsang, « Structure of PP4397 reveals the molecular basis for different c-di-GMP binding modes by Pilz domain proteins », dans Journal of Molecular Biology, vol. 398, no 1, 23 avril 2010, p. 97–110 [lien PMID, lien DOI]
- Portail de la biologie cellulaire et moléculaire
- Portail de la biochimie
- Portail de la chimie
Wikimedia Foundation. 2010.
