- Catalyseur
-
Catalyseur
 Pour l'élément de pot d'échappement, voir Pot catalytique.
Pour l'élément de pot d'échappement, voir Pot catalytique. Hydrogénation d'un lien C=C sur un lit catalyseur :
Hydrogénation d'un lien C=C sur un lit catalyseur :
(1) Les réactifs ont sont adsorbés sur la surface du catalyseur et H2 est dissocié.
(2) Un atome H se lie à l'un des atomes C. L'autre atome C est attaché à à la surface.
(3) Un deuxième atome C se lie à un atome H. La molécule s'éloigne de la surface.En chimie, un catalyseur est une substance qui augmente ou ralentit la vitesse d'une réaction chimique ; il participe à la réaction mais est régénéré à la fin de la réaction. Il ne fait donc partie ni des réactifs ni des produits dans l'équation. Lorsqu’un catalyseur est utilisé pour accélérer une transformation, on dit que celle-ci est catalysée. Les catalyseurs agissent seulement sur des produits prédéterminés. Si un catalyseur accélère la réaction, il est dit positif; S'il la ralentit, il est dit négatif[1].
Les catalyseurs sont largement utilisés dans l'industrie et en laboratoire parce qu'ils augmentent considérablement la production des produits tout en minimisant les coûts de production. Dans la nature et en biochimie, certaines protéines possèdent une activité catalytique. Ils s'agit des enzymes.
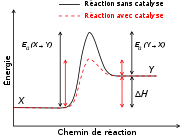 Effet d'un catalyseur positif sur l'énergie d'activation d'une réaction : elle est plus faible et la vitesse de réaction augmente.
Effet d'un catalyseur positif sur l'énergie d'activation d'une réaction : elle est plus faible et la vitesse de réaction augmente.
Le catalyseur augmente la vitesse de réaction en introduisant de nouveaux chemins de réaction (mécanisme), et en abaissant son énergie d'activation, ou énergie libre de Gibbs d'activation. Ce faisant il permet d'augmenter la vitesse, ou d'abaisser la température de la réaction. Le catalyseur ne modifie pas l'énergie libre de Gibbs totale de la réaction qui est une fonction d'état du système et n'a donc aucun effet sur la constante d'équilibre.
En plus de modifier la vitesse de réaction, le choix d'un catalyseur peut reposer sur d'autres paramètres :
- la sélectivité : un catalyseur sélectif va favoriser la production du produit désiré par rapport aux produits secondaires. Par exemple, quand on utilise l'argent métallique pour catalyser la réaction de formation de l'oxyde d'éthylène, à partir d'oxygène et d'éthylène, cette réaction est accompagnée par la formation plus favorable thermodynamiquement de CO2 et H2O ;
- la durée de vie : le catalyseur doit pouvoir demeurer intact après plusieurs cycles de réaction.
Les catalyseurs sont classés selon leur type :
Sommaire
Analogie
Le terme "modifie ou augmente la vitesse de réaction" est une façon synthétique de faire le bilan de ce qui s'est passé, mais qui, strictement parlant, est erroné. En effet, il ne s'agit plus de la même transformation chimique ! Le "chemin réactionnel" avec catalyseur n'est pas le même que sans, et c'est pourquoi la vitesse est différente : il n'y pas les mêmes barrières de potentiel à franchir. Pour aller de la face nord à la face sud de la butte Montmartre, vous pouvez passer par le Sacré-Coeur, ou faire le tour par la rue Custine, la rue Caulaincourt et le boulevard Rochechouart. C'est cette dernière solution à laquelle vous invite le catalyseur
Exemple simple
La cendre peut servir de catalyseur lors de la combustion du sucre. Le sucre, chauffé au briquet, ne produit aucune flamme. Recouvert de cendre, il peut s'enflammer et brûle d'une flamme bleue.
Bibliographie
- Lexique de chimie, Physique et chimie au lycée
- La Chimie au Lycée / la catalyse / généralités sur les catalyseurs, La Chimie au lycée
Notes et références
- ↑ (en) Association québécoise des utilisateurs de l'ordinateur au primaire-secondaire, « Facteurs qui influencent la vitesse d'une réaction », 2005, Association québécoise des utilisateurs de l'ordinateur au primaire-secondaire. Consulté le 31 mars 2009
Voir aussi
Articles connexes
Liens externes
- Geneviève Wrobel er Louis Ponsolle, Évolution de catalyseurs solides, Éducation nationale (film pédagogique ancien)
- Portail de la chimie
Catégorie : Catalyseur
Wikimedia Foundation. 2010.
