- Force Ionique
-
Force ionique
La force ionique, souvent notée I (ou FI de manière à la distinguer de l'intensité), est un des principaux facteurs influençant l'activité des ions en solution aqueuse. Elle s'exprime en mol.L-1 et est calculée de la manière suivante :
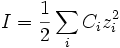
où Ci représente la concentration de l'ion i et zi son nombre de charge
Mesure de la force ionique
La meilleure solution pour déterminer la force ionique consiste à déterminer les concentrations respectives des différents ions en solution et à utiliser la formule précédente. Cependant on peut aussi se contenter d'une estimation de la force ionique connaissant la concentration totale en solides dissous (notée TDS et exprimée en mg.L-1) ou la conductivité électrique (notée SpC et exprimée en 10-6 S.cm-1) de la solution. Ces estimations utilisent les formules empiriques suivantes :
- I = 2.5 x 10-5 TDS
- I= 1.7 x 10-5 SpC
Force ionique et activité chimique
Plusieurs relations semi-empiriques permettent d'obtenir le coefficient d'activité moyen d'un électrolyte (ex : NaCl, MgSO4...) ou le coefficient d'activité d'un ion (ex : Na+, Cl-,...) en solution à partir de la valeur de la force ionique I.
Les trois formules les plus courantes sont détaillées ci-dessous (
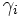 est le coefficient d'activité de l'ion i,
est le coefficient d'activité de l'ion i, 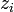 son nombre de charges et a un paramètre homogène à une longueur) :
son nombre de charges et a un paramètre homogène à une longueur) :- Formule de Debye-Hückel limite (DHL) :
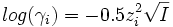
- Formule de Debye-Hückel étendue (DHE) :
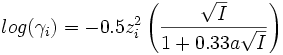
- Approximation de Güntleberg (AG) :
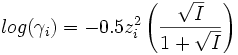
La formule (DHL) n'est valable que si la force ionique I est inférieure à 10-2.3 mol.L-1 car elle considère chaque ion comme une charge ponctuelle. Cette approximation ne peut plus être faite pour une solution concentrée. Les formules (DHE) et (AG) ne sont quant à elles valables que si I est inférieure à 0.1 mol.L-1.
D'autres formules ou théories plus complexes ont donc été développées pour mettre en relation le coefficient d'activité et la force ionique lorsque I est supérieure à 0.1 mol.L-1. C'est notamment le cas de l'équation de Davies, du modèle de Pitzer ou de la théorie SIT.
- Loi de Davies pour l'eau à 298 K et I<0.5 M :
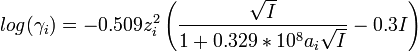 où ai est le diamètre effectif moyen des ions hydratés et I la force ionique
où ai est le diamètre effectif moyen des ions hydratés et I la force ionique
- Portail de la chimie
Catégories : Propriété chimique | Électrochimie | Réaction chimique
Wikimedia Foundation. 2010.
