- ARN de transfert
-
Acide ribonucléique de transfert
L'acide ribonucléique de transfert, ou ARN de transfert ou ARNt, est un court ARN, long de 70 à 100 nucléotides, qui intervient lors de la synthèse des protéines dans la cellule. Les cellules vivantes contiennent quelques dizaines de sortes d'ARNt, chacune d'elle étant dédiée au transfert de l'un des 20 acides aminés au ribosome, la machine cellulaire responsable de l'assemblage des protéines à partir de l'information génétique contenue dans l'ARN messager.
Sommaire
Rôle dans la traduction du message génétique
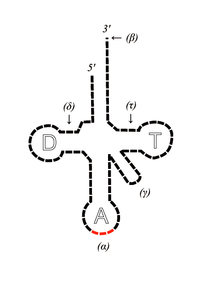
Les ARNt sont des polymères, contenant des régions simple brin et double brin, et composés de ribonucléotides. Leur fonction dans la cellule est d'assurer la correspondance entre l'information génétique portée par l'ARN messager, et les acides aminés contenus dans la protéine codée par cet ARN messager (ARNm). Ils sont les acteurs clés de la traduction du code génétique. Les ARNt portent l'un des 20 acides aminés attaché par une liaison ester à leur extrémité 3'-OH (β sur la figure 1) et transportent celui-ci au ribosome. Trois des nucléotides de chaque ARNt forment un anticodon (α sur la figure 1) spécifique de l'acide aminé. L'anticodon s'apparie au codon sur l'ARN messager assurant ainsi la correspondance entre codon et acide-aminé, conformément au code génétique.
L'interaction codon-anticodon s'effectue dans le ribosome qui vérifie la complémentarité des bases de l'ARNm et de l'ARNt. Lorsque celle-ci est réalisée, le ribosome catalyse l'allongement de la chaîne protéique en cours de synthèse (réaction de transpeptidation) et avance sur l'ARN messager.
Une fois que l'ARNt a été utilisé par le ribosome, il ne porte plus d'acide aminé à son extrémité 3'-OH. Il est alors rechargé par une enzyme spécifique, appelée aminoacyl-ARNt synthétase, qui catalyse l'estérification de l'acide aminé spécifique. Il existe en général 20 aminoacyl-ARNt synthétases, une pour chaque acide aminé.
Structure des ARNt
La plupart des ARNt ont une structure canonique, conservée chez toutes les espèces. Ils se replient sur eux mêmes, formant des appariements intramoléculaires de nucléotides pour donner une structure à quatre tiges ou bras, appelée "feuille de trèfle" (figure 1). La tige supérieure, qui porte les extrémités 5' et 3' s'appelle le bras accepteur, car c'est lui qui porte (accepte) l'acide aminé. La tige inférieure, terminée par la boucle de l'anticodon s'appelle bras anticodon, les deux autres tiges s'appellent bras T et bras D (figure 1), car ils portent des ribonucléotides modifiés, autres que A, G, C et U : la ribothymidine (T), pour le bras T et la dihydrouridine (D) pour le bras D.
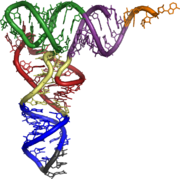
Ces quatre tiges se replient en trois dimensions pour former une structure en forme de "L" (figure 2)[1]. Celle-ci résulte de l'empilement coaxial deux à deux des tiges : le bras T sur bras accepteur et le bras anticodon sur le bras D. Cette structure en forme de "L" est stabilisée par des interactions entre la boucle T et la boucle D, qui fait intervenir des nucléotides modifiés, que l'on retrouve conservés dans la plupart des ARNt. L'extrémité 5' ne présente qu'un seul phosphate. L'extrémité 3' comporte quatre nucléotides non appariés et se termine toujours par le trinucléotide CCA , dont l'adénosine terminale porte la fonction OH où est estérifié l'acide aminé,
Nucléotides modifiés
Les ARNt se caractérisent par la présence d'un grand nombre de nucléotides non-canoniques, ou nucléotides modifiés, dans leur séquence. Ces modifications de nucléotides : méthylation, isomérisation, thiolation, réduction... sont incorporés post-transcriptionnellement par des enzymes spécialisées.
On trouve deux grandes classes de nucléotides modifiés dans l'ARNt : ceux qui participent à l'établissement de la stabilisation de la structure tridimensionnelle, par exemple la ribothymidine et la pseudouridine dans la boucle T, et ceux qui sont localisés dans la boucle de l'anticodon et qui interviennent directement dans l'interaction avec l'ARNm et dans la lecture des codons, comme par exemple l'inosine ou ses dérivés.
Certaines modifications de nucléotides sont très simples : ajout d'un groupement méthyle (CH3) et d'autres sont très complexes et nécessitent l'intervention de plusieurs enzymes.
Synthèse
Les ARNt sont synthétisés par transcription à partir de de gènes situés dans l'ADN génomique. Chez les bactéries, on trouve fréquemment plusieurs ARNt regroupés sous forme d'opérons qui sont transcrits sous forme d'un seul précurseur qui est ensuite clivé. Chez les eucaryotes, les ARNt sont spécifiquement transcrits par l'ARN polymérase III.
Le transcrit primaire est en général maturé par un certain nombre d'enzymes, qui clivent les extrémités. La ribonucléase P mature l'extrémité 5', et plusieurs ribonucléases sont impliquées dans la maturation du coté 3'. Une enzyme spécifique, l'ARNt nucléotidyl-tranférase ou "CCAse" intervient ensuite pour ajouter ou réparer l'extrémité 3' qui se termine par la séquence CCA.
Les ARNt subissent alors plusieurs étapes de modifications de nucléotides et éventuellement l'épissage d'introns que l'on observe parfois dans certains ARNt eucaryotes..
Codon, anticodon et décodage
Lors du processus de traduction, les trois bases de l'anticodon de l'ARNt s'apparient au codon de l'ARNm. L'interaction entre le premier nucléotide de l'anticodon et le troisième nucléotide du codon est souvent un appariement non-canonique, appelé paire wobble ou "bancale", différente d'un appariement Watson-Crick classique (A-U ou G-C). Cet appariement implique parfois un nucléotide modifié de l'ARNt.
Ces appariements wobble permettent de réduire le nombre d'ARNt nécessaires à la traduction du code génétique, en autorisant la lecture de différent codons synonymes par un seul et même ARNt. Ainsi, l'ARNt spécifique de l'isoleucine dans la souris à un anticodon IAU, où I est une inosine qui peut s'apparier aux trois codons AUU, AUC et AUA, en formant des paires I-U, I-C et I-A.
ARNt et aminoacyl-ARNt synthétase
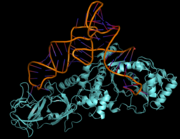
L'estérification de l'acide aminé spécifique à l'extrémité 3'-OH de l'ARNt est une étape clef du décodage du code génétique. On appelle cette étape l'aminoacylation et, dans toutes les cellules vivantes, il existe une vingtaine d'enzymes, les aminoacyl-ARNt synthétases, dont la fonction est de catalyser cette étape.
Chacune de ces enzymes est spécifique d'un acide aminé donné et reconnait le ou les ARNt correspondant. Ces enzymes sont capables de discriminer les ARNt spécifiques de son acide aminé, en reconnaissant des motifs de nucléotides particuliers, souvent dans l'anticodon lui-même, mais parfois dans d'autres régions de l'ARNt. Cette reconnaissance est cruciale, car il n'y a plus de contrôle qualité ultérieur au niveau du ribosome : toute erreur dans l'aminoacylation se traduira donc ensuite par une erreur dans le décodage du message génétique.
L'aminoacylation comprend deux étapes: l'activation de l'acide aminé par adénynylation et la formation du lien ester entre l'acide aminé et l'hydroxyle 2' ou 3' du ribose du nucléotide 3' de l'ARN de transfert.
La première étape consiste en l'attaque nucléophile de l'acide aminé sur une molécule d'ATP reconnue par l'aminoacyl-ARNt synthétase. L'oxygène de cet acide aminé brisera le lien entre le premier et le second des trois phosphates de l'ATP. Ainsi, il se formera un nouveau lien, un lien anhydride, entre l'acide aminé et l'AMP (adénosine monophosphate) ainsi généré. L'acide aminé est ainsi activé sous forme d'aminoacyl-adénylate, qui reste lié à l'enzyme.
Deuxième étape: catalyse d'un lien ester par l'ARNt. En utilisant l'énergie contenue dans l'aminoacyl-adénylate, l'ARN de transfert fera une attaque nucléophile sur l'acide aminé. Cela créera un lien ester, qui sera encore riche en énergie.
Après ces deux étapes, l'ARN de transfert est prêt à amener son acide aminé spécifique vers le ribosome et l'ARN messager.[2]
Historique
L'existence des ARNt, comme "adapteurs" entre les acides aminés et l'ARN messager, a été postulée par Francis Crick [3], avant que ceux-ci ne soient effectivement découverts par Hoagland et Zamecnick en 1958[4]
C'est également Francis Crick qui a formulé l'hypothèse de l'interaction "bancale" (en:wobble hypothesis) qui permet d'expliquer le fait qu'un ARNt donné puisse lire plusieurs codons synonymes.
Notes et références
- ↑ Kim S.H., Suddath F.L., Quigley G.J., McPherson A., Sussman J.L., Wang A.H., Seeman N.C., Rich A., « Three-dimensional structure of yeast phenylalanine transfer RNA », dans Science, vol. 185, p. 435-440 [lien PMID]
Robertus J.D., Ladner J.E., Finch J.T., Rhodes D., Brown R.S., Clark B.F., Klug A., « Structure of yeast phenylalanine tRNA at 3 Å resolution », dans Nature, vol. 250, p. 546-551 [lien PMID] - ↑ Molecular cell biology, Lodish
- ↑ FHC Crick (1958) On protein synthesis. Symp. Soc. Exp. Biol., 12: 138–163.
- ↑ MB Hoagland, ML Stephenson, JF Scott, LI Hecht, PC Zamecnik (1958) A soluble ribonucleic acid intermediate in protein synthesis J. Biol. Chem., 231:241-257.[1]
Voir aussi
Liens internes
Liens externes
- (en) Compilation des séquences d'ARNt à l'Université de Bayreuth
- (en) G~tRNA~db: The Genomic tRNA Database
- Portail de la biologie
- Portail de la biologie cellulaire et moléculaire
Catégorie : ARN - ↑ Kim S.H., Suddath F.L., Quigley G.J., McPherson A., Sussman J.L., Wang A.H., Seeman N.C., Rich A., « Three-dimensional structure of yeast phenylalanine transfer RNA », dans Science, vol. 185, p. 435-440 [lien PMID]
Wikimedia Foundation. 2010.