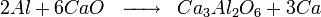- 7440-70-2
-
Calcium
 Calcium protégé sous atmosphère d'argon.
Calcium protégé sous atmosphère d'argon.
Le calcium est un élément chimique, de symbole Ca et de numéro atomique 20.
C'est un métal alcalino-terreux gris et mou qui ne se trouve jamais à l'état de corps pur dans la nature. Il est le cinquième élément le plus abondant de la croûte terrestre (plus de 3 %) et est essentiel pour la matière organique : formation des os, des dents et des coquilles. Le calcium joue également un rôle très important en physiologie cellulaire.
Sommaire
Histoire
La chaux était déjà préparée par les Romains dès le premier siècle, mais ce n'est qu'en 1808 que le calcium fut découvert. En apprenant que Jöns Jacob Berzelius et Magnus Martin Pontin avaient préparé un amalgame de calcium par électrolyse de la chaux dans du mercure, Sir Humphry Davy fut capable d'isoler le métal impur.
Caractéristiques notables
Le calcium peut être produit par électrolyse du fluorure de calcium mais plus couramment par réduction sous vide de la Chaux (CaO) par de la poudre d'aluminium.
Il brûle avec une flamme jaune-rouge ; exposé à l'air sec il forme une couche protectrice blanche d'oxyde et de nitrure. Il réagit violemment avec l'eau dont il déplace l'hydrogène et forme alors de l'hydroxyde de calcium Ca(OH)2.
Applications physiques du calcium métal
- agent réducteur dans l'extraction d'autres métaux tels que l'uranium, le zirconium, et le thorium ;
- désoxydant, désulfurant ou décarburant pour différents alliages ferreux et non-ferreux ;
- utilisé, parfois en association avec le magnésium, pour éliminer le bismuth du plomb (débismuthage) ;
- agent d'alliage utilisé dans la production d'alliages de l'aluminium, du béryllium, du cuivre, du plomb et du magnésium.
Composés
- carbonate de calcium CaCO3, très répandu dans la nature, car c'est le composant de base des roches calcaires ; c'est par calcination du calcaire que l'on obtient la chaux vive ; voir aussi : calcite, aragonite ;
- oxyde de calcium CaO (chaux vive) et hydroxyde de calcium Ca(OH)2 (chaux éteinte) ;
- aluminate de calcium (Al2O3,3CaO) : un des composants du clinker, et utilisé pour la confection de mortiers réfractaires ;
- carbure de calcium CaC2 (communément appelé carbure; son hydrolyse produit de l'acétylène) ;
- halogénures de calcium :
- chlorure de calcium CaCl2 parfois utilisé comme sel de déneigement en remplacement du chlorure de sodium ;
- fluorure de calcium CaF2 (fluorine) ;
- iodure de calcium CaI2 ;
- bromure de calcium CaBr2 ;
- nitrure de calcium Ca3N2 ;
- peroxyde de calcium CaO2 ;
- phosphure de calcium Ca3P2 (son hydrolyse génère de la phosphine PH3) ;
- sulfure de calcium CaS;
- phosphate de calcium Ca3(PO4)2 ;
- silico-calcium (alliage calcium-silicium), utilisé en sidérurgie ;
- hypochlorite de calcium Ca(ClO)2 ;
- anhydrite sulfate de calcium anhydre CaSO4, déhydratant
- bassanite sulfate de calcium semi-hydraté 2CaSO4 H2O principal contituant de la poudre à plâtre avant usage.
- gypse sulfate de calcium hydraté CaSO4 2H2O, principal contituant du plâtre après durcissement.
Dans l'alimentation
Le calcium est de loin le métal le plus abondant dans le corps. Il est majoritairement entreposé dans les os, dont il fait partie intégrante. Il contribue à la formation de ces derniers, ainsi qu'à celle des dents, et au maintien de leur santé. Le calcium joue aussi un rôle essentiel dans la coagulation du sang, le maintien de la pression sanguine et la contraction des muscles, dont le cœur.
Importance physiologique
Le calcium est un composant important d'un régime sain. Contrairement à ce que l’on croit, ce ne sont pas les produits laitiers qui représentent la meilleure source de calcium, car la proportion calcium/phosphore n’y est pas bonne. Le lait contient en effet trop de phosphore, ce qui peut entraîner une calcification insuffisante. Le corps a besoin de magnésium, de silicium, de vitamines A, C et D, de protéines et de phosphore pour bien l’assimiler.
Le calcium intervient dans la formation des os et des dents ; son déficit va donc les affecter (ostéoporose, problèmes de croissance). Son excès provoque l'apparition de calculs rénaux. De plus, il intervient dans les échanges cellulaires et est, de ce fait, vital. Son taux sanguin (calcémie) est extrêmement régulé, pour éviter des variations fatales à l'organisme. Les hormones impliquées dans cette régulation sont la parathormone et la calcitonine, bien que le rôle « hormonal » de la calcitonine soit discuté étant donné que son augmentation n'entraîne pas de modification sur le métabolisme phospho calcique. Il serait plus juste de considérer la parathormone et le calcitriol (dérivé de la vitamine D) comme les deux principales hormones du métabolisme phospho calcique. Voir aussi métabolisme du calcium. Le calcium sert aussi à réguler le pH corporel, il est relargué des os lorsqu'il y a une acidification du milieu interne provoquée par une consommation de produit acidifiant (protéines, laits…) et une faible consommation de végétaux qui ont un effet alcalinisant.
Le risque de cancer du côlon semble diminué par un régime riche en calcium. La majorité des études épidémiologiques indiquent que les gens dont l'alimentation contient le plus de calcium ont moins fréquemment un cancer colorectal. Plus de 25 publications scientifiques montrent que le calcium diminue la cancérogenèse colique chez les rongeurs[1]. Enfin, trois essais cliniques contrôlés montrent que la prise d'un supplément de carbonate de calcium (1-2 g/j) diminue la récurrence des polypes de 15 à 30 % chez des volontaires[1] : Il semble donc que le calcium prévienne le cancer colorectal.
Présence dans les aliments
Article détaillé : Teneur en calcium des aliments.Le calcium est présent dans plusieurs aliments de consommation courante.
Les produits laitiers constituent la principale source de calcium alimentaire (plus des deux tiers). Le calcium y est présent sous une forme permettant une bonne absorption intestinale (de l'ordre de 30 %) et n'augmentant pas l'excrétion urinaire, permettant au final une bonne biodisponibilité.
D'autres aliments contiennent du calcium : eau du robinet, amandes, persil, figues, cresson, cacao, pissenlit, jaune d'œuf, graines de sésame, épinard, certains poissons… Le calcium d'origine végétale est cependant le plus souvent moins absorbable car il est en grande partie insolubilisé de façon irréversible sous forme de phytates (soja) ou d'oxalates (épinard, cacao). Ainsi l'absorbabilité du calcium de l'épinard ne dépasserait pas 5 %.[réf. nécessaire]
Pour l'évaluation de la biodisponibilité réelle, il faut aussi tenir compte des facteurs alimentaires qui influencent la perte urinaire du calcium absorbé. Ainsi, l'absorption simultanée de phosphore diminue l'excrétion urinaire de calcium. À l'opposé, les composants « acidogènes » du régime, comme les sulfates (en particulier dans les eaux minérales sulfatées calciques), augmentent la calciurie.
Enfin, la fixation du calcium absorbé dans le tissu osseux (prévenant l'ostéoporose) dépend de nombreux autres facteurs, en particulier hormonaux (voir ci-dessus).
Les apports journaliers recommandés sont de 700 mg par jour chez l'adulte[2].
En tant que médicament
L'absorption de calcium sous forme de comprimés permet d'augmenter son apport journalier si ce dernier n'est pas optimal. Il est parfois associé à la prise de vitamine D. Il semble être efficace dans le traitement préventif de l'ostéoporose de la personne âgée, en diminuant le taux de fractures ainsi que les indices de déminéralisation osseuse[3]. L'effet secondaire le plus noté reste une constipation[4]. Cependant cette supplémentation pourrait être associée avec un risque majoré de maladies cardio-vasculaires[5], même si cette donnée reste discutée[6].
Production industrielle
Le calcium est produit par aluminothermie de la chaux, c’est-à-dire une réaction d'oxydo-réduction où la chaux − l’oxyde de calcium CaO − est réduite par l'aluminium dans des fours où l'on établit le vide.
De façon simplifiée :
On introduit dans le four des pastilles formées à partir d'un mélange de chaux et de poudre d'aluminium. Le four est chauffé électriquement ou à l'aide d'un combustible fossile. Le calcium formé au cours de la réaction se dégage sous forme de vapeur, et l'on dispose (dans le circuit d'aspiration établissant le vide dans le four) un condenseur où il vient se déposer. Le résidu de la réaction est de l'aluminate de calcium (combinaison d'alumine et de chaux).
Notes et références
- ↑ a et b Chimioprévention
- ↑ [pdf](fr) Ostéoporose : stratégies de prévention et de traitement
- ↑ Tang BMP, Eslick GD, Nowson C, Smith C, Bensoussan A, Use of calcium or calcium in combination with vitamin D supplementation to prevent fractures and bone loss in people aged 50 years and older: a meta-analysis, Lancet 2007; 370:657-666
- ↑ Reid IR, Mason B, Horne A et als. Randomized controlled trial of calcium in healthy older women, Am J Med, 2006;119:777-85
- ↑ Bolland MJ, Barber PA, Doughty RN et Als. Vascular events in healthy older women receiving calcium supplementation: randomised controlled trial, BMJ, 2008;336:262-266
- ↑ Hsia J, Heiss G, Ren H et als. Calcium/vitamin D supplementation and cardiovascular events, Circulation, 2007;115:846-54
Voir aussi
Articles connexes
- Antagoniste du calcium
- Calcémie
- Catégorie:Composé du calcium
- Teneur en calcium des aliments
- Macro-élément
- Métabolisme du calcium
- Calcium 48
Lien externe
s1 s2 g f1 f2 f3 f4 f5 f6 f7 f8 f9 f10 f11 f12 f13 f14 d1 d2 d3 d4 d5 d6 d7 d8 d9 d10 p1 p2 p3 p4 p5 p6 1 H He 2 Li Be B C N O F Ne 3 Na Mg Al Si P S Cl Ar 4 K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Kr 5 Rb Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te I Xe 6 Cs Ba La Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po At Rn 7 Fr Ra Ac Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Lr Rf Db Sg Bh Hs Mt Ds Rg Cp Uut Uuq Uup Uuh Uus Uuo 8 Uue Ubn * Ute Uqn Uqu Uqb Uqt Uqq Uqp Uqh Uqs Uqo Uqe Upn Upu Upb Upt Upq Upp Uph Ups Upo Upe Uhn Uhu Uhb Uht Uhq Uhp Uhh Uhs Uho ↓ g1 g2 g3 g4 g5 g6 g7 g8 g9 g10 g11 g12 g13 g14 g15 g16 g17 g18 * Ubu Ubb Ubt Ubq Ubp Ubh Ubs Ubo Ube Utn Utu Utb Utt Utq Utp Uth Uts Uto Métalloïdes Non-métaux Halogènes Gaz rares Métaux alcalins Métaux alcalino-terreux Métaux de transition Métaux pauvres Lanthanides Actinides Superactinides Éléments non classés - Portail de la chimie
Catégories : Produit chimique qui réagit avec l'eau | Calcium | Élément chimique | Métal alcalino-terreux | Minéral alimentaire
Wikimedia Foundation. 2010.