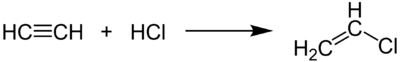- Acetylene
-
Acétylène
Acétylène 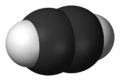
Structure tridimensionnelle de l'acétylène Général Nom IUPAC éthyne Synonymes Ethine No CAS No EINECS PubChem SMILES InChI Apparence gaz incolore dissous dans l'acétone sous pression.[1] Propriétés chimiques Formule brute C2H2 [Isomères] Masse molaire 26,0373 g∙mol-1
C 92,26 %, H 7,74 %,Propriétés physiques T° fusion -80,7 °C (point triple) [2] T° ébullition -84,7 °C [2] Solubilité 1,185 g⋅l-1 (eau,20 °C) [3] T° d’auto-inflammation 305 °C [3] Point d’éclair Gaz Inflammable[1] Limites d’explosivité dans l’air 2.3 - 100 Vol.% [3] Pression de vapeur saturante à 20 °C : 4460 kPa[1] Point critique 35,2 °C
61.38 bar
0.1122 l/mol [4]Point triple -80,8 °C à 1.2825 bar [5] Thermochimie S0gaz, 1 bar 200,93 J⋅mol-1⋅K-1 (1 bar) [6] ΔfH0gaz 226,73 kJ⋅mol-1 [6] Cp 44,04 J⋅mol-1⋅K-1 à 25 °C [6] Précautions Directive 67/548/EEC 
F+Phrases R : 5, 6, 12, Phrases S : (2), 9, 16, 33, Transport 239 3374 NFPA 704 SIMDUT[7] 


SGH[8] 

DangerÉcotoxicologie LogP 0.37[1] Unités du SI & CNTP, sauf indication contraire. L’acétylène (appelé éthyne par la nomenclature IUPAC) est un composé chimique hydrocarbure de la classe des alcynes de formule brute C2H2. Il a été découvert par Edmund Davy en Angleterre en 1836. C’est l’alcyne le plus simple, constitué de deux atomes de carbone et deux d’hydrogène. Les deux atomes de carbone sont reliés par une triple liaison qui contient la majorité de son énergie chimique.
Sa structure est linéaire :
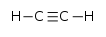
Berthelot, en 1862, fut le premier à synthétiser l’acétylène, dans un appareil surnommé œuf de Berthelot, par la production d'un arc voltaïque entre deux électrodes de graphite baignant dans une atmosphère d’hydrogène :
-
- 2 C + H2 → C2H2
L’acétylène est un gaz incolore, pratiquement inodore quand il est pur (mais on lui attribue généralement un odeur d'ail caractéristique qui provient des impuretés, notamment la phosphine lorsqu'il est produit à partir du carbure de calcium.
L'acétylène est extrêmement inflammable à température et pression standard. Il peut à l'état libre se décomposer spontanément, de façon explosive lorsque la pression est supérieure à 100 kPa, c'est pour cette raison qu’il est stocké dissous dans l’acétone ou le diméthylformamide (DMF), eux mêmes inclus dans une matière poreuse stabilisatrice.Sommaire
Utilisation
Des applications de l’acétylène :
- la forte teneur en carbone donne une flamme très éclairante utilisée par exemple dans les lampes à acétylène (calebombe) des spéléologues ;
- la haute chaleur de combustion de l’acétylène permet d'atteindre de haute température (3 200 °C dans l'oxygène pur), ce qui en fait un candidat idéal comme combustible pour la soudure. Une des particularités de la combustion de l'acétylène est sa combustion en 2 temps: l'acétylène réagit en premier avec l'oxygène pour donner du monoxyde de carbone et de l'hydrogène, puis ces produits réagissent dans un second temps pour former du dioxyde de carbone et de l'eau. Le monoxyde de carbone et l'hydrogène sont des gaz réducteurs, ce qui en fait des réactifs appréciés en soudure de l'acier pour réduire les oxydes de fer issus de la réaction entre le fer et l'oxygène à haute température, permettant ainsi une meilleure homogénéisation de la soudure et donc une meilleure qualité de cette dernière. La soudure à l'acétylène permet l'assemblage de métaux variés (aciers, inox, alliages de cuivre), mais aussi sous certaines conditions l'aluminium allié au silicium ;
- la réaction de l’acétylène avec l’acide chlorhydrique est une manière de produire du chlorure de vinyle (monomère du chlorure de polyvinyle).
Propriétés physico-chimiques
Les propriétés chimiques de l'acétylène s'expliquent en grande partie par la présence dans sa molécule d'une triple liaison résultant de la superposition d'une liaison simple s (provenant de la fusion de deux orbitales sp) et de deux liaisons p résultant de la fusion de deux orbitales 2p. Cette liaison, de longueur 0,124 nm et caractérisée par une énergie de 811 kJ, est moins stable que les liaisons simples (614 kJ) et doubles (347,3 kJ), et par conséquent plus réactive.
Les réactions de l’acétylène
- L’acétylène et les monoalkylacétylènes sont les seuls hydrocarbures qui ont un hydrogène ayant un caractère acide et qui peut être échangé par un métal.
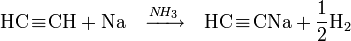
- Certains acétylénures comme
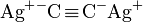 sont détonants au choc.
sont détonants au choc.
- L’acétylène réagit avec l’acide cyanhydrique pour former de l’acrylonitrile, monomère de l’acrylonitrile butadiène styrène (ABS) et du styrène-acrylonitrile (SAN).
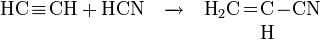
- L'acétylène donne le benzène par polymérisation sous l'action de la chaleur.
- Par dimérisation en présence de catalyseurs, on obtient du vinylacétylène auquel on ajoute du chlorure d'hydrogène pour obtenir du chloroprène, monomère du polychloroprène ou néoprène.
Production et synthèse
L’acétylène n’existe pas à l'état naturel (d'autres alcynes existent ponctuellement dans les hydrocarbures). Les principales méthodes industrielles pour produire l’acétylène sont :
Méthode carbochimique
On utilise comme matière première le calcaire et le coke ou du charbon de bois. Dans un four à haute température (1 700 °C minimum) chauffé par un courant électrique passant dans le milieu réactionnel en fusion, il se produit du carbure de calcium selon les réactions :
-
- CaCO3 → CaO + CO2
-
- CaO + 3 C + 108 300 calories → CaC2 + CO
Chez l’utilisateur, le carbure réagit avec l’eau pour produire l’acétylène.
-
- CaC2 + 2 H2O → C2H2 + Ca(OH)2 + 31 000 calories
Combustion partielle du méthane
La combustion partielle du méthane produit aussi de l’acétylène :
-
- 3 CH4 + 3 O2 → C2H2 + CO + 5 H2O
Déshydrogénation des alcanes
Les alcanes les plus lourds du pétrole et du gaz naturel sont craqués en molécules plus légères qui sont deshydrogénées à haute température.
-
- C2H6 → C2H2 + 2 H2
Liens et documents externes
References
- ↑ a , b , c et d ACETYLENE, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- ↑ a et b (en) David R. Lide, CRC Handbook of Chemistry and Physics, 89th Edition, CRC Press/Taylor and Francis, Boca Raton, 2009, « Physical Constants of Organic Compounds »
- ↑ a , b et c Entrée de « Acetylene » dans la base de données de produits chimiques GESTIS de la BGIA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 14 avril 2009 (JavaScript nécessaire)
- ↑ Clark, A.M.; Din, F., Equilibria Between Solid, Liquid, and Gaseous Phases at Low Temperature binary systems acetylene - carbon dioxide, acetylene - ethylene and acetylene - ethane, Trans. Faraday Soc., 1950, 46, 901.
- ↑ Tsonopoulos, C.; Ambrose, D., Vapor-Liquid Critical Properties of Elements and Compounds. 6. Unsaturated Aliphatic Hydrocarbons, J. Chem. Eng. Data, 1996, 41, 645-656.
- ↑ a , b et c Acetylene sur http://www.nist.gov. Consulté le 14 avril 2009
- ↑ « Acétylène » dans la base de données de produits chimiques Reptox de la CSST (organisme canadien responsable de la sécurité et de la santé au travail), consulté le 24 avril 2009
- ↑ Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
Voir aussi
- Portail de la chimie
Catégories : Produit chimique extrêmement inflammable | Alcyne -
Wikimedia Foundation. 2010.