- Phosphine
-
Phosphine 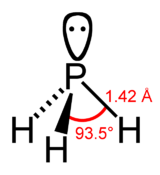
Structure de la phosphine Général Nom IUPAC Phosphane (IUPAC)
Phosphine
Hydrure de phosphore
Hydrogène phosphoréNo CAS No EINECS Apparence gaz comprimé liquéfié incolore[1]. Propriétés chimiques Formule brute PH3 Masse molaire[3] 33,99758 ± 0,00021 g·mol-1
H 8,89 %, P 91,11 %,Moment dipolaire 0,5740 ± 0,0003 D [2] Propriétés physiques T° fusion -133 °C [1] T° ébullition -87,7 °C [1] Solubilité dans l'eau à 17 °C : 26 ml/100 ml[1] Masse volumique 0,8 g·cm-3 [1] T° d'auto-inflammation 38 °C [1] Point d’éclair Gaz Inflammable[1] Limites d’explosivité dans l’air en volume % dans l'air : 1.8-[1]? Pression de vapeur saturante à 20 °C : 4 186 kPa [1] Point critique 65,4 bar, 51,35 °C [4] Thermochimie ΔvapH° 14,6 kJ·mol-1 (1 atm, -87,75 °C)[5] Propriétés électroniques 1re énergie d'ionisation 9,869 ± 0,002 eV (gaz)[6] Cristallographie symbole de Pearson  [7]
[7]Classe cristalline ou groupe d’espace P213 (n°198) [7] Strukturbericht D1[7] Structure type NH3 [7] Précautions Directive 67/548/EEC 
T+
F+
NPhrases R : 12, 17, 26, 34, 50, Phrases S : 1/2, 28, 36/37, 45, 61, [8] Transport 263 2199 [9]NFPA 704 SIMDUT[10] 


SGH[11] 




DangerÉcotoxicologie Seuil de l’odorat bas : 0,01 ppm
haut : 5 ppm[12]Unités du SI & CNTP, sauf indication contraire. La phosphine est le nom commun d'un gaz constitué d' hydrure de phosphore (dont le nom officiel et international (Code IUPAC) est phosphane).
Il s'agit d'un gaz incolore, très toxique et inflammable (utilisé pour ces raisons comme agent de fumigation à des fins biocides). Son point d'ébullition est de -88 °C à 1 atm.
La phosphine pure est inodore, mais la « phosphine technique » a une odeur extrêmement déplaisante évoquant l'ail ou le poisson pourri, à cause de la présence de « phosphine substituée » et de diphosphine (P2H4).Sa formule est PH3. Elle peut par exemple résulter de l'action d'un acide sur un sel d'aluminium (phosphure d'aluminium) ou de magnésium (phosphure de magnésium) ou tout simplement d'une réaction de ces sels avec l'eau où le sel est hydrolysé.
Exemple : AlP+ 3H2O → PH3 + Al(OH)3
phosphure d'aluminium + eau → phosphine (gaz) + hydroxyde d'aluminium.
Sommaire
Utilisation
- Armes chimiques (maintenant interdites par un traité international)
- Rodenticide utilisé pour tuer des taupes ou d'autre micromammifères jugées « nuisibles ».
- Dopant dans l'industrie des semi-conducteurs.
- Destruction d'insectes (insecticide) et d'acariens (acaricide) dans les denrées et semences stockées (fûts, silos, cales de bateaux, etc)
Précautions
La phosphine est corrosive pour les métaux et moindrement pour les plastiques (ces derniers n'étant pas attaqués si l'air contient de la phosphine, mais qu'il est totalement déshydraté).
Les sels de phosphure d'aluminium et de tous autres métaux, doivent être placés de telle façon à ce qu'ils n'aient pas accès à de l'humidité ambiante, de l'eau ou un acide.
En tant que biocide, ce produit ne peut être appliqué que par des entreprises et du personnel agréé et en France sous le contrôle des services de la protection des végétaux (SRPV).Structure et propriétés
Historique
Tout au long du siècle passé, PH3 a été considéré comme un composé d’origine exclusivement industrielle.
Son existence sur Terre était uniquement attribuée à une origine extraterrestre, comme la schreibersite météorique (Fe3P).
En 1968, Iverson a détecté du phosphure de fer (Fe2P) biogénique, généré par des processus de corrosion bactérienne du fer. Par la suite, du PH3 naturel gazeux a été mis en évidence parmi les constituants de l’atmosphère des planètes (Jupiter, en 1974, et Saturne, en 1975).La phosphine n’a pas été détectée sur Terre avant 1988.[réf. nécessaire] Du PH3 sous forme gazeuse ou complexée a par la suite été trouvé dans des sites d’émission de méthane et dans divers environnements tels que les zones humides et marécageuses, les matières en suspension dans l'eau et les sédiments (fluviaux et marins), ainsi que dans certains excréments et le fumier (Gassmann et al., 1996).
Chimie
La phosphine peut être préparée de différentes manières. Industriellement, elle s'obtient par réaction du phosphore et de l'eau en milieu acide ou en voie basique par la réaction du phosphore blanc avec l'hydroxyde de sodium, formant par la même réaction de hypophosphite de sodium.
P4 + 4H2O → H3PO4 + PH3 + H2
ou
P4 + 3NaOH + 3H2O → 3NaH2PO2 + PH3
Elle peut s'obtenir par hydrolyse d'un phosphure métallique comme le phosphure d'aluminium ou le phosphure de calcium.
La phosphine pure PH3, sans trace de phosphène P2H4, peut s'obtenir par action de l'hydroxyde de potassium sur l'iodure de phosphonium (PH4I).
On appelle aussi « phosphines » les dérivés de PH3. Ceux-ci sont des dérivés alkylés ou arylés, tout comme les amines sont des dérivés de l'ammoniac. Parmi les exemples courants, la triphénylphosphine ((C6H5)3P) et le BINAP, sont toutes deux utilisées comme ligands dans des complexes métalliques (catalyseur de Wilkinson). De telles phosphines sont souvent présentées comme co-catalyseurs dans des réactions telles que le couplage de Sonogashira.
Ne pas confondre la phosphine avec le phosgène (COCl2), ce dernier ne contenant en réalité pas de phosphore.
Utilisation comme agent fumigène et gazeux biocide
Pour l'utilisation biocide agricole, on utilise de la phosphine gazeuse pure ou en mélange avec un gaz inerte, dioxyde de carbone ou azote pour supprimer le risque d'inflammabilité ou d'explosivité, des pastilles de phosphure d'aluminium, de calcium ou de zinc qui relâchent de la phosphine au contact de l'eau atmosphérique (ou de l'acide de l'estomac des rongeurs). Ces pastilles contiennent aussi des agents pour réduire le potentiel d'inflammation ou d'explosion de la phosphine produite.
À cause du bannissement du précédemment populaire fumigène bromure de méthyle dans le cadre du protocole de Montréal, la phosphine est le seul fumigène encore largement utilisé, économiquement viable et qui réagit rapidement qui ne laisse pas de résidus sur les produits engrangés surtout sous sa forme gazeuse.
Des parasites et espèces dites nuisibles ayant développé une grande résistance à la phosphine sont apparus et devenus courants en Asie, Australie et au Brésil. De telles résistances sont probables dans d'autres régions et peuvent ne pas être suivies de près.Articles connexes
Références
- E. Fluck, The chemistry of phosphine, Topics in Current Chemistry Vol. 35, 64 pp (1973)
- A.D.F. Toy, The Chemistry of Phosphorus, Pergamon Press, Oxford, UK (1973)
- WHO (World Health Organisation), Phosphine and selected metal phosphides, Environmental Health Criteria. Published under the joint sponsorship of UNEP, ILO and WHO, Geneva, Vol. 73, 100 pp (1988)
- FDA factsheet :http://www.epa.gov/opprd001/factsheets/phosphine.pdf
- W.R. Iverson, Nature Vol. 217, p. 1265 (1968)
- G. Gassmann, J.E.E. van Beusekom et D. Glindemann, Offshore atmospheric phosphine, Naturwissenschaften Volume 83 129-131 (1996), doi:10.1007/BF01142178
- Dans le première épisode de la saison 1 de Breaking Bad, Walter White en crée pour se débarrasser de deux dealers.
Notes
- PHOSPHINE, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- (en) David R. Lide, Handbook of chemistry and physics, CRC, 16 juin 2008, 89e éd., 2736 p. (ISBN 142006679X et 978-1420066791), p. 9-50
- Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
- Properties of Various Gases sur flexwareinc.com. Consulté le 12 avril 2010
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, CRC Press Inc, 2009, 90e éd., Relié, 2804 p. (ISBN 978-1-420-09084-0)
- (en) David R. Lide, Handbook of chemistry and physics, CRC, 2008, 89e éd., 2736 p. (ISBN 9781420066791), p. 10-205
- The Ammonia (NH3, D1) Structure sur http://cst-www.nrl.navy.mil/. Consulté le 17 décembre 2009
- « phosphine » sur ESIS, consulté le 11 février 2009
- Entrée du numéro CAS « 7803-51-2 » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 28 novembre 2008 (JavaScript nécessaire)
- « Phosphine » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- Phosphine sur hazmap.nlm.nih.gov. Consulté le 14 novembre 2009
Wikimedia Foundation. 2010.



