- Acénaphtène
-
Acénaphtène 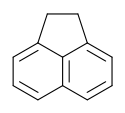

Structure de l'acénaphtène.Général Nom IUPAC 1,2-dihydroacénaphthylène Synonymes 1,8-éthylènenaphthalène
peri-éthylènenaphthalène
naphthylènéthylèneNo CAS No EINECS No RTECS AB1000000 PubChem SMILES InChI Apparence Poudre cristalline blanche à jaune Propriétés chimiques Formule brute C12H10 [Isomères] Masse molaire[2] 154,2078 ± 0,0103 g·mol-1
C 93,46 %, H 6,54 %,Susceptibilité magnétique χM 109,3×10-6 cm3·mol-1[1] Propriétés physiques T° fusion 93,4 °C [3] T° ébullition 279 °C [3] Solubilité 3,9 mg·l-1 (eau,25 °C)[4]
36,52 mg·g-1 (éthanol,25,05 °C)
31,10 mg·g-1 (propan-2-ol,24,92 °C)
50,40 mg·g-1 (butan-1-ol,25,1 °C)
401,70 mg·g-1 (toluène,25,08 °C)[5]Masse volumique 1,222 g·cm-3 à 20 °C [3] T° d'auto-inflammation 450 °C [6] Point d’éclair 135 °C [6] Thermochimie S0solide 188,87 J·K-1·mol-1 [7] ΔfH0gaz 156,8 kJ·mol-1 [7] ΔfH0solide 72 kJ·mol-1 [7] ΔfusH° 21,4622 kJ·mol-1 à 93,41 °C [7] ΔvapH° 63,9 kJ·mol-1 à 25 °C [8] Cp 185,27 J·K-1·mol-1 (solide,17,15 °C) [9]
220,85 J·K-1·mol-1 (gaz,126,85 °C)[7]PCI -6 222 kJ·mol-1 [7] Propriétés optiques Indice de réfraction  [3]
[3]Précautions Directive 67/548/EEC[6] 
NPhrases R : 51/53, Phrases S : 61, Transport[6] 90 3077 NFPA 704 SGH[10] 

AttentionÉcotoxicologie CL50 600 mg·kg-1 (rat, i.p.) [4] LogP 3,92 [6] Composés apparentés Isomère(s) Acénaphtylène Unités du SI & CNTP, sauf indication contraire. L'acénaphtène est un hydrocarbure aromatique polycyclique (HAP) constitué d'une molécule de naphtalène dont les carbones 1 et 8 sont reliés par un pont éthylénique. C'est la forme hydrogénée de l'acénaphtylène.
C'est un constituant du goudron, et on le trouve aussi dans la houille ainsi qu'en très faible quantité dans le pétrole.
Sommaire
Histoire
L'acénaphthène a été découvert pour la première fois par Marcellin Berthelot dans le goudron en 1867[11], puis synthétisée ensuite avec Bardy à partir de l'α-éthylnaphthalène.
Propriétés physico-chimiques
L'acénaphtène est presque insoluble dans l'eau, mais est en revanche soluble dans le benzène, l'éther, le chloroforme et dans l'alcool à chaud.
Cet hydrocarbure réagit avec les halogènes de manière préférentielle en position 3, 5 et 6 voire 1 en fonction de l'activation. La nitration et la sulfonation ont lieu également sur ces positions.
L'hydrogénation catylique conduit à la formation du tétrahydroacénahtène et du décahydroacénahtène alors que l'oxydation donne l'acénaphtylène, l'acide naphtalique, l'anhydride naphtalique, l'acénaphtènequinone, l'acénaphténol et l'acénaphténone[11].Utilisation
L'acénaphtène est produit en grande quantité pour la synthèse de l'anhydride naphtalique par oxydation en phase gazeuse. L'oxydation a lieu en présence d'air et d'un catalyseur à base de vanadium à 300–400 °C[11]. L'acide naphtalique est produit par oxydation en phase liquide en présence de chromate ou d'air accompagné d'acétate de manganèse voire d'acétate de cobalt aux environs de 200 °C[11]. La condensation avec le propandinitrile donne l'acide naphtalèn-1,4,5,8-tétracarboxylique. Ces composés sont des intermédiaires pour la fabrication de pigments pérylènes et périnones[11].
D'autres intermédiaires pour la fabrication de colorants ou de produits pharmaceutiques utilisent l'acénaphtène comme réactif: le 4-bromacénaphtène pour la production d'anhydride 4-bromonaphtalique, le 5,6-dichloracénaphtène et le 3,5,6-trichloracénaphtène. Le pigment fluorescent Solvent yellow 44 est fabriqué via l'anhydride 4-nitronaphtalique qui est le résultat de la nitration et de l'oxydation de l'acénaphtène[11].
Des plastiques thermiquement stables ou non-inflammables par incorporation de dérivés de l'acénaphtène durant la polymérisation[11].Production et synthèse
Le goudron contient environ 0.3 % d'acénaphtène et 2 % d'acénaphtylène qui peut être converti via hydrogénation. L'acénaphtène est concentrée dans la fraction du goudron ayant un point d'ébullition compris entre 230 et 290 °C jusqu'à 25%. Une seconde distillation est effectuée pour obtenir une solution concentrée ayant un point d'ébullition entre 270 et 275 °C suivie d'une cristallisation pour l'obtention de l'acénaphtène technique (95-99%)[11]. Une suite de distillation et recristallisation permet une meilleure purification du produit[11].
Voir aussi
Liens externes
- (en) Method for sampling and analysis (méthode d'échantillonnage et d'analyse)
- (en) Chemical land datasheet
- (en) MSDS at Oxford University Page de l'université d'Oxford)
- (en) National Pollutant Inventory - Polycyclic Aromatic Hydrocarbon Fact Sheet
- (en) Entrée « Acénaphtène » de la base d'une base de donnée HAP
Références
- (en) Hyp J. Dauben, Jr., James D. Wilson et John L. Laity, « Diamagnetic Susceptibility Exaltation in Hydrocarbons », dans Journal of the American Chemical Society, vol. 91, no 8, 9 avril 1968, p. 1991-1998
- Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
- (en) W. M Haynes, CRC Handbook of chemistry and physics, Boca Raton, CRC Press/Taylor and Francis, 2011, 91e éd., 2610 p. (ISBN 978-143982-077-3), p. 3-4
- (en) « Acenaphthene » sur ChemIDplus, consulté le 18 janvier 2010
- (en) Fang He et Pengbiao Liu, « Solubility of Acenaphthylene in Different Solvents between (278 and 323) K », dans Journal of Chemical & Engineering Data, vol. 52, no 6, 2007, p. 2536-2537
- Entrée de « Acenaphthene » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 18 janvier 2010 (JavaScript nécessaire)
- (en) « Acenaphthene » sur NIST/WebBook, consulté le 18 janvier 2010
- (en) Ying Duan Lei, Raymond Chankalal, Anita Chan et Frank Wania, « Supercooled Liquid Vapor Pressures of the Polycyclic Aromatic Hydrocarbons », dans Journal of Chemical & Engineering Data, vol. 47, no 4, 2002, p. 801-806
- (en) J. A. R. Cheda et E. F. Jr. Westrum, « Subambient-Temperature Thermophysics of Acenaphthene and Acenaphthylene: Molecular Disorder in the Latter », dans The Journal of Physical Chemistry, vol. 98, no 9, 1994, p. 2482-2488
- SIGMA-ALDRICH
- (en) Karl Griesbaum, Arno Behr, Dieter Biedenkapp, Heinz-Werner Voges, Dorothea Garbe, Christian Paetz, Gerd Collin, Dieter Mayer, Hartmut Höke, Hydrocarbons, Wiley-VCH Verlag GmbH & Co, coll. « Ullmann's Encyclopedia of Industrial Chemistry », 15 juin 2000
Catégories :- Produit chimique dangereux pour l'environnement
- Hydrocarbure aromatique polycyclique
- Composé tricyclique
- Naphtalène
Wikimedia Foundation. 2010.



