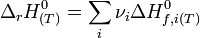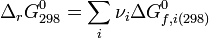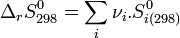- Enthalpie Standard De Formation
-
Enthalpie standard de formation
L'enthalpie d'un corps pur ne peut être calculée de façon absolue car elle dépend de l'énergie interne qui n'est pas calculable (H = U + pV). Néanmoins, des tables d'enthalpies molaires standards ont été établies afin de pouvoir calculer rapidement une enthalpie standard de réaction à partir des valeurs de ces enthalpies molaires :
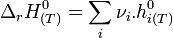 . Cela suppose de définir une échelle arbitraire d'enthalpies molaires en définissant un zéro arbitraire d'enthalpie.
. Cela suppose de définir une échelle arbitraire d'enthalpies molaires en définissant un zéro arbitraire d'enthalpie.C'est pour éviter cet inconvénient qu'a été définie l'enthalpie standard de formation à T :
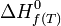 ou
ou 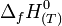 dont les valeurs pour chaque corps pur ont été tabulées à la température de référence de 298 K.
dont les valeurs pour chaque corps pur ont été tabulées à la température de référence de 298 K.Sommaire
Définition
L'enthalpie standard de formation à T, d'un composé chimique,
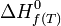 , est la différence d'enthalpie mise en jeu lors de la formation d'une mole de ce composé à partir des corps simples, purs, pris dans l'état standard et stables à la température considérée T.
, est la différence d'enthalpie mise en jeu lors de la formation d'une mole de ce composé à partir des corps simples, purs, pris dans l'état standard et stables à la température considérée T.Elle correspond à l'enthalpie standard de réaction à T,
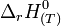 (voir thermochimie) de la réaction de formation du corps pur à partir des corps purs simples correspondants, stables dans l' état standard à T.
(voir thermochimie) de la réaction de formation du corps pur à partir des corps purs simples correspondants, stables dans l' état standard à T.exemple : l'enthalpie standard de formation à T, de
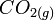 :
: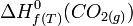
C'est l'enthalpie standard de réaction,
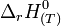 de la réaction de formation à partir des corps simples stables dans l'état standard à T:
de la réaction de formation à partir des corps simples stables dans l'état standard à T: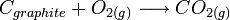
De cette définition découlent plusieurs conséquences :
- L'enthalpie standard de formation à T, d'un corps simple stable est nulle, puisque la réaction de formation c'est la réaction de formation à partir de lui-même.
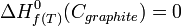 si le graphite est stable à la température choisie T. En revanche, l'enthalpie de formation du carbone diamant (métastable) est différente de zéro puisque c'est alors la réaction de formation du diamant à partir du corps simple stable dans les conditions standards, le graphite.
si le graphite est stable à la température choisie T. En revanche, l'enthalpie de formation du carbone diamant (métastable) est différente de zéro puisque c'est alors la réaction de formation du diamant à partir du corps simple stable dans les conditions standards, le graphite.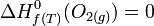 si le dioxygène est stable à T.
si le dioxygène est stable à T.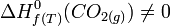 car c'est un corps composé.
car c'est un corps composé.
- Il n'est plus nécessaire de définir une échelle arbitraire d'enthalpie. On a choisi de dresser des tables d'enthalpies standards de formation à la température de référence de 298 K.
Grandeurs thermodynamiques de quelques composés à 298 K
Les enthalpies standards de formation et entropie standard à 298 K, sont tirées des tables publiées par la JANAF ainsi que Ribaud et Manson (Ministère de l'Air - 1961). Attention, en toute rigueur, ces enthalpies de formation ne sont plus standard car elles ne sont pas données à P = 1 bar = 105 Pa, mais à P = 1 atm = 1,01325×105 Pa, ce qui constituait la pression standard à cette date. Néanmoins, étant donnée la variation minime de pression, les valeurs reportées dans ce tableau sont proches des valeurs réelles en première approximation.
Voir État standard.composé chimique Masse molaire (g) 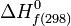 (kJ/mole)
(kJ/mole)S°298 (J/(mol.K)) CO2(g) 44,010 -393,5 213,75 CO(g) 28,011 -110,58 197,6 NO(g) 30,008 90,32 210,7 NH3(g) 17,031 -45,91 192,66 CH4(g) 16,043 -74,9 186,17 C2H6(g) 30,068 -84,7 229,57 C3H8(g) 44,094 -103,88 270,01 C4H10(g) 58,12 -124,78 310,15 C5H12(g) 72,146 -146,50 349,49 C6H14(g) 86,172 -167,25 386,95 C7H16(g) 110,198 -187,89 425,41 C8H18(g) 114,224 -208,52 463,84 C2H4(g) 28,054 52,49 219,30 C3H6(g) 42,078 20,42 267,03 C2H2(g) 26,038 226,81 200,92 C6H6(g) 78,108 82,96 269,30 H2(g) 2,016 0 130,46 H(g) 1,008 218,06 114,65 N2(g) 28,016 0 191,32 N(g) 14,008 472,96 153,23 O(g) 16,000 249,28 161,02 O2(g) 32,000 0 204,82 O3(g) 48,000 142,12 237,42 C (graphite) 12,011 0 5,68 C (diamant) 12,011 1,92 2,45 H2O (liquide) 18 -285,8 69,96 H2O (gaz) 18 -241,8 188,74 Remarques :
- Les corps simples dont l'enthalpie de formation standard à 298 K est nulle, correspondent à la variété stable à cette température.
- Certains composés ne sont pas stables sous la pression standard à 298 K. C'est le cas par exemple, de l'eau à l'état gaz. Néanmoins, même si son existence est formelle dans ces conditions, on a donné la valeur de son enthalpie standard de formation à 298 K, déterminée en tenant compte de l'enthalpie de vaporisation de l'eau liquide.
Loi de Hess
L'intérêt de l'enthalpie standard de formation est qu'elle permet de calculer le
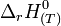 de n'importe quelle réaction, connaissant le
de n'importe quelle réaction, connaissant le 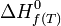 de chacun des réactifs et produits intervenant dans la réaction. Ceci est donné par la loi de Hess.
de chacun des réactifs et produits intervenant dans la réaction. Ceci est donné par la loi de Hess.Considérons une réaction chimique dont l'équation bilan est la suivante :
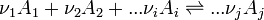
- réactifs ( i )....................................produits ( j )
L'enthalpie standard de réaction à T est égale à :
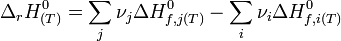
Remarque
- Ces relations sont souvent exprimées par les expressions simplifiées mais très peu explicites.
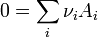 Cette relation représente l'équation-bilan !
Cette relation représente l'équation-bilan !
Remarques
- De la même manière et pour les mêmes raisons, il a été défini une enthalpie libre standard de formation à T :
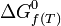 dont les valeurs ont été tabulées pour la plupart des composés, à la température de référence de 298 K. Ces valeurs permettent de calculer l'enthalpie libre standard de réaction à 298 K :
dont les valeurs ont été tabulées pour la plupart des composés, à la température de référence de 298 K. Ces valeurs permettent de calculer l'enthalpie libre standard de réaction à 298 K : 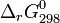
- Ce qui permet d'avoir accès à la constante d'équilibre,
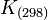 (voir Équilibre chimique).
(voir Équilibre chimique).
- En revanche l'entropie d'un corps pur peut être calculée de façon absolue (voir Calculs de l'entropie d'un corps pur), donc il n'est pas nécessaire de définir une entropie standard de formation. Les entropies molaires standards à 298 K :
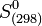 sont directement tabulées. Elles permettent le calcul de l'entropie standard de réaction à 298 K:
sont directement tabulées. Elles permettent le calcul de l'entropie standard de réaction à 298 K: 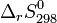
Voir aussi
- Portail de la chimie
Catégories : Thermochimie | Propriété chimique
Wikimedia Foundation. 2010.