- Nitration
-
La nitration est une réaction chimique qui permet d'introduire un ou plusieurs groupement nitro - NO2 dans une molécule. C'est une réaction qui fait partie des plus importantes en chimie industrielle avec la chloration et la sulfonation.
Sommaire
Généralités
Trois types de nitrations peuvent être définies: les nitrations C, O et N en fonction de l'atome sur lequel vient se greffer le groupe nitro.
La nitration fait partie des réactions les plus exothermiques de la chimie industrielle et des mesures de sécurité rigoureuses sont appliquées: une enthalpie de réaction moyenne de 126 kJ/mol est courante[1]. Le mode de production continue est préféré pour les grandes quantités ou pour des quantités plus petites le mode discontinu peut être utilisé mais avec en général une limitation aux réacteurs de 6000 litres[2].
Nitration ionique
Il s'agit du mécanisme le plus courant notamment pour la nitration des composés aromatiques. Des mélanges d'acides contenant de l'acide nitrique et un acide fort tel l'acide sulfurique, l'acide fluorhydrique, l'acide perchlorique, le trifluorure de bore ou des résines échangeuses d'ions porteuses de groupes acide sulfoniques[1] sont utilisés comme agents de nitration.
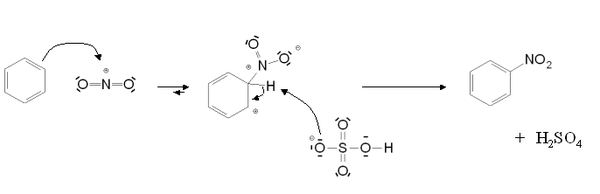
Ces acides forts catalysent la formation d'ions nitroniums NO2+. L'acide sulfurique reste l'acide le plus utilisé grâce à son efficacité et à son prix et on l'utilise dans des proportions standards 20% d'acide nitrique, 60 % d'acide sulfurique et 20 % d'eau[1].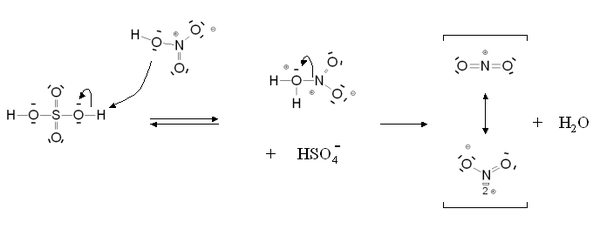 Mécanisme de formation de l'ion nitronium
Mécanisme de formation de l'ion nitronium
Dans le cadre de la nitration aromatique, l'ion nitronium se fixe ensuite sur le cycle benzénique par un mécanisme de substitution électrophile aromatique.
Si la réaction est catalysée en présence d'acide sulfurique, l'étape cinétiquement déterminante est la nitration du cycle benzénique pour former l'intermédiaire de Wheland. En présence d'acide nitrique seul, il s'agit de la formation de l'ion nitronium.
Le pentoxyde de diazote est également une source de ion nitronium par dissociation:
L'oxyde est en solution dans du dichlorométhane et possède un pouvoir moyen de nitration, mais réagit de manière pratiquement stoechiométrique et permet une concentration résiduelle très faible. Ce type de réactif est utilisé pour des synthèses particulières notamment pour la nitration d'hétérocycles[1]Nitration radicalaire
La synthèse radicalaire est principalement utilisée pour la nitration de paraffines en phase liquide et gazeuse[1]. Une haute température est nécessaire pour la formation des radicaux de l'ordre de 150-200 °C pour les réactions en phase liquide et de 200-440 °C pour la phase vapeur. Une pression élevée entre 8-12 atm est généralement appliquée notamment pour le recouvrement des produits par condensation ou refroidissement externe. Les principaux agents de nitration sont l'acide nitrique et le dioxyde d'azote.
La voie radicalaire est un mélange d'étapes de nitration et d'oxydation[1]:
1) Acide nitrique
2) Dioxyde d'azoteLa conversion de l'acide nitrique est comprise entre 20-40%, le reste formant des oxydes d'azote (principalement NO).
Notes et références
- (en) Lyle F. Albright, Nitration, Wiley-VCH Verlag GmbH & Co, coll. « Kirk‑Othmer Encyclopedia of Chemical Technology », 4 décembre 2000
- (en) Gerald Booth, Nitro Compounds, Aromatic, Wiley-VCH Verlag GmbH & Co, coll. « Ullmann's Encyclopedia of Industrial Chemistry », 15 septembre 2000
Voir aussi
Articles connexes
Wikimedia Foundation. 2010.