- Oxydation et reduction en chimie organique
-
Les réactions d'oxydo-réduction sont d'une importance capitale en chimie organique. Néanmoins, la structure des composés rend l'approche assez différente de ce que l'on observe en chimie inorganique ou en électrochimie notamment parce que les liaisons chimiques dans une structure organique sont essentiellement covalentes alors que les principes d'oxydo-réduction traitent plutôt de composés ioniques.
Sommaire
Détermination du nombre d'oxydation
On peut déterminer l'état d'oxydation d'un atome en calculant son nombre d'oxydation. Plus celui-ci est élevé, plus l'atome est oxydé.
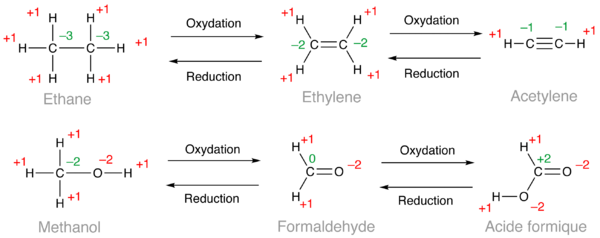
La somme de tous les nombres d'oxydation d'une molécule est égale à la charge totale de la molécule, c'est-à-dire zéro dans la plupart des cas en chimie organique (molécules neutres). Sauf cas particuliers, l'hydrogène a un nombre d'oxydation de +1, l'oxygène –2, l'azote –3, les halogènes –1 et le nombre d'oxydation du carbone est celui qu'il faut déterminer.
Dans les exemples ci-dessous, les nombres d'oxydation utilisés pour le calcul sont en rouge et le résultat en vert. Dans le cas de l'éthane, les 6 atomes d'hydrogène donnent un total de +6 ce qui conduit à calculer un nombre d'oxydation de –3 pour chaque carbone puisque 6×(+1) + 2×(–3) = 0. Dans le cas de l'éthylène, on obtient un nombre d'oxydation de –2 pour les deux carbones et –1 pour l'acétylène. D'après ces calculs, un alcène est donc une forme oxydée d'un alcane et un alcyne, une forme oxydée d'un alcène. De la même façon, on peut classer dans l'ordre croissant d'oxydation les alcools (méthanol ci-dessous), les aldéhydes (formaldéhyde) et les acides carboxyliques (acide formique).
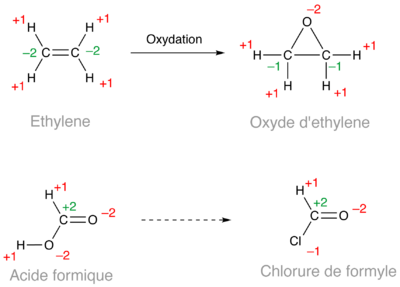
Est-ce qu'un époxyde est une forme oxydée d'un alcène ? En comparant l'éthylène et l'oxyde d'éthylène (ci-dessous), la réponse est oui. En revanche, l'acide formique et le chlorure de formyle ont le même degré d'oxydation.
Limites : cette méthode n'est pas applicable lorsque les atomes de carbone sont de nature très différente à moins de considérer la molécule comme un assemblage de plusieurs fragments indépendants.
Hydrogénation/déshydrogénation
Si l'on compare l'éthane et l'éthylène (ci-dessus), on constate qu'une oxydation est formellement une perte d'une molécule d'hydrogène H2 (déshydrogénation), et la réduction est la réaction inverse (hydrogénation).
H3C—CH3 → H2C=CH2 + H2
L'hydrogénation est une réaction très utilisée en chimie organique. Elle nécessite la présence d'un catalyseur métallique qui va activer l'hydrogène gazeux en le dissociant. Cette réaction est appelée hydrogénation catalytique. Les catalyseurs sont principalement composés de palladium, de platine, de nickel ou de rhodium et ils peuvent être solubles (catalyseur homogène) ou non (catalyseur hétérogène) dans le milieu réactionnel.
L'hydrogénolyse est un cas particulier de l'hydrogénation catalytique. Dans cette réaction, c'est une liaison simple qui est hydrogénée ce qui provoque la coupure (lyse) de la liaison. Par exemple (Ph est un groupe phényle) :
R—O—CH2—Ph + H2 → R—OH + CH3-Ph
Exemples
- Réduction d'un alcyne en alcène : Organic Syntheses, Vol. 68, p.182 (1990).
- Préparation d'un stilbène par déshydrogénation à la DDQ : Organic Syntheses, Vol. 49, p.53 (1969).
Oxydation et réduction par classe de composés
- Acide carboxylique
- Aldéhyde
- Alcool (chimie)
- Amine (chimie)
- Amination réductrice
- Oxydation d'un alcool
Articles connexes
- Portail de la chimie
Catégories : Catalyse | Réaction organique | Électrochimie
Oxydation et reduction en chimie organique
Wikimedia Foundation. 2010.