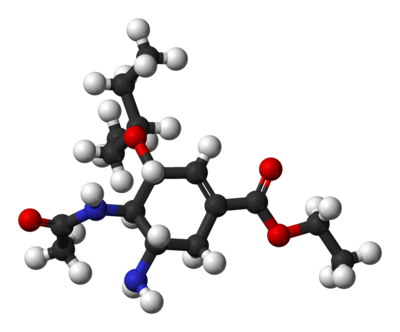
- Synthèse totale de l'oseltamivir
-
La synthèse totale de l'oseltamivir correspond à la synthèse totale du principe actif antigrippal commercialisé par Hoffmann-La Roche sous le nom de marque Tamiflu. Sa production commerciale commence à partir de l'acide shikimique, une biomolécule issue de l'anis étoilé de Chine (fruit de Illicium verum) dont l'offre mondiale est limitée. À cause de cette offre limitée, des recherches sur d'autres voies de synthèse évitant l'acide shikimique sont en cours et en 2010, plusieurs de ces synthèses alternatives ont été publiées. Le contrôle de la stéréochimie est important : l'oseltamivir possède trois stéréocentres et l'isomère recherché est seulement l'un des 8 stéréoisomères possibles.
Sommaire
Production commerciale
La méthode courante de production de l'oseltamivir est basée sur les recherches de Gilead Sciences à partir de l'acide quinique naturel[1],[2] et celles d'Hoffmann-La Roche à partir de l'acide shikimique[3].
Synthèse de Karpf-Trussardi
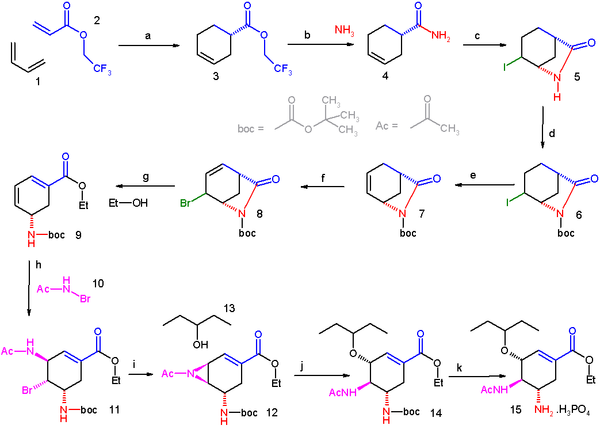
La méthode de production actuelle comprend deux étapes avec des azotures potentiellement dangereux car explosifs. Une synthèse sans azoture du Tamiflu Hoffmann-La Roche, publiée est décrite graphiquement ci-dessous[4]:

La synthèse commence à partir de l'acide (–)-shikimique. Le 3,4-pentylidène acétal mésylate, est préparé en trois étapes avec un rendement global de 80%: estérification avec l'éthanol et le chlorure de thionyle, cétalisation avec l'acide paratoluènesulfonique (APTS) et la pentan-3-one, mésylation avec la triéthylamine et le chlorure de méthanesulfonyle. L'ouverture réductrice du cétal sous conditions de Hunter modifiées[5] produit un mélange inséparable de, majoritairement (>80%), mésylate diol, inintéressant et des mésylates isomériques monopentyl éther dont celui recherché ne correspond qu'à environ 8% mol. du mélange total. L'époxyde correspondant est formé sous conditions basiques avec du bicarbonate de potassium. En utilisant le diéthyl étherate de bromure de magnésium, un acide de Lewis très bon marché (et communément préparé frais par addition de copeaux de magnésium métallique sur le 1,2-dibromoéthane dans un mélange benzène:diéthyl éther), l'époxyde est ouvert avec l'allylamine pour former l'aminoalcool-1,2 correspondant. Les solvants méthyl tert-butyl éther et acétonitrile, non miscibles à l'eau, sont utilisés pour simplifier la purification qui consiste à agiter le mélange réactionnel avec une solution aqueuse 1M de sulfate d'ammonium. Une réduction sur palladium, catalysée avec de l'éthanolamine suivie par une purification acide fournit l'aminoalcool-1,2 déprotégé (N-désallylation). Cet aminoalcool est converti directement en l'allyl-diamine correspondante par une intéressante séquence en cascade qui commence par une imination (formation d'une imine) non sélective du benzaldéhyde avec élimination de l'eau par l'azéotrope qu'elle forme avec le méthyl tert-butyl éther. Puis une mésylation suivie de l'élimination du chlorhydrate de triéthylamine, un coproduit solide, forme un intermédiaire qui subit une aziridination (formation d'un cycle aziridine) simultanément à une transimination avec un autre équivalent d'allylamine. Avec l'acide méthylsulfonique libéré, l'aziridine s'ouvre proprement pour former la diamine qui subit immédiatement une seconde transimination. Une hydrolyse acide élimine l'imine. Un acylation sélective avec l'anhydride acétique (sous conditions tamponnées, le groupe 5-amino est protoné en raison de son pKa de 4,2 -considérablement plus bas qu'un pKa attendu aux alentours de 8 pour ce genre de groupe- ce qui empêche son acétylation) donne le produit N-acétylé désiré sous forme cristalline après purification. Finalement, une désallynation comme précédemment, produit l'oseltamivir free base qui est converti en le phosphate d'oseltamivir désiré par traitement avec l'acide phosphorique. Ce produit final est obtenu avec une très bonne pureté de 99,7% et avec un rendement général de 17 à 22%à partir de l'acide (–)-shikimique.
Il est à noter que cette synthèse permet d'éviter l'utilisation de réactifs et d'intermédiaires azotures potentiellement explosifs mais la synthèse effectivement mise en œuvre par Hoffmann-La Roche les utilise. Hoffmann-La Roche connaît d'autres voies vers l'oseltamivir qui n'impliquent pas l'utilisation d'acide shikimique comme composé de départ possédant une chiralité définie. Une des ces voies exploite une réaction de Diels-Alder impliquant l'acrylate d'éthyle et des furanes, une autre voie l'acide isophtalique qui implique une hydrogénation catalytique et une désymétrisation enzymatique.
Synthèse de Corey
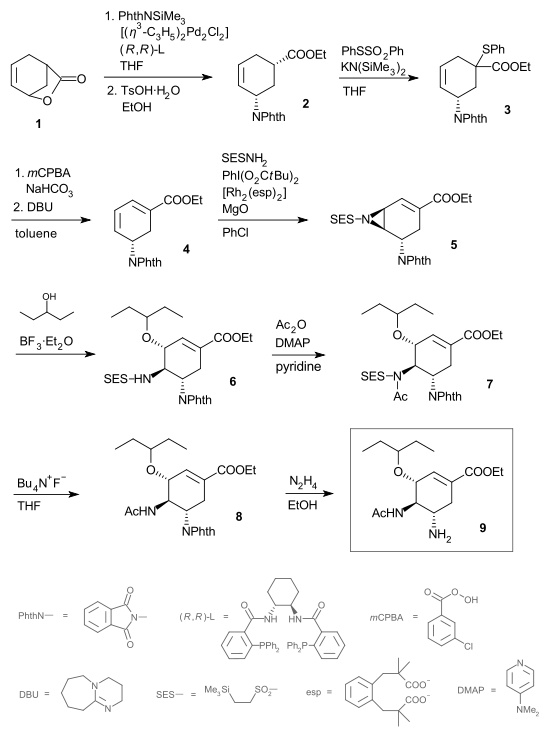
En 2006, l'équipe d'Elias James Corey publie une nouvelle route contournant l'acide shikimique et partant du butadiène et de l'acide acrylique[6]. Les inventeurs ont choisi de ne pas breveter cette procédure en 11 étapes, décrite ci-dessous :
Le butadiène (1) réagit dans une réaction de Diels-Alder asymétrique avec l'ester acrylate du 2,2,2-trifluoroéthanol (2) et catalysé par le catalyseur CBS. L'ester (3) est converti en l'amide (4) par réaction avec l'ammoniac et l'étape suivante vers le lactame (5) est une iodolactamisation initiée par le triflate de triméthylsilyle. Le groupe protecteur BOC est ajouté sur le groupe amide par réaction avec l'anhydride de BOC dans (6) et le substituant iode est éliminé par une réaction d'élimination avec DBU pour former l'alcène (7). Un atome de brome est introduit dans (8) par une bromation allylique avec le NBS et le groupe amide est coupé avec de l'éthanol et du carbonate de césium, accompagné de l'élimination du bromure pour former l'ester éthylique de diène (9). La nouvelle double liaison formée est fonctionnalisée par le N-bromoacétamide (10) dans une réaction catalysée avec du bromure d'étain(IV) qui permet un contrôle complet de la stéréochimie de (11). Dans l'étape suivante, l'atome de brome est remplacé par l'atome d'azote du substituant acétamide avec la base forte KHMDS ce qui fournit l'aziridine (12) qui, à son tour, est ouverte par réaction avec le pentan-3-ol (13) vers l'éther (14). Dans l'étape finale, le groupe BOC est retiré par l'acide phosphorique et le phosphate d'oseltamivir (15) est formé.
Synthèse de Shibasaki
En 2006 aussi, l'équipe de Masakatsu Shibasaki de l'Université de Tokyo publie une synthèse qui évite aussi l'acide shikimique mais emploie des azotures[7],[8].
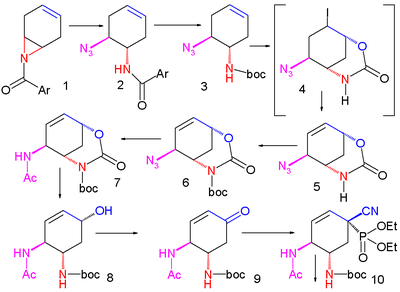
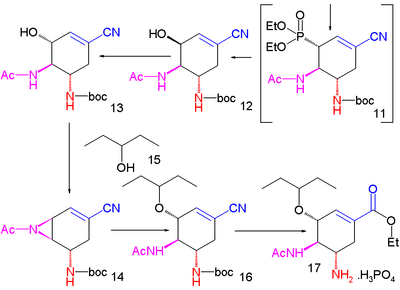
Synthèse de Shibasaki du Tamiflu Part. I Part. II Une méthode améliorée publiée en 2007 commence par la désymétrisation énantiosélective de l'aziridine (1) avec l'azoture de triméthylsilyle (TMS–N3) et un catalyseur chiral pour former l'azoture (2). Le groupe amide est protégé par un groupe BOC introduit par l'anhydride de BOC et la DMAP dans (3) dont la iodolactamisation avec de l'iode et du carbonate de potassium donne initialement l'intermédiaire instable (4) qui se réarrange en le carbamate cyclique (5) après élimination d'iodure d'hydrogène (HI) avec le DBU.
Le groupe amide est reprotégé avec BOC dans (6) et le groupe azoture est converti en acétamide dans (7) par acylation réductrice avec l'acide thioacétique et la 2,6-lutidine. Le carbonate de césium accomplit l'hydrolyse du groupe carbamate pour former l'alcool (8) qui est ensuite oxydé en la cétone (9) par le périodinane de Dess-Martin. Une cyanophosphorylation avec le cyanophosphate de diéthyle (numéro CAS ) modifie le groupe cétone en le cyanophosphate (10) ouvrant la voie à un réarrangement allylique (en) intramoléculaire vers le phosphate β-allylique instable (11) (dans le toluène en tube scellé) qui est hydrolysé en l'alcool (12) par le chlorure d'ammonium. Ce groupe hydroxyle a une stéréochimie erronée et est donc inversé dans une réaction de Mitsunobu avec l'acide 4-nitrobenzoïque (numéro CAS ) suivie par l'hydrolyse du para-nitrobenzoate pour former (13).
Une seconde réaction de Mitsunobu forme alors l'aziridine (14), prête pour une réaction d'ouverture de cycle avec le pentan-3-ol (15) catalysée par du trifluorure de bore et qui forme l'éther (16). Dans l'étape finale, le groupe protecteur BOC est retiré (HCl) puis par réaction avec l'acide phosphorique, le phosphate d'oseltamivir (17) est formé.
Synthèse de Fukuyama
Une approche publiée en 2007[9] comme celle de Corey commence par une réaction de Diels-Alder asymétrique cette fois avec la pyridine et l'acroléine comme réactifs de départ.
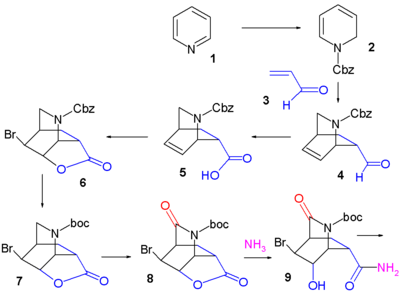
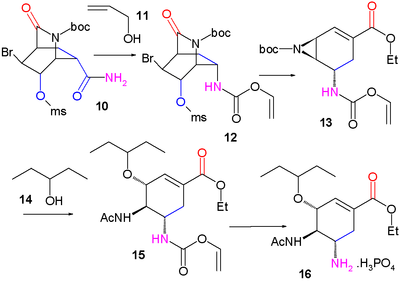
Synthèse de Fukuyama du Tamiflu Part. I Part. II La pyridine (1) est réduite avec le borohydrure de sodium (NaBH4) en présence de chloroformiate de benzyle pour former la dihydropyridine (2) protégée par un groupe Cbz. La réaction de Diels-Alder asymétrique avec l'acroléine (3) est menée en présence de catalyseur de McMillan (en) pour former strictement l'isomère endo de l'aldéhyde (4) qui est oxydé en l'acide carboxylique (5) avec du chlorite de sodium (NaClO2), du dihydrogénophosphate de potassium (en) (KH2PO4) et 2-méthylbut-2-ène ((CH3)2C=CHCH3). L'addition de brome donne par halolactamisation la produit (6) et après replacement du groupe protecteur Cbz par BOC le produit (7) (hydrogénolyse (en) en présence de dicarbonate de di-tert-butyle), un groupe carbonyle est introduit dans l'intermédiaire (8) avec de l'oxyde de ruthénium(IV) catalytique et du periodate de sodium (NaIO4) comme catalyseur sacrificiel (en). L'addition d'ammoniac ouvre le groupe lactame et forme l'amide (9) dont le groupe hydroxyle est mésylaté (méthanesulfonaté) dans (10).
Dans l'étape suivante, du diacétate d'iodobenzène (numéro CAS ) est ajouté et convertit l'amide par un réarrangement de Hofman (en) en le carbamate d'allyle (12) après capture de l'intermédiaire isocyanate avec l'alcool allylique (11). À l'ajout d' éthanolate de sodium dans l'éthanol, trois réactions se déroulent simultanément : coupure de l'amide protégé par BOC qui forme un nouveau groupe ester d'éthyle, déplacement du groupe mésylate par la nouvelle amine protégée par BOC vers un groupe aziridine et réaction d'élimination qui forme la double liaison alcénique de (13) avec libération de HBr. Dans les deux dernières étapes, le cycle aziridine est ouvert par le pentan-3-ol (14) et le trifluorure de bore pour former l'aminoéther (15) avec le groupe BOC remplacé par un groupe acétyle et après retrait du groupe protecteur de l'autre amine (Pd/C, Ph3P et acide 1,3-diméthylbarbiturique dans l'éthanol) et addition d'acide phosphorique, le Tamiflu (16) est obtenu.
Synthèse de Trost
En 2008, le groupe de Barry M. Trost (en) de l'Université Stanford publie la plus courte voie de synthèse à ce jour[10].
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Oseltamivir total synthesis » (voir la liste des auteurs)
- Kim, C. U.; Lew, W.; Williams, M. A.; Liu, H.; Zhang, L.; Swaminathan, S.; Bischofberger, N.; Chen, M. S.; Mendel, D. B.; Tai, C. Y.; Laver, W. G.; Stevens, R. C.; Influenza Neuraminidase Inhibitors Possessing a Novel Hydrophobic Interaction in the Enzyme Active Site: Design, Synthesis, and Structural Analysis of Carbocyclic Sialic Acid Analogues with Potent Anti-Influenza Activity, J. Am. Chem. Soc., 1997, vol. 119(4), pp. 681-690. DOI:10.1021/ja963036t
- John C. Rohloff, Kenneth M. Kent, Michael J. Postich, Mark W. Becker, Harlan H. Chapman, Daphne E. Kelly, Willard Lew, Michael S. Louie, Lawrence R. McGee, Ernest J. Prisbe, Lisa M. Schultze, Richard H. Yu, and Lijun Zhang, Practical Total Synthesis of the Anti-Influenza Drug GS-4104, J. Org. Chem., 1998, vol. 63(13), pp. 4545-4550. DOI:10.1021/jo980330q.
- Abrecht, S.; Harrington, P.; Iding, H.; Karpf, M.; Trussardi, R.; Wirz, B.; Zutter, U.; Chimia, 2004,vol. 58, p. 621.
- Martin Karpf and René Trussardi, New, Azide-Free Transformation of Epoxides into 1,2-Diamino Compounds: Synthesis of the Anti-Influenza Neuraminidase Inhibitor Oseltamivir Phosphate (Tamiflu), J. Org. Chem., 2001, vol. 66(6), pp. 2044-2051. DOI:10.1021/jo005702l.
- Birgit Bartels and Roger Hunter, « A selectivity study of activated ketal reduction with borane dimethyl sulfide », dans J. Org. Chem., vol. 58, 1993, p. 6756 [lien DOI]
- Ying-Yeung Yeung, Sungwoo Hong, and E. J. Corey, A Short Enantioselective Pathway for the Synthesis of the Anti-Influenza Neuramidase Inhibitor Oseltamivir from 1,3-Butadiene and Acrylic Acid, J. Am. Chem. Soc., 2006, vol. 128(19), pp. 6310-6311. DOI:10.1021/ja0616433.
- Yuhei Fukuta, Tsuyoshi Mita, Nobuhisa Fukuda, Motomu Kanai, and Masakatsu Shibasaki, De Novo Synthesis of Tamiflu via a Catalytic Asymmetric Ring-Opening of meso-Aziridines with TMSN3, J. Am. Chem. Soc., 2006, vol. 128(19), pp. 6312-6313. DOI:10.1021/ja061696k.
- Tsuyoshi Mita, Nobuhisa Fukuda, Francesc X. Roca, Motomu Kanai, and Masakatsu Shibasaki, Second Generation Catalytic Asymmetric Synthesis of Tamiflu: Allylic Substitution Route, Org. Lett., 2007, vol. 9(2), pp. 259-262. DOI:10.1021/ol062663c.
- Nobuhiro Satoh, Takahiro Akiba, Satoshi Yokoshima, Tohru Fukuyama, A Practical Synthesis of (–)-Oseltamivir, Angew. Chem. Int. Ed., 2007, vol. 46, pp. 5734-5736. DOI:10.1002/anie.200701754.
- Barry M.Trost, Ting Zhang, A Concise Synthesis of (−)-Oseltamivir, Angew. Chem. Int. Ed., 2008, vol. 47, pp. 1-4.DOI:10.1002/anie.200800282.
Wikimedia Foundation. 2010.