- Chlorure de méthanesulfonyle
-
Chlorure de méthanesulfonyle 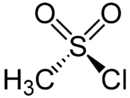
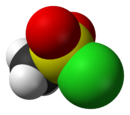
Général Nom IUPAC chlorure de méthanesulfonyle Synonymes chlorure de mésyle No CAS No EINECS No RTECS PubChem SMILES InChI Apparence liquide Propriétés chimiques Formule brute CH3ClO2S [Isomères] Masse molaire[1] 114,551 ± 0,009 g·mol-1
C 10,49 %, H 2,64 %, Cl 30,95 %, O 27,93 %, S 27,99 %,Propriétés physiques T° fusion -32 °C[2] T° ébullition 162 °C[3]
60 °C à 21 mmHg[4]Masse volumique 1,48 g·cm-3 à 25 °C[4] Point d’éclair 113 °C[4] Propriétés optiques Indice de réfraction  = 1,452[4]
= 1,452[4]Précautions Directive 67/548/EEC[4] 
T+Phrases R : 24/25, 26, 34, 37, Phrases S : 26, 28, 36/37/39, 45, Transport - 3246 Écotoxicologie DL50 200 mg·kg-1 (souris, oral)[3]
50 mg·kg-1 (rat, oral)[3]
10 mg·kg-1 (souris, i.p.)[3]Unités du SI & CNTP, sauf indication contraire. Le chlorure de méthanesulfonyle ou chlorure de mésyle est un chlorure de sulfonyle (le chlorure de l'acide méthanesulfonique) utilisé pour former des mésylates (méthanesulfonates) et pour générer des sulfènes.
Sommaire
Préparation
Le chlorure de mésyle est très toxique, sensible à l'humidité, corrosif et lacrymogène. Il doit être stocké dans un endroit sec, préférablement dans un dessicateur.
Il est préparé soit par synthèse directe du méthane et du chlorure de sulfuryle dans une réaction radicalaire (1):
- CH4 (g) + SO2Cl2 (g) → CH3SO2Cl + HCl (g) (1)
soit par une autre méthode qui part de l'acide méthanesulfonique qui, lui-même, est accessible via la réaction du méthane avec le trioxyde de soufre (2) ou via une forte oxydation du méthanethiol (3):
- CH4 (g) + SO3 (g) → CH3SO3H (l) (2)
- CH3SH + HNO3 → CH3SO3H + H2O + NOx (3)
L'acide méthanesulfonique ainsi préparé réagit avec le chlorure de thionyle (4) ou le phosgène (5) pour former le chlorure de mésyle :
- CH3SO3H + SOCl2 → CH3SO2Cl + SO2 + HCl (4)
- CH3SO3H + COCl2 → CH3SO2Cl + CO2 + HCl (5)
Utilisation
Méthanesulfonate
Le principal usage du chlorure de methanesulfonyle est la formation d'esters mésylates d'alcools en présence d'une base non-nucléophile[5]. Les méthanesulfonates sont utilisés comme intermédiaires de synthèse dans des réactions de substitution, d'élimination, de réduction et de réarrangement. Quand ils sont traités avec un acide de Lewis, les méthanesulfonates d'oxime subissent facilement un réarrangement de Beckmann[6].
Les méthanesulfonates ont été occasionnellement utilisés comme groupe protecteur d'hydroxyle. Ils sont stables en milieu acide et peuvent être retirés en utilisant de l'amalgame de sodium[7].
Méthanesulfonamide
Le chlorure de mésyle peut réagir sur les amines pour former des méthanesulfonamides. Contrairement aux méthanesulfonates, un méthanesulfonamide est un groupe fonctionnel très stable aussi bien en condition acide qu'en condtion basique. Quand il est utilisé comme groupe protecteur, il peut être reconverti en amine en utilisant de le tétrahydruroaluminate de lithium (LiAlH4)[8].
Addition sur un alcyne
En présence de chlorure de cuivre(II), le chlorure de methanesulfonyle s'additionne sur les alcynes pour former des β-chloro sulfones[9].
Formation d'hétérocycles
Sous traitement avec une base comme la triéthylamine, le chlorure de mésyle subit une élimination pour former du sulfène qui, lui-même, peut subir des cycloadditions pour former différents hétérocycles, par exemple, les α-hydroxycétones réagissent avec le sulfène pour former des sultones à cinq chaînons[10].
Autre
Former des ions acyliminium à partir d'α-hydroxyamides peut être fait en utilisant une fois de plus le chlorure de mésyle et une base, typiquement la triéthylamine[11].
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Methanesulfonyl chloride » (voir la liste des auteurs)
- Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
- Entrée de « Methanesulfonyl chloride » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais) (JavaScript nécessaire)
- Methanesulfonyl chloride sur ChemIDPlus.
- Methanesulfonyl chloride chez Sigma-Aldrich
- Furst, A.; Koller, F., « Über Steroide und Sexualhormone. Ein neuer Weg zur Herstellung der α-Oxyde von Cholesterin und trans-Dehydro-androsteron », dans Helv. Chim. Acta, vol. 30, 1947, p. 1454 [lien DOI]
- Maruoka, K.; Miyazaki, T.; Ando, M.; Matsumura, Y.; Sakane, S.; Hattori, K.; Yamamoto, H., « Organoaluminum-promoted Beckmann rearrangement of oxime sulfonates », dans J. Am. Chem. Soc., vol. 105, 1983, p. 2831 [lien DOI]
- Webster, K. T.; Eby, R.; Schuerch, C., « Selective demesylation of 2-O-(methylsulfonyl)-?-mannopyranoside derivatives with sodium amalgam and 2-propanol », dans Carbohydr. Res., vol. 123, 1983, p. 335 [lien DOI]
- Merlin, P.; Braekman, J. C.; Daloze, D., « Stereoselective synthesis of (±)-tetraponerine-8, a defence alkaloid of the ant Tetraponera sp », dans Tetrahedron Lett., vol. 29, 1988, p. 1691 [lien DOI]
- Amiel, Y., « Addition of sulfonyl chlorides to acetylenes », dans Tetrahedron Lett., vol. 12, 1971, p. 661 [lien DOI]
- Potonay, T.; Batta, G.; Dinya, Z., « Flavonoids. 41. Stereospecific synthesis of 2,3-dihydro-c-3-substituted-t-3-methyl-r-2-phenyl-4H-1-benzopyran-4-ones », dans Journal of Heterocyclic Chemistry, vol. 25, 1988, p. 343 [lien DOI]
- Chamberlin, A. R.; Nguyen, H. D.; Chung, J. Y. L., « Cationic cyclization of ketene dithioacetals. A general synthesis of pyrrolizidine, indolizidine, and quinolizidine alkaloid ring systems », dans J. Org. Chem., vol. 49, 1984, p. 1682 [lien DOI]
Catégories :- Produit chimique très toxique
- Produit chimique corrosif
- Réactif pour la chimie organique
- Chlorure de sulfonyle
Wikimedia Foundation. 2010.

