- Acide thioacétique
-
Acide thioacétique 
Général Nom IUPAC S-acide éthanethioique Synonymes acide thiacétique
acétyl mercaptan
acide thionoacétiqueNo CAS No EINECS No RTECS PubChem ChEBI SMILES InChI Apparence Liquide légèrement jaune d'odeur piquante[1] Propriétés chimiques Formule brute C2H4OS [Isomères] Masse molaire[3] 76,118 ± 0,007 g·mol-1
C 31,56 %, H 5,3 %, O 21,02 %, S 42,13 %,pKa 3,33 à 25 °C[2],[1] Propriétés physiques T° fusion -17 °C[1],[4] T° ébullition 87 °C (décomp.)[1]
93 °C[4]
88-91,5 °C[5]Solubilité peu soluble dans l'eau, soluble dans les alcools et éthers légers[1] Masse volumique 1,065 g·cm-3 à 25 °C[5] Point d’éclair 11 °C[5]
39,4 °C[6]Pression de vapeur saturante 1,07 mbar à 20 °C[1] Viscosité dynamique 6,3 mPa·s(cP) à 20 °C[1] Propriétés optiques Indice de réfraction  = 1.465[5]
= 1.465[5]Précautions Directive 67/548/EEC[5],[6] 
C
FPhrases R : 11, 34, Phrases S : 9, 16, 26, 36/37/39, 45, Transport - 2436 3/PG 2 Écotoxicologie DL50 75 mg·kg-1 (souris, i.p.)[4] Unités du SI & CNTP, sauf indication contraire. L'acide thioacétique est un composé organique acide de formule semi-développée CH3COSH. C'est l'équivalent sulfuré de l'acide acétique (AcOH) avec un point d'ébullition (87-93°C) plus bas. Il est peu soluble dans l'eau où il subit une hydrolyse, lente à basse température, plus rapide à haute température[1].
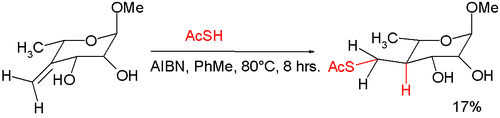
Il est utilisé en synthèse organique pour introduire le groupe thiol (–SH) dans des molécules. Dans un méthode synthétique, ce réactif est utilisé avec AIBN pour une addition nucléophile par l'intermédiaire d'un radical libre qui transforme un alcène exocyclique en un thioester[7]:
Notes et références
- Fiche Thioacetic acide [PDF] de Arkema inc.
- Dissociation Constants Of Organic Acids And Bases, zirchrom.com
- Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
- Thioacetic acid sur ChemIDPlus.
- Thioacetic acid chez Sigma-Aldrich.
- MSDS Thioacetic Acid.
- László Lázár, Magdolna Csávás, Anikó Borbás, Gyöngyi Gyémánt, and András Lipták, Synthesis of methyl 6-deoxy-4-O-(sodium sulfonato)-α-L-talopyranoside, its C-4 epimer and both isosteric [4-C-(potassium sulfonatomethyl)] derivatives , ARKIVOC, 2004, (vii), pp. 196-207/ article [PDF]
Voir aussi
Catégories :- Produit chimique corrosif
- Produit chimique facilement inflammable
- Acide organique
- Réactif pour la chimie organique
- Composé organo-sulfuré
-
Wikimedia Foundation. 2010.