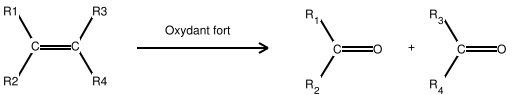- Alcene
-
Alcène
Les alcènes sont des hydrocarbures insaturés, caractérisés par une double liaison covalente entre deux atomes de carbone. Ces liaisons sont toujours de type covalente normale parfaite.
Le terme oléfine était le nom donné par le passé aux alcènes ; bien qu'encore employé, ce terme tombe de plus en plus en désuétude.
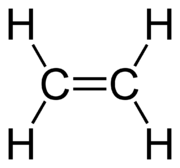
L'alcène le plus simple est l'éthylène (nom usuel de l'éthène) dont la structure développée est :
Les alcènes non cycliques possèdent une formule brute de la forme CnH2n où n est un entier naturel supérieur ou égal à 2.
Sommaire
- 1 Nomenclature
- 2 Propriétés physiques
- 3 Réactivité
- 3.1 Réaction d'addition
- 3.2 Réaction de destruction par combustion
- 4 Réaction de Diels-Alder
Nomenclature
Alcènes non-ramifiés
Il faut utiliser le même nom que celui de l'alcane portant le même nombre d'atomes de carbone, en utilisant le suffixe « -ène » plutôt que « -ane » et en intercalant l'indice de position de la double liaison (voir règle 2a) dans le mot, avant le suffixe, et limité par deux tirets de chaque cotes.
Alcènes ramifiés
Voici les règles à suivre pour nommer un alcène ramifié :
Règle 1
Dans la formule de structure, déterminer la chaîne carbonée principale (c'est-à-dire la chaîne la plus longue d'éléments contenant un C) comportant obligatoirement la double liaison. Pratiquement, cela revient à :- choisir une extrémité de la chaîne carbonée,
- parcourir la chaîne en passant par le plus grand nombre d'atomes C se suivant.
Règle 2
- afin de situer la double liaison, numéroter la chaîne principale de façon que le numéro de l'atome C portant la double liaison soit le plus petit possible.
- suivre la même numérotation pour situer les ramifications.
Règle 3
- Citer le nom de la ramification alkyle, suivi de son indice de position entouré de tirets. Faire suivre du nom de l'alcène comme s'il n'était pas ramifié.
La double liaison peut être déterminée selon les règles de priorité de Cahn-Ingold-Prelog :
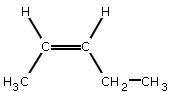
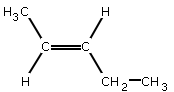
- si les groupes les plus importants liés à chacun des atomes de carbone de la double liaison se retrouvent du même côté par rapport à la double liaison, on parle d'isomère Z (de l'allemand zusammen=ensemble), exemple :
- si les groupes les plus importants liés à chacun des atomes de carbone de la double liaison se retrouvent de coté opposé par rapport à la double liaison, on parle d'isomère E (de l'allemand entgegen=opposé), exemple :
Propriétés physiques
Les alcènes ont des températures d'ébullition un peu plus basses que celles des alcanes correspondants car les forces de Van der Waals sont plus faibles ; en effet, une double liaison prend plus d'espace qu'une simple liaison, donc les molécules s'empilent de façon moins compacte et les forces intermoléculaires sont moins importantes. Il en résulte qu'il faut fournir moins d'énergie pour les rompre : les températures d'ébullition sont plus basses. Ils brûlent avec une flamme claire.
Les alcènes sont gazeux jusqu'au butène, puis liquides et enfin solides à partir de C16. Leur solubilité, médiocre dans l'eau, est bonne dans l'alcool et l'éther.
Réactivité
La double liaison est formée d'une liaison σ (sigma) forte (EL = 347 kJ/mol) et d'une liaison π (pi) appelée également liaison insaturée, plus faible (EL = 263 kJ/mole). La force de la liaison π étant plus faible que celle de la liaison σ, elle cède plus facilement.
Les principales réactions des alcènes sont :
- réaction d'addition sur les carbones porteurs de la double liaison
- réaction de destruction et de dégradation
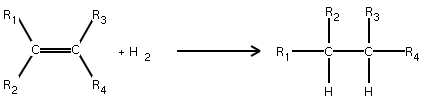
Réaction d'addition
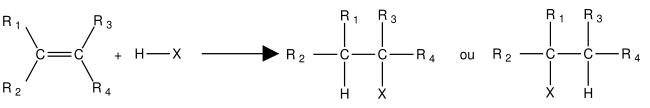
Lors des réactions, la liaison π peut se rompre : un réactif A-B électrophile va s'additionner sur la double liaison de l'alcène et il y a formation d'un produit saturé. La liaison π a donc été remplacée par deux liaisons σ.
Action du dihydrogène
Action d'un dérivé halogéné
formation du produit Markovnikov
Cette réaction obéit à la loi de Markovnikov :
Dans une réaction d'addition de H-X sur un alcène, en l'absence de péroxyde et dans l'obscurité, l'atome d'hydrogène migre vers le carbone moins substitué (c.-à-d. le plus hydrogéné pour former le carbocation le plus stable).
formation du produit Karasch ou anti-Markovnikov
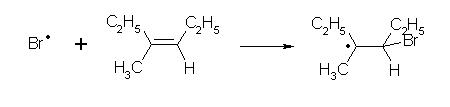
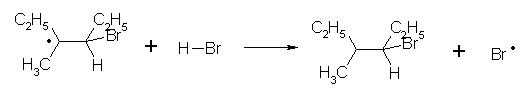
Exemple: addition radicalaire du bromure d'hydrogène sur le 3-méthylhex-3-ène en présence de peroxyde de benzoyle.
Le mécanisme réactionnel est séparable en trois étapes.
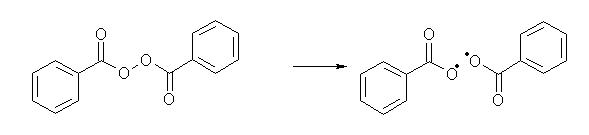
initiation:
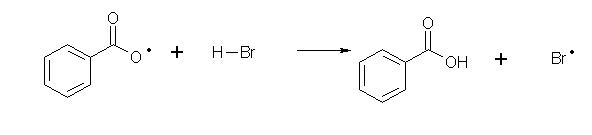
Un péroxyde est un bon initiateur de radical, il se coupe spontanément en deux radicaux qui à leur tour attaquent une molécule de HBr pour former le radical de propagation Br• . L'initiation peut aussi être réalisée par irradiation aux UV.
propagation:
C'est dans l'étape de propagation que se forme le produit final, le 4-bromo-3-méthylhex-3-ène.
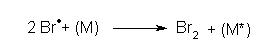
terminaison:
Dans cette étape M est une molécule quelconque du mélange réactionnel voire une molécule du récipient, elle absorbe l'énergie issue du regroupement de deux radicaux.
Cette réaction, en présence de peroxyde ou d'UV, donne au dérivé halogéné une orientation inverse de celle observée en l'absence de ces réactifs. On parle d'orientation anti-markovnikov, ou d'« effet Karasch ».
Action d'un halogène
→ Halogénation : addition de H-X. → Dihalogènation : addition de dichlore ou dibrome (diiode trop peu réactif, difluor trop réactif)
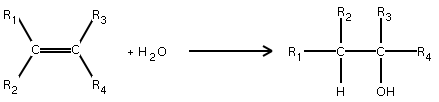
Action de l'eau (hydratation)
Cette réaction obéit à la loi de Markovnikov :
Dans une réaction d'addition de H2O sur un alcène, en l'absence de péroxyde, l'atome d'hydrogène migre vers le carbone le moins substitué (c.-à-d. le plus hydrogéné)
Action d'un oxydant faible
Sur le plan théorique on peut utiliser l'ion permanganate en milieu neutre, la réaction sur l'alcène conduit alors à un diol. Cependant MnO4- reste un oxydant trop fort, on lui préfère en général le tetraoxyde d'Osmium, qui est utilisé en petite quantité du fait de son extrême toxicité. De ce fait on utilise de l'eau oxygénée (H2O2) qui le reforme après réaction (il tient donc le rôle de catalyseur).
Action d'une solution d'oxydant fort
(ozonolyse par exemple)
Si R2 est un atome d'hydrogène, alors R1CH=O est un aldéhyde. Néanmoins l'aldéhyde est oxydée en un acide carboxylique par l'ozone présent dans le milieu, si on désire conserver l'aldéhyde il est nécessaire d'utiliser un réducteur (le Zinc par exemple).
Si R1 et R2 sont des groupes alkyles, alors R1R2C=O est une cétone.
La même réaction est possible avec le permanganate, chauffé en milieu acide. La différence avec l'Ozone est que dans le cas de formation d'un aldéhyde, on ne peut empêcher sa transformation en acide carboxylique.
Hydroboration
Permet l'obtention de certains alcools primaires là où l'addition d'eau conduit à un alcool secondaire, par exemple l'hydroboration du but1ène conduit au butan1ol, alors qu'une l'hydratation donne du butan2ol.
Formation d'époxydes, obtention d'un diol
Un alcène mis en présence de dioxygène conduit à un époxyde. Il est nécessaire de chauffer en présence d'un catalyseur, l'Argent par exemple. En industrie on utilise des peracides (R-O-O-H), dont la liaison peroxyde est très oxydante, le plus utilisé étant le MCPBA (Méta Chloro Per Benzoïque Acide). L'hydratation (reaction d'addition) d'un peroxyde conduit à un diol.
Réaction de destruction par combustion
Réaction de Diels-Alder
Article détaillé : Réaction de Diels-Alder.La réaction de Diels-Alder est un cas particulier des cycloadditions entre systèmes π. Il s'agit d'une addition d'un réaction entre un diène conjugué, et un dièneophile, un alcène substitué. L'exemple-type de cette réaction est la réaction entre le buta-1,3-diène et l'éthylène pour former le cyclohexène:
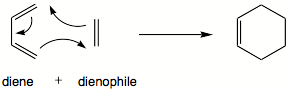
- Portail de la chimie
Catégories : Alcène | Groupe fonctionnel
Wikimedia Foundation. 2010.