- Trifluorure de bore
-
Trifluorure de bore 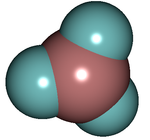

Général Synonymes Trifluoroborane No CAS No EINECS Apparence gaz comprime, incolore, d'odeur acre. Forme des fumées blanches en atmosphère humide[1]. Propriétés chimiques Formule brute BF3 [Isomères] Masse molaire[2] 67,806 ± 0,007 g·mol-1
B 15,94 %, F 84,06 %,Propriétés physiques T° fusion -127 °C[1] T° ébullition -100 °C[1] Solubilité 3 320 g·l-1 dans l'eau à 0 °C Masse volumique 2,4 (air=1) T° d'auto-inflammation ininflammable Point critique 49,9 bar, -12,35 °C [3] Thermochimie ΔvapH° 19,33 kJ·mol-1 (1 atm, -99,9 °C)[4] Propriétés électroniques 1re énergie d'ionisation 15,7 ± 0,3 eV (gaz)[5] Précautions Directive 67/548/EEC 
T+
CPhrases R : 14, 26, 35, Phrases S : (1/2), 9, 26, 28, 36/37/39, 45, NFPA 704 SIMDUT[6] 


SGH[7] 


DangerInhalation Toux Peau Rougeur, douleur Yeux Rougeur, douleur Écotoxicologie Seuil de l’odorat bas : 1,5 ppm[8] Unités du SI & CNTP, sauf indication contraire. Le trifluorure de bore est un gaz toxique et incolore de formule chimique BF3. Il réagit avec l'air humide en formant des fumées blanches composés de fluorure d'hydrogène, d'acide borique et d'acide fluoroborique.
Dans ce composé, le bore est déficitaire en électrons. Au cours des réactions chimiques, BF3 se comporte donc comme un acide de Lewis. Il réagit par exemple avec les fluorures en formant des sels de tétrafluorure :
CsF + BF3 → CsBF4
Sommaire
Structure
La configuration spatiale adoptée par cette molécule est conforme à la théorie VSEPR. Elle minimise les interaction entre doublet d'électrons autour de l'atome central. Elle correspond à une structure dans laquelle les 4 atomes sont coplanaires avec des angles de valence égaux à 120 °. La molécule est plane, trigonale et trois atomes de fluor forme un triangle équilatéral.
Force de la liaison chimique
Les liaisons chimiques B-F sont des liaisons simples. Leur force (646 kJ/mol) est supérieure à celle de toutes les liaisons simples connues[9]. L'origine de cette force ne peut être interprétée par une forme de résonance qui mettrait en jeu le caractère donneur des doublets de l'atome de fluor. Son électronégativité (4) très supérieure à celle du bore (2) ne le permet pas. Deux interprétations complémentaires permettent de comprendre la très grande force de liaison.
Interprétations
Une première interprétation est d'ordre orbitalaire. Le système des quatre orbitales pz (z axe perpendiculaire au plan de la molécule)donne lieu à des recouvrements qui stabilisent l'interaction B-F. Cela indique que cette liaison possède en fait un caractère de double liaison, ce qui justifie sa force.
Une seconde interprétation est due à l'examen simultanée de la grande densité électronique entre B et F (la quantité de recouvrement des OA) et de la charge partielle exceptionnellement élevée portée par B (+2,58) et celle de F (-0,86). Ces valeurs ont été trouvées dans le cadre de la théorie AIM (Atoms in Molecules). Souvent, ces deux propriétés sont exclusives, le caractère ionique d'une liaison ne permettant pas un fort recouvrement orbitalaire. Dans le cas du triflurorure de bore, les deux sont simultanément importants, ce qui rend compte de la force importante de la liaison simple B-F[10].
Synthèse
Il existe une synthèse industrielle et une synthèse de laboratoire bien différentes.
Dans l'industrie
La synthèse industrielle du trifluorure de bore met en jeu des composés facilement accessibles et peut de ce fait se réaliser à l'échelle des milliers de tonnes.
Na2B4O7 + 6 CaF2 + 8 H2SO4 → 2 NaHSO4 + 6 CaSO4 + 7 H2O + 4 BF3
Les réactifs sont en effet le borax (extrait directement du sol, c'est la source d'élément chimique bore), le flurorure de calcium (fluorite) également présente dans la nature, et l'acide sulfurique produit industriellement en grande quantité.
Au laboratoire
Au laboratoire, la synthèse de petite quantité de trifluorure de bore se fait par décomposition d'un sel de diazonium. C6H5N2BF4 → C6H5F + N2 + BF3
Propriétés
Acide de Lewis
Le caractère hypovalent du bore (il ne respecte pas la règle de l'octet) confère au trifluorure de bore un caractère d'acide de Lewis fort. Une partie importante de sa réactivité s'explique ainsi. Il peut facilement fixer une base de Lewis telle que les ions halogénures F-, Cl-, etc. les solvants oxygénés comme l'éther éthylique, etc.
Le trifluore de bore est ainsi commercialisé en solution dans l'éther sous forme de BF3 éthérate OEt2-BF3. Le caractère d'acide de Lewis de BF3 est alors fortement diminué car la fixation d'une base de Lewis doit être précédée du départ de l'éther.
Hydrolyse
L'hydrolyse est la destruction des liaisons B-F et à la formation de liaison B-OH. L'hydrolyse du trifluorure de bore conduit à l'acide borique B(OH)3.
L'hydrolyse s'explique également avec la propriétés d'acide de Lewis du trifluorure de bore. La première étape est la fixation par BF3 d'une molécule d'eau
BF3 + H2O → H2O-BF3
Le caractère attracteur de B active un hydrogène de l'eau ainsi fixée, ce qui conduit à
H2O + H2O-BF3 → H3O+ + HOBF4-
puis
HOBF4- → HOBF3
et une deuxième addition élimination peut intervenir.
Alcoolyse
L'alcoolyse est une réaction proche de l'hydrolyse, mais avec les alcools. Elle conduit aux esters boriques B(OR)3 ou aux alkylborates B(OR)4-.
Alkylation
La liaison B-F peut être alkylée, par exemple avec un organomagnésien. C'est la voie habituelle pour préparer des alkyl(aryl)borate. Par exemple l'ion tétraphénylborate se prépare ainsi, à partir de BF3 ou de de BF4-.
Utilisation
La principale utilisation du trifluorure de bore met en jeu son caractère d'acide de Lewis fort. Les synthèses industrielle utilisant la réaction de Friedel et Craft en sont grosses consommatrice car il faut l'utiliser en quantité stoéchiométrique (et non catalytique).
RX + ArH + BF3 = Ar-R + BF3 + HX
Bien que BF3 semble ne pas intervenir dans le bilan, la présence d'ion X- le transforme en ions BF4- ce qui lui supprime entièrement son caractère d'acide de Lewis.
- BF3 est également utilisé comme dopant pour l'implantation d'ions dans les semi-conducteurs[11]
- Il permet aussi d'initier des réactions de polymérisation de composés insaturés.
- Le 10BF3 est utilisé dans les détecteurs de neutrons lents (par exemple dans les sondes à neutrons).
Sécurité
Le trifluorore de bore est un composé corrosif. Une inhalation prolongée peut occasionner un œdème pulmonaire. Il réagit violemment avec l'eau. Il doit être manipulé avec précautions.
La valeur limite d'exposition est fixée en France à 1 ppm (2,77 mg·m-3).
Lien externe
- Fiche internationale de sécurité
- INERIS : fiche de toxicité
- Propriétés physiques des gaz, sécurité, FDS, compatibilité avec les matériaux, équilibre gaz-liquide, enthalpie, masse volumique, viscosité, inflammabilité, propriétés de transport
Références
- TRIFLUORURE DE BORE, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
- Properties of Various Gases sur flexwareinc.com. Consulté le 12 avril 2010
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, CRC Press Inc, 2009, 90e éd., Relié, 2804 p. (ISBN 978-1-420-09084-0)
- (en) David R. Lide, Handbook of chemistry and physics, CRC, 2008, 89e éd., 2736 p. (ISBN 9781420066791), p. 10-205
- « Trifluorure de bore » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- Boron trifluoride sur hazmap.nlm.nih.gov. Consulté le 14 novembre 2009
- Greenwood N. N. & Earshaw A (2003) Chemistry of the Elements, 2nde Ed. Elsevier.
- Gillespie R.J. (2001). Electron Densities, Atomic Charges, and Ionic, Covalent, and Polar Bonds. J. Chem. Educ. vol.78, pp. 1688-1691.
- Encyclopédie des gaz, air liquide, consulté le 7 septembre 2008
Catégories :- Composé du bore
- Produit chimique très toxique
- Produit chimique corrosif
- Fluorure
- Gaz inorganique
Wikimedia Foundation. 2010.

