- Sulfate d'ammonium
-
Sulfate d'ammonium 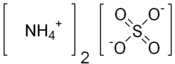
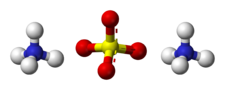
Structure du sulfate d'ammoniumGénéral Synonymes sulfate d'ammoniaque No CAS No EINECS No E E517 SMILES InChI Apparence cristaux incolores Propriétés chimiques Formule brute (NH4)2SO4 Masse molaire[1] 132,14 ± 0,007 g·mol-1
H 6,1 %, N 21,2 %, O 48,43 %, S 24,27 %,Propriétés physiques T° fusion 280 °C Solubilité 760 g·l-1 eau à 20 °C Masse volumique 1,2 g·cm-3 à 20 °C Précautions SIMDUT[2] Produit non contrôlé Écotoxicologie DL50 3 000 mg·kg-1 (Rat ingestion) Unités du SI & CNTP, sauf indication contraire. Le sulfate d'ammonium est un composé chimique de formule (NH4)2SO4. C'est un sel d'ammonium NH4+ et d'acide sulfurique H2SO4 qui possède de très nombreuses applications. Il est notamment couramment utilisé comme engrais destiné à l'acidification des sols alcalins ; il contient 21 % d'azote sous forme d'ammonium NH4+ et 24 % de soufre sous forme de sulfate SO42-. Il est aussi utilisé pour accélérer le départ en fermentation des moûts. On peut ajouter 10 g/hL de (NH4)2SO4 lorsque la teneur du moût en azote ammoniacal est inférieure à 50 mg·l-1.
Préparation
Le sulfate d'ammonium est obtenu par réaction de l'ammoniac NH3 avec l'acide sulfurique[3] :
Un mélange d'ammoniac gazeux et de vapeur d'eau est introduit dans un réacteur contenant une solution saturée de sulfate d'ammonium et environ 2 à 4 % d'acide sulfurique à 60 °C. De l'acide sulfurique concentré est ajouté afin de maintenir l'acidité de la solution ainsi que la concentration de l'acide sulfurique du mélange. La chaleur produite par la réaction maintient quant à elle la température à 60 °C.
Du sulfate d'ammonium sec et pulvérulent peut être obtenu en pulvérisant de l'acide sulfurique dans une enceinte contenant de l'ammoniac gazeux. La chaleur produite par la réaction évapore toute l'eau de l'acide en laissant le sel anhydre.
On produit également le sulfate d'ammonium à partir du gypse (sulfate de calcium hydraté CaSO4·2H2O) finement divisé qu'on ajoute à une solution de carbonate d'ammonium (NH4)2CO3 pour produire du carbonate de calcium CaCO3 qui précipite en laissant le sulfate d'ammonium en solution :
Le sulfate d'ammonium existe à l'état naturel dans le minéral rare appelé mascagnite dans les fumerolles volcaniques.
Références
- Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
- « Sulfate d’ammonium » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- (en) Charles W. George and Ronald A. Susott, (April 1971), « Effects of ammonium phosphate and sulfate on the pyrolysis and combustion of cellulose », avril 1971.
Catégories :- Sulfate
- Composé de l'ammonium
Wikimedia Foundation. 2010.
