- Réaction de Mitsunobu
-
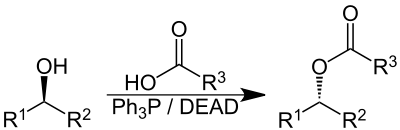
La réaction de Mitsunobu désigne, en chimie organique, la réaction de substitution nucléophile sur un alcool à l'aide d'un composé azo et d'une phosphine. Elle tient son nom de chimiste japonais Oyo Mitsunobu qui a décrit en 1967 l'acylation d'un alcool avec de l'azodicarboxylate de diéthyle (en) (DEAD) et de la triphénylphosphine.
Cette réaction entraine l'inversion de la configuration absolue du carbone portant la fonction alcool.
Sommaire
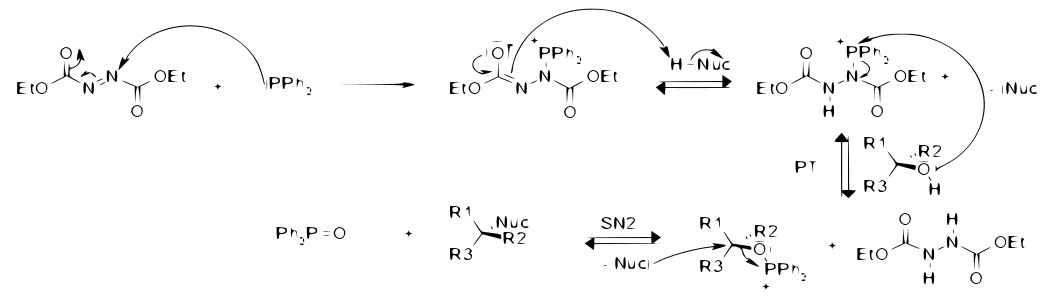
Mécanisme
L'étape clef de cette réaction est la SN2 sur le carbone portant la fonction alcool. Cette étape nécessite l'activation de l'alcool par la phosphine. La force motrice de cette réaction est la formation d'un oxyde de phosphine et l'hydrogénation de la liaison N=N[1].
Utilisation en synthèse
Inversion d'un alcool
La réaction de Mitsunobu est largement utilisé pour inverser la configuration absolue du carbone fonctionnel de l'alcool. Le nucléophile utilisé est alors un acide carboxylique et l'hydrolyse de l'ester obtenu permet d'accéder à l'alcool souhaité[2]. Cette technique est en particulier utilisé pour améliorer l'excès stéréoisomérique lors d'une synthèse multi-étape[3].
Conversion de l'alcool
En changeant la nature du nucléophile, il est possible d'obtenir un grand nombre de composés différents tels que des esters[1], des dérivés halogénés[3], des amines[3], des azotures[2] ou des thioéthers[2].
Notes et références
- (en) Jonathan Clayden, Nick Greeves, Stuart Warren et Peter Wothers, Organic chemistry, Oxford university press (ISBN 0-19-850346-6), p. 430-431
- (en) László Kürti et Barbara Czakó, Strategic Applications of Named Reactions in Organic Synthesis : Background and Detailed Mechanisms, Elsevier Academic press, 2005 (ISBN 0-12-429785-4), p. 295
- Jacques Drouin, Introduction à la chimie organique : Les molécules organiques dans votre environnement. Usages, toxicité, synthèse et réactivité, vol. 2005, Librairie du Cèdre, 1re éd. (ISBN 2-916346-00-7), p. 406-408
Wikimedia Foundation. 2010.