- Catalyse
-
La catalyse est l'action d'une substance appelée catalyseur sur une transformation chimique dans le but d'augmenter sa vitesse de réaction. Le catalyseur, qui est en général en quantité beaucoup plus faible que les réactifs, n'est pas consommé et est retrouvé inchangé à la fin de la réaction. S'il est séparable facilement du milieu réactionnel, ce qui est le cas des catalyseurs hétérogènes, il est utilisé (en théorie) indéfiniment.
Différents types de catalyse peuvent être distingués selon la nature du catalyseur :
- catalyse homogène, si le catalyseur et les réactifs ne forment qu'une seule phase (souvent liquide) ;
- catalyse hétérogène, si le catalyseur et les réactifs forment plusieurs phases (généralement un catalyseur solide pour des réactifs en phase gazeuse ou liquide) ;
La catalyse enzymatique est un cas particulier où le catalyseur est une enzyme ; les caractères de la catalyses enzymatiques (influence de la concentration du catalyseur, types de succession d'étapes, etc.) sont les mêmes que ceux de la catalyse homogène.
La catalyse peut être aussi classée en fonction du mécanisme mis en jeu. Ainsi nous pouvons avoir :
- la catalyse acido-basique (générale ou spécifique) ;
- la catalyse d'oxydo-réduction ;
- la catalyse nucléophile ;
- la catalyse de transfert de phase.
Un catalyseur ne modifie ni le sens d'évolution d'une transformation ni la composition du système à l'état final. Tout catalyseur d'une réaction dans le sens direct catalyse aussi la réaction en sens inverse. De ce fait, un catalyseur ne permet pas à des réactions thermodynamiquement impossibles de se produire. Par exemple, la réaction d'équation
- 2H2O → 2H2 + O2
ne se produit pas en l'absence de catalyseur (à température ordinaire) et aucun catalyseur ne peut la faire se produire. Cependant, comme un catalyseur peut modifier fortement la vitesse d'une réaction parmi un grand nombre de réactions concurrentes possible, il peut favoriser une réaction qui n'existe pas en son absence. C'est le cas de l'oxydation de l'ammoniac par le dioxygène
- en l'absence de catalyseur, 2NH3 + 3/2O2 → N2 + 3H2O
- en présence de platine catalyseur, 2NH3 + 5/2O2 → 2NO + 3H2O
Cette seconde réaction n'est pas du tout présente en l’absence de platine.
Sommaire
Histoire
Le pot catalytique est sans doute l'exemple le plus connu de la catalyse, mais ce domaine de la chimie possède des retombées quotidiennes pour le grand public. Un très grand nombre de procédés chimiques comportent au moins une étape catalysée, que ce soit pour la fabrication de fibres synthétiques, de médicaments ou d'additifs alimentaires.
Découverte
Le terme catalyse fut introduit par Berzélius en 1836 (du grec καταλύειν, qui signifie dénouer) lorsque le début du XIXe siècle fut propice à des études dans ce qui sera ce domaine. Dès 1814 Kirchhoff rapporte l'hydrolyse de l'amidon catalysée par les acides, en 1817 Humphry Davy découvre que l'introduction de platine chaud dans un mélange d'air et de gaz issus du charbon conduit à chauffer à blanc le métal. En 1824 Henry rapporte l'empoisonnement d'un catalyseur : l'éthylène inhibe la réaction entre l'hydrogène et l'oxygène sur du platine. Il remarque par ailleurs l'oxydation sélective dans la réaction entre l'oxygène et un mélange gazeux composé d'hydrogène, de monoxyde de carbone et de méthane. En 1845 Grove montre qu'un filament de platine est également un bon catalyseur pour la décomposition de l'eau en hydrogène et oxygène. En 1871 le procédé Deacon, utilisé pour l'oxydation de l'acide chlorhydrique en chlore, est développé : il utilise un catalyseur à base de brique en argile imprégnée de sels de cuivre. Peu de temps après, en 1877, Lemoine démontre que la décomposition de l'acide iodique en dihydrogène et diiode atteint le même point d'équilibre à 350 °C que la réaction soit menée avec ou sans catalyseur (platine). Cette propriété est confirmée deux ans plus tard par Bertholet avec l'estérification des acides organiques et l'hydrolyse des esters dont l'équilibre de réaction reste identique avec ou sans catalyseur.
Développement de la chimie
Le début du XXe siècle marque une découverte qui continue d'avoir des répercussions de nos jours. Wilhelm Normann réalise l'hydrogénation de l'acide oléique (acide cis-9-octadécènoïque C17H33COOH), liquide, en acide stéarique (acide octadécanoïque C17H35COOH), solide, sur du nickel finement divisé. Cette hydrogénation est encore largement utilisée au XXIe siècle dans de nombreux domaines (alimentation, pharmacie, savonnerie, parfumerie, peinture…) et le nickel reste le catalyseur phare.
La synthèse de l'ammoniac (NH3) à partir du diazote et du dihydrogène est mise au point par Fritz Haber sous haute pression, à température moyenne et en présence de Fe3O4 réduit. Cet ammoniac peut être oxydé en monoxyde d'azote par oxydation sur du platine pour servir de base à la fabrication d'acide nitrique (HNO3). En 1923, BASF commande une usine de fabrication du méthanol à partir de monoxyde de carbone et d'hydrogène sur un catalyseur à base d'oxyde de zinc et d'oxyde de chrome. Durant la même période, le procédé Fischer-Tropsch permet d'obtenir des alcanes, des alcènes et des alcools à partir de monoxyde de carbone et d'hydrogène à l'aide de catalyseur à base de fer et de cobalt. L'oxydation catalytique du dioxyde de soufre en trioxyde de soufre sur de l'oxyde de vanadium V (V2O5) permet la synthèse à grande échelle d'acide sulfurique.
À la fin des années 1930, le craquage catalytique apparaît, offrant la possibilité de rompre les liaisons C-C. Ce procédé, le procédé Houdry, utilise un catalyseur à base d'argile de type montmorillonite traitée à l'acide, et permet de craquer les grosses molécules du pétrole, typiquement contenues dans les gasoil, en plus petites molécules qu'on trouve dans les essences. Durant la même décennie l'oxydation sélective de l'éthylène en oxyde d'éthylène sur un catalyseur à base d'argent est mise au point, développée et commercialisée par Union Carbide. Tous ces procédés permettent d'avoir accès à une échelle industrielle à des produits de base de la chimie, ouvrant ainsi à la voie au développement de la chimie de base et des spécialités.
Incontournable catalyse
Les trente glorieuses profiteront largement à la chimie avec un grand développement des procédés en tout genre pour des productions de plus en plus diversifiées. La catalyse sera un acteur important de ce développement. La polymérisation se développe grandement en profitant des molécules de base produites. Dans les années 1950 le polyéthylène, le polypropylène, et le polybutadiène apparaissent grâce notamment au procédé de polymérisation coordinative Ziegler – Natta utilisant des catalyseurs à base de complexes organométalliques de titane et aluminium. Le traitement du pétrole s'affirme avec l'hydrodésulfuration sur des catalyseurs à base de sulfure de cobalt et de molybdène, l'hydrotraitement des naphtas sur des catalyseurs cobalt – molybdène déposé sur alumine.
Les années 1960 marquent l'apparition des zéolithes de synthèse actives et sélectives pour l'isomérisation des alcanes et le craquage catalytique. Dès lors ces matériaux vont faire l'objet d'intenses études pour leurs propriétés catalytiques et les chercheurs mettent au point de nombreuses zéolithes aux propriétés adaptées selon les réactions à catalyser, mais aussi à la forme des molécules par le contrôle de la taille des canaux. Les réactions mises en jeu conduisent à des molécules de plus en plus diverses : l'ammoxidation du propylène sur des catalyseurs à base d'oxydes de bismuth et de molybdène conduit à la fabrication d'acrylonitrile, alors que l'oxychloration de l'éthylène sur des catalyseurs à base de chlorure de cuivre conduit au chlorure de vinyle.
La décennie 1970 voit apparaître le pot d'échappement catalytique à base de platine, rhodium et palladium. C'est à cette époque que se développe industriellement la catalyse enzymatique avec l'immobilisation d'enzymes, ce qui permet le développement des pénicillines semi-synthétiques ou l'isomérisation du glucose en fructose. Les efforts entrepris lors de la découverte des zéolithes synthétiques se traduisent industriellement dans les années 1980, le procédé MTG (methanol to gasoline : « méthanol vers essence ») permet de fabriquer de l'essence à partir du méthanol grâce au zéolithe H-ZSM5, production de diesel à partir CO et H2 grâce à des catalyseurs à base de cobalt. La chimie fine n'est pas en reste avec la synthèse de la vitamine K4 à l'aide d'un catalyseur membranaire à base de platine.
La liste est encore très longue et les molécules de plus en plus élaborées.
Considérations générales
Catalyseur
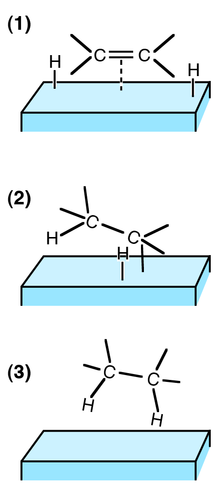 Hydrogénation d'un lien C=C sur un lit catalyseur :
Hydrogénation d'un lien C=C sur un lit catalyseur :
(1) Les réactifs sont adsorbés sur la surface du catalyseur et H2 est dissocié.
(2) Un atome H se lie à l'un des atomes C. L'autre atome C est attaché à la surface.
(3) Un deuxième atome C se lie à un atome H. La molécule s'éloigne de la surface.En chimie, un catalyseur est une substance qui augmente la vitesse d'une réaction chimique ; il participe à la réaction mais est régénéré à la fin de la réaction. Il ne fait donc pas partie des réactifs. S'il fait partie des produits, la réaction est dite autocatalysée. C'est le cas, par exemple de la réaction d'équation
- 2MnO4- + 5 H2C2O4 + 6 H+ → Mn2+ + 10 CO2 + 8 H2O
Lorsqu’un catalyseur est utilisé pour accélérer une transformation, on dit que celle-ci est catalysée. Les catalyseurs agissent seulement sur des produits prédéterminés. Si un catalyseur accélère la réaction, il est dit positif; S'il la ralentit, il est dit négatif[1].
Les catalyseurs sont largement utilisés dans l'industrie et en laboratoire parce qu'ils augmentent considérablement la production des produits tout en minimisant les coûts de production. Dans la nature et en biochimie, certaines protéines possèdent une activité catalytique. Ils s'agit des enzymes.
Le catalyseur augmente la vitesse de réaction en introduisant de nouveaux chemins de réaction (mécanisme), et en abaissant son énergie d'activation, ou énergie libre de Gibbs d'activation. Ce faisant il permet d'augmenter la vitesse, ou d'abaisser la température de la réaction. Le catalyseur ne modifie pas l'énergie libre de Gibbs totale de la réaction qui est une fonction d'état du système et n'a donc aucun effet sur la constante d'équilibre.
En plus de modifier la vitesse de réaction, le choix d'un catalyseur peut reposer sur d'autres paramètres :
- la sélectivité : un catalyseur sélectif favorise la formation du produit désiré par rapport aux produits secondaires. Par exemple, quand on utilise l'argent métallique pour catalyser la réaction de formation de l'oxyde d'éthylène, à partir d'oxygène et d'éthylène, cette réaction est accompagnée par la formation plus favorable thermodynamiquement de CO2 et H2O ;
- la durée de vie : le catalyseur doit pouvoir demeurer intact après plusieurs cycles de réaction.
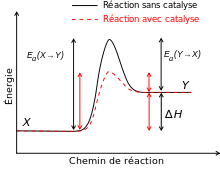 Effet d'un catalyseur positif sur l'énergie d'activation d'une réaction : elle est plus faible et la vitesse de réaction augmente.
Effet d'un catalyseur positif sur l'énergie d'activation d'une réaction : elle est plus faible et la vitesse de réaction augmente.
Analogie
Pour aller de la face nord à la face sud de la butte Montmartre, vous pouvez passer par le Sacré-Coeur, ou faire le tour par la rue Custine, la rue Caulaincourt et le boulevard Rochechouart. C'est à cette dernière option que vous invite le catalyseur. Ainsi, la succession des étapes conduisant à la formation d'un produit n'est pas la même en présence et en l'absence d'un catalyseur. Les produits intermédiaires et leur énergie (potentielle) sont différents. Le chemin réactionnel est donc différent en présence et en absence du catalyseur.
Mécanisme type
Le catalyseur réagit généralement avec un ou plusieurs réactifs pour donner un intermédiaire, qui donne le produit de la réaction tout en régénérant le catalyseur. Ci-dessous, un schéma typique de réaction entre deux composés A et B donnant un produit D en présence d'un catalyseur C.
Le bilan d'une réaction R → P, en présence d'un catalyseur peut se mettre être :
- R + C = RC (1)
- RC → P + C (2)
Bien que le catalyseur (C) soit consommé dans l'étape (1), il est régénéré par l'étape (2). La somme des deux étapes est donc identique au bilan annoncé :
- R → P
Catalyse et énergie de réaction
Un catalyseur fonctionne en permettant un mécanisme alternatif mettant en jeu différents états de transition et des énergies d'activation plus basses. Ainsi, dans le cas d'une réaction bimoléculaire simple de type A + B, l'état de transition est remplacé par un intermédiaire réactionnel de plus basse énergie, accompagné par deux états de transition, eux-mêmes de plus basse énergie. L'effet de ce changement est que plus de collisions moléculaires ont l'énergie nécessaire pour atteindre l'état de transition. Ainsi, un catalyseur permet d'effectuer des réactions qui, bien que thermodynamiquement faisables, étaient cinétiquement impossibles, ou nettement plus lentes. En clair, un catalyseur abaisse l'énergie d'activation d'une réaction.
Un catalyseur ne peut pas rendre possible une réaction énergétiquement défavorable, pas plus qu'elle ne peut déplacer l'équilibre final. La réaction et la réaction inverse sont également catalysées (principe de microréversibilité). L'enthalpie libre de la réaction est inchangée.
Classement selon la nature du catalyseur
La catalyse hétérogène
Article détaillé : Catalyse hétérogène.Les principes
La catalyse est hétérogène quand le catalyseur et les réactifs ne sont pas dans la même phase. L'immense majorité des cas de catalyse hétérogène fait intervenir un catalyseur sous forme solide, les réactifs étant alors gazeux et/ou liquides. Par exemple, l'oxydation du monoxyde de carbone (gaz) par l'oxygène de l'air (gaz)en CO2 sur un catalyseur platine (solide), ou l'hydrogénation du benzène (liquide) par l'hydrogène (gaz) en cyclohexane (liquide) sur nickel (solide).
L'avantage de ce type de catalyse, qui concerne 80% des procédés industriels catalysés, est la grande facilité de mise en œuvre. Les réactifs passent en effet sur le catalyseur immobilisé sur un support. La réaction peut ainsi se dérouler en continue.
Mécanismes réactionnels
Considérons une réaction en phase gazeuse catalysée par un solide. La première étape de n'importe quel mécanisme réactionnel en catalyse hétérogène est l'étape d'adsorption.
- L'adsorption physique ou physisorption
Un réactif de la phase gazeuse peut se « déposer » à la surface du catalyseur. Les forces mises en jeu sont faibles, de l'ordre de 10 à 40 kJ.mol−1, et ce sont des forces d'interaction moléculaires regroupés sous l'appellation force de van der Waals. Ce mode de liaison n'est pas suffisant pour la catalyse, le réactif doit être chimisorbé.
- L'adsorption chimique ou chimisorption
La chimisorption consiste en la création d'une liaison covalente entre la surface du catalyseur et le réactif. Cette chimisorption s'accompagne de l'affaiblissement d'autres liaisons chimiques de la molécule chimisorbée. Celle-ci devient alors plus réactive et peut subir une transformation chimique.
- Mécanisme de type Langmuir - Hinshelwood
Dans ce type de mécanisme, la réaction se fait entre espèces adsorbées à la surface du catalyseur. Cela signifie donc que les espèces nécessaires à une réaction sont présentes à la surface du catalyseur. Cela ne veut pas dire que toutes les espèces mises en jeu dans la réaction doivent être présentes. Dans le cas de réactions mettant en jeu plusieurs espèces et plusieurs étapes, le substrat peut bouger à la surface du catalyseur et les réactifs aussi.
- Mécanisme de type Eley - Rideal
Contrairement au mécanisme précédent, ici la réaction se fait entre une espèce adsorbée à la surface du catalyseur et une espèce non adsorbée.
- Désorption
La dernière étape est une étape de désorption, à savoir la molécule produite quitte la surface du catalyseur pour se retrouver dans le milieu ambiant. Le produit peut alors être entraîné par le flux, gazeux par exemple, pour subir d'autres opérations (typiquement séparation, purification) comme dans les procédés continus. Il peut aussi rester dans le mélange réactionnel le reste du temps en attendant l'arrêt de la manipulation, c'est le cas dans les procédés de type batch (discontinus).
La catalyse homogène
Article détaillé : Catalyse homogène.Les principes
En catalyse homogène les réactifs et le catalyseur sont présents dans la même phase. On retrouve beaucoup ce type de catalyse en chimie organique où de nombreuses réactions se déroulent avec des réactifs en solution, en présence d'ion H+, d'acide de Lewis, de complexes, etc. tous étant également solubles.
Contrairement à la catalyse hétérogène qui permet de séparer le catalyseur facilement, la catalyse homogène ne permet pas séparer le catalyseur tel quel du milieu réactionnel. Elle présente cependant d'autres atouts : une grande reproductibilité d'une synthèse à l'autre, une grande spécificité, une activité à plus basse température et d'un point de vue scientifique une meilleure connaissance des mécanismes réactionnels.
Mécanismes réactionnels
Il est impossible de résumer simplement les mécanismes réactionnels. Cependant il existe dix étapes élémentaires pour les réactions impliquant des organométalliques, qui sont les catalyseurs dans le monde de la catalyse hétérogène. Ces dix étapes élémentaires ne forment en fait que 5 réactions puisqu'on peut avoir une réaction et sa réaction inverse (par exemple l'addition oxydante et l'élimination réductrice). Ces étapes élémentaires n'apparaissent pas toutes durant le mécanisme réactionnel du cycle catalytique.
Les étapes élémentaires se caractérisent par trois variables :
- ΔVE : changement du nombre d'électron de valence de l'atome central (généralement un atome métallique)
- ΔOS : changement de l'état d'oxydation de l'atome central
- ΔCN : changement du nombre de coordination
Classement selon le type de réaction activée
- Catalyse acido-basique
Dans ces réactions, le catalyseur agit en tant qu'acide ou base. On distingue deux cas, selon que la réaction est accélérée par tous les acides (respectivement toutes les bases)(catalyse générale) ou un acide (ou une base) particulier (catalyse spécifique).
- Catalyse générale
De nombreuses réactions sont catalysées par tous types d'acide et de base. Ainsi, l'estérification d'un acide carboxylique par un alcool est catalysée par tous les acides. Le mécanisme passe par la protonation de l'alcool et fait ainsi apparaître H_{2}O comme groupe partant.
- Catalyse spécifique
Dans certains cas, un acide particulier sert de catalyseur. Le mécanisme passe alors par une réaction bien particulière, comme par exemple l'estérification de ce catalyseur.
- Catalyse d'oxydo-réduction
Des réactions d'oxydo-réduction peuvent aussi être catalysées. Par exemple, la dismutation de l'eau oxygénée est catalysée par les ions Fe2+ ou Fe3+.
- Catalyse nucléophile
Des réactions de substitution nucléophiles peuvent être fortement accélérées en présence de traces d'autres nucléophiles. L'exemple classique est l'iodure de lithium. Dans ce sel, l'ion iodure est très peu lié au lithium, et est un assez bon nucléophile. L'ion iodure est aussi très bon nucléofuge. Il sera donc déplacé par le nucléophile principal plus rapidement que ne se serait déroulée la réaction en absence de catalyseur.
- Catalyse par transfert de phase
Article détaillé : Catalyseur de transfert de phase.Ici, l'idée est d'amener en contact des espèces se trouvant dans deux phases différentes. Ainsi, les substitutions nucléophiles par OH- sont réalisables alors que la base est en phase aqueuse et le substrat en phase organique. Le catalyseur transporte l'ion hydroxyde de la phase aqueuse à la phase organique, puis retransporte le nucléofuge de la phase organique à la phase aqueuse. Une règle essentielle est que chaque phase doit respecter l'électroneutralité, si bien que si un cation change de phase, un anion doit changer en même temps (ou un cation doit passer en même temps dans l'autre direction).
- Autocatalyse
Dans certains cas, le catalyseur apparaît dans le bilan de la réaction, du côté des produits : la réaction est alors autocatalysée. L'effet d'une autocataluse se traduit par une augmentation de la vitesse de réaction (alors que la vitesse diminue toujours lorsque la réaction avance) avant de diminuer. L'augmentation de la vitesse est due à l'augmentation de la concentration en catalyseur, et sa diminution à la disparition importante de ses réactifs.
Quelques exemples de réactions et de procédés
La cendre peut servir de catalyseur lors de la combustion du sucre. Le sucre, chauffé au briquet, ne produit aucune flamme. Recouvert de cendre, il peut s'enflammer et brûle d'une flamme bleue.
La catalyse d'une réaction d'oxydo-réduction se fera généralement par un couple dont le potentiel sera compris entre le potentiel de l'oxydant et celui du réducteur.
La lampe Berger élimine les mauvaises odeurs en diffusant un produit catalyseur de la substance active dans l'air.
Notes et références
- (fr) Association québécoise des utilisateurs de l'ordinateur au primaire-secondaire, « Facteurs qui influencent la vitesse d'une réaction », Association québécoise des utilisateurs de l'ordinateur au primaire-secondaire, 2005. Consulté le 31 mars 2009
Voir aussi
Bibliographie
- Jacques Angenault - La Chimie - dictionnaire encyclopédique - Dunod (1995) - ISBN 2-10-002497-3
Articles connexes
- Réaction autocatalytique
- Pot catalytique
- Oxydo-réduction en chimie organique
- Inhibiteur (chimie)
- Poison de catalyseur
Liens externes
- La catalyse, conférence filmée de Christian Minot, Universités de tous les savoirs
- Évolution de catalyseurs solides, SFRS/CERIMES (film pédagogique ancien 1970)
Catégories :- Catalyse
- Chimie générale
- Physico-chimie des interfaces
- Lusis
Wikimedia Foundation. 2010.
