- Isocyanate
-
Un isocyanate est un composé chimique contenant le groupe fonctionnel isocyanate -N=C=O
Les isocyanates sont une ressource importante de divers secteurs industriels : papier, textile, adhésif, isolation (mousse polyuréthane)…
Sommaire
Classification des molécules isocyanates
Selon leur structure, les isocyanates sont classés en séries aliphatiques, alicycliques et aromatiques. Ces derniers sont plus rigides et plus réactifs que les premiers.
Une molécule peut contenir une ou plusieurs fonctions isocyanates.
Les molécules isocyanates monofonctionnelles
- Isocyanates aliphatiques : Isocyanate de méthyle
- Isocyanates aromatiques : Isocyanate de phényle.
Les molécules isocyanates difonctionnelles : Les diisocyanates
Les diisocyanates sont surtout utilisés pour la fabrication des polyuréthanes. Les polyuréthanes obtenus à partir de diisocyanates aromatiques sont relativement plus stables que ceux issus de diisocyanates aliphatiques.
On distingue les diisocyanates symétriques et dissymétriques. La symétrie des diisocyanates affecte la morphologie des domaines rigides des polyuréthanes qui les contiennent.
- Diisocyanates aromatiques symétriques :
- 2,2'-diisocyanate de diphénylméthylène : 2,2'-MDI
- 4,4'-diisocyanate de diphénylméthylène : 4,4'-MDI
- 4,4’-dibenzyl diisocyanate : 4,4’-DBDI
- 2,6-Diisocyanate de toluène : 2,6-TDI
- m-Xylylène diisocyanate : m-XDI
- Diisocyanates aromatiques dissymétriques :
- 2,4'-diisocyanate de diphénylméthylène : 2,2'-MDI
- 2,4’-dibenzyl diisocyanate : 2,4’-DBDI
- 2,4-Diisocyanate de toluène : 2,4-TDI
- Diisocyanates alicycliques symétriques :
- Méthylène bis(4-cyclohexylisocyanate) : H12MDI
- Diisocyanates alicycliques dissymétriques :
- Isophorone diisocyanate : IPDI
- Diisocyanates aliphatiques symétriques :
- Hexaméthylène diisocyanate : HMDI
Les molécules isocyanates plurifonctionnelles : Les polyisocyanates
Comme pour les diisocyanates, les polyisocyanates sont surtout utilisés pour la fabrication des polyuréthanes : Poly-diisocyanate de diphénylméthylène (PMDI).
Réactivité de la fonction isocyanate
La fonction isocyanate peut réagir surtout avec les fonctions chimiques à hydrogène labile. Voici quelques exemples de réaction avec les isocyanates :
- Isocyanate + Amine = Urée
- Isocyanate + Alcool = Uréthane :
- Isocyanate + Eau = Amine + dioxyde de carbone
- Isocyanate + Acide carboxylique = Amide + dioxyde de carbone ou acylurée + monoxyde de carbone
- Isocyanate + Urée = Biuret
- Isocyanate + Uréthane = Allophanates
L’isocyanate peut aussi réagir avec ses semblables : Une dimérisation donne des urétidinediones et une trimérisation donne des isocyanurates.
En général, la vitesse de réaction pour l’addition d’un composé avec un groupement isocyanate est déterminée par sa basicité : plus le composé est basique plus sa vitesse de réaction avec un groupement isocyanate sera importante. La vitesse de réaction diminue dans l’ordre suivant :
Amines aliphatiques primaires > amines aliphatiques secondaires > NH3 > amines aromatiques > urées aliphatiques > alcools primaires > eau > acides carboxyliques > alcools secondaires > phénols > urées aromatiques > alcools tertiaires > uréthanes > amides.
D’autre part, la réactivité des groupements isocyanates dépend de l’effet inductif donneur – attracteur du groupement R de l’isocyanate RNCO. La réactivité forme alors la suite croissante suivante :
- ter-butyl- < cyclohexyl- < n-alkyl- < benzyl- < phényl- < para-nitrophenyl- < chlorosulfonyl-isocyanate.
Cependant la stabilité thermique de l’uréthane formé augmente dans le sens inverse.
Blocage de la fonction isocyanate
Afin de maîtriser la réactivité des fonctions isocyanates, le recours à leur blocage est effectué notamment pour permettre de stocker et conserver au cours du temps ces composés. Le blocage (appelé parfois protection, le terme protection ici ne correspond pas exactement au terme utilisé en chimie organique) est effectué en utilisant des molécules dites agent de blocage telles que les phénols, les lactames, les oximes… D'une manière générale les agents de blocage sont des composés à hydrogène labile. Pour obtenir des isocyanates bloqués soluble dans l'eau, l'agent de blocage classiquement utilisé est le bisulfite (HSO3-). Les isocyanates ainsi protégés restent réactifs avec de bons nucléophiles tels que les amines.
Utilisations
Les diisocyanates et les polyisocyanates sont utilisés pour la synthèse de polymères dont la chaîne squelettique contient les groupes fonctionnels composés de carbone, oxygène et azote comme surtout les polyuréthanes et les polyurées et beaucoup moins les polyimides et les polyamides.
Sécurité
Les isocyanates sont généralement des composés toxiques et réactifs, qu'il convient de manipuler avec précautions. Toute exposition directe aux isocyanates ou à leurs vapeurs doit être évitée.
Wikimedia Foundation. 2010.

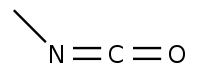


![\mathrm{R{-}NCO + H_2O \longrightarrow [R{-}NHCOOH]}](7/807b0be32ee3f48a834a6f66d1cf966c.png)
![\mathrm{[R{-}NHCOOH] \longrightarrow R{-}NH_2 + CO_2}](3/ec39fcf0808f8ee202bae1c5d88368ba.png)