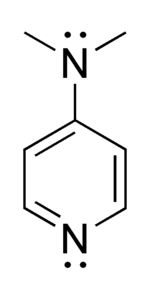
- 4-diméthylaminopyridine
-
La 4-diméthylaminopyridine ou DMAP est un dérivé de la pyridine avec une fonction diméthylamine en position para et de formule (CH3)2NC5H4N. Ce solide incolore est un catalyseur nucléophile utile dans un grand nombre de réactions comme des estérifications avec des anhydrides, la réaction de Baylis-Hillman (en), des hydrosilylations, des tritylations, le réarrangement de Steglich, la synthèse de Staudinger (en) de β-lactames et encore beaucoup d'autres. Des analogues chiraux de la DMAP sont utilisés dans des expériences de résolution cinétique (en), principalement, des alcools secondaires et d'auxiliaires d'Evans de type amide[5],[6],[7].
Sommaire
Préparation
La 4-diméthylaminopyridine peut être synthétisée par un protocole en deux étapes et partant de la pyridine. Celle-ci est oxydée en un cation 4-pyridylpyridinium qui réagit alors avec la diméthylamine[8] :
Catalyseur d'estérification
Dans le cas d'une estérification avec l'anhydride acétique, le mécanisme actuellement accepté consiste en trois étapes. Premièrement, la DMAP et l'anhydride acétique forment dans une réaction de pré-équilibre une paire d'ions labiles, un acétate et un acétylpyridinium. Dans la seconde étape, l'alcool à estérifier attaque le groupe acétyle pour former l'ester. Dans cette étape, l'anion acétate attire le proton de l'alcool tandis qu'il forme une liaison covalente avec le groupe acétyle. La liaison de l'acétyle avec la DMAP est coupée pour régénérer le catalyseur et former l'ester. La formation de la liaison ester et la coupure de celle entre la DMAP et l'acétyle sont synchrones et concertées sans l'apparition d'un intermédiaire tétraédrique. L'acide acétique formé (ion acétate + proton) protone alors la DMAP. Dans la dernière étape du cycle catalytique, une base auxiliaire (co-catalyseur sacrificiel), usuellement la triéthylamine, déprotone la DMAP protonée, régénérant le catalyseur. La réaction se déroule selon cette voie de réaction nucléophile, indépendamment de l'anhydride utilisé mais le mécanisme change avec la valeur du pKa de l'alcool utilisé. Par exemple, dans le cas d'un phénol, la réaction passe par un voie de réaction catalysée par une base. Dans ce cas, la DMAP agit comme une base qui déprotone le phénol, tandis que le phénolate formé réagit sur l'anhydride[9].
Sécurité
La DMAP a une toxicité relativement élevée et est particulièrement dangereuse en raison de sa capacité à être absorbée par la peau. Elle est aussi corrosive.
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « 4-Dimethylaminopyridine » (voir la liste des auteurs)
- 4-Dimethylaminopyridine sur ChemIDPlus.
- Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
- 4-(Dimethylamino)pyridine chez Sigma-Aldrich.
- MSDS 4-Dimethylaminopyridine.
- Donald J Berry, Charles V Digiovanna, Stephanie S Metrick and Ramiah Murugan, « Catalysis by 4-dialkylaminopyridines », dans Arkivoc, 2001, p. 201–226 [texte intégral]
- Höfle, G., Steglich, W., Vorbrüggen, H., « 4-Dialkylaminopyridines as Highly Active Acylation Catalysts », dans Angew. Chem. Int. Ed. Engl., vol. 17, 1978, p. 569–583 [lien DOI]
- Ryan P. Wurz, « Chiral Dialkylamine Catalysts in Asymmetric Synthesis », dans Chem. Rev., vol. 107, no 12, 2007, p. 5570–5595 [texte intégral, lien PMID, lien DOI]
- Shinkichi Shimizu, Nanao Watanabe, Toshiaki Kataoka, Takayuki Shoji, Nobuyuki Abe, Sinji Morishita, Hisao Ichimura, Pyridine and Pyridine Derivatives in "Ullmann's Encyclopedia of Industrial Chemistry", Wiley-VCH, Weinheim, 2007. DOI:10.1002/14356007.a22_399.
- S. Xu, I. Held, B. Kempf, H. Mayr, W. Steglich, H. Zipse, « The DMAP-Catalyzed Acetylation of Alcohols - A Mechanistic Study (DMAP = 4-(dimethylamino)-pyridine) », dans Chem. Eur. J., vol. 11, no 16, 2005, p. 4751–4757 [lien PMID, lien DOI]
Wikimedia Foundation. 2010.