- Flavonoïde
-
Les flavonoïdes (ou bioflavonoïdes) sont des métabolites secondaires des plantes partageant tous une même structure de base formée par deux cycles aromatiques reliés par trois carbones : C6-C3-C6, chaîne souvent fermée en un hétérocycle oxygéné hexa- ou pentagonal. Certains auteurs, comme Bruneton[1], préfèrent séparer, pour tenir compte de leurs propriétés particulières, les dérivés flavaniques, les anthocyanosides et les isoflavonoïdes et de conserver l'appellation de flavonoïdes stricto sensu pour les autres.
Les flavonoïdes sont responsables de la couleur variée des fleurs et des fruits et représentent une source importante d'antioxydants dans notre alimentation. Ils forment une sous-classe des polyphénols. Il y en a plus de 6000 à avoir été décrits chez les plantes.
Les flavonoïdes ont été découverts par Albert Szent-Györgyi en 1936 qui a reçu pour cela le prix Nobel de physiologie ou médecine, en 1937 (voir la section « histoire » en fin d'article). Dans les années 50, Jack Masquelier, de l'université de Bordeaux entreprend une étude des composés flavaniques de l'écorce de pin et des pépins de raisin et dépose des brevets sur la purification des procyanidines oligomères (ou pycnogénol) et leurs utilisations thérapeutiques.
Sommaire
Distribution
Les flavonoïdes sont largement distribués dans le règne végétal où ils sont présents le plus souvent sous la forme soluble d'hétérosides. Ils sont fréquents chez les Bryophyta (mousses et hépatiques), les Pteridophyta (fougères) et les Gymnospermae (conifères) mais c'est chez les Angiospermae qu'ils manifestent la plus grande diversité.
Ils interviennent dans la symbiose entre les fabacées et les bactéries du groupe rhizobium[2]. Les racines de luzerne relâchent des flavonoïdes qui attirent la bactérie Rhizobium meliloti et induisent chez elle les gènes de nodulation.
Couleur
Les flavonoïdes sont des pigments responsables de la colorations des fleurs et des fruits. Ils couvrent une large gamme de couleur allant du rouge à l'ultraviolet en passant par le jaune. Leur couleur dépend de leur structure mais aussi de l'acidité du milieu (pH). Les jaunes viennent des chalcones, aurones et flavonols jaunes, les rouges et les mauves des anthocyanosides, les bleus trouvent leurs origines dans les co-pigments flavones-anthocyanosides. L'absorption dans l'ultraviolet produit des motifs perceptibles par les insectes et capables de les guider vers le nectar[1].
Les pigments colorés des fleurs servent à attirer les insectes pollinisateurs. Ils jouent aussi un rôle dans la protection de la plante contre les UV et de défense contre les pathogènes et les insectes ravageurs.
On trouve ces pigments dans le rouge des pommes et des poires, dans les baies de genièvre, le miel, le raisin et le vin...
Les formes hétérosidiques des flavonoïdes sont hydrosolubles et s'accumulent dans les vacuoles.
Structure chimique
Les flavonoïdes présentent un squelette de base à 15 atomes de carbone, fait de deux cycles benzéniques C6 reliés par une chaîne en C3. Le pont à 3 carbones entre les deux phényles forme généralement un troisième cycle pyrone.
La distinction des sous-classes se fait sur la conformation de cette structure centrale C. On peut distinguer notamment dans les flavonoïdes[1],[3] :FLAVONOIDES stricto sensu 
CLASSE SQUELETTE Aglycones Hétérosides Dérivés méthoxylés FLAVONE 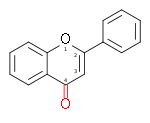
2-phénylchromen-4-oneLutéolol (OH:5,7,3',4')
Apigénol (OH:5,7,4')7-O--glucoside de lutéol,
6-C-glucoside d'apigénol,
ApiineTangeritine (CH3:5,6,7,8,4')
Nobilétine (CH3:5,6,7,8,3',4')
Géraldone (7,4'-dihydroxy-3'-méthoxyflavone)FLAVONOL 
3-hydroxy-2-phénylchromen-4-oneQuercétol, Kaempférol, Myricétol,
FisétolRutine (ou rutoside),
3,7,4'-O-triglucoside de kaempférol, 3-O-galactoside d'isorhamnétolPachypodol, Rhamnazine, 3,7-diméthylquercétol, Isorhamnétol (=3-méthylquercétol) DIHYDROFLAVONOL
ou
FLAVANONOL
3-hydroxy-2,3-dihydro-2-phénylchromen-4-onedihydrokaempférol, dihydroquercétol (=Taxifoline) 3-O-rhamnoside de dihydroquercétol, 3-O-rhamnoside de dihydromyricétol FLAVANONE  2,3-dihydro-2-phenylchromen-4-one
2,3-dihydro-2-phenylchromen-4-oneNaringétol, Eriodictyol, Butine Hespéridine (7-O-rutoside d'hespérétine),
Naringine, Néohespéridine, DidymineHespérétine, Homoeriodictyol AURONE 
Hispidol, Aureusidine, Sulfurétine, Maritimetine CHALCONE 
Isoliquiritigénine, Butéine Xanthohumol DIHYDROCHALCONE Phlorétine Aspalathine (=3-C-glucopyranosyldihydrochalcone),
Naringine dihydrochalcone, Néohespéridine dihydrochalcone, Nothofagine, Phloridzine1. les flavones
- aglycones : lutéolol : dans le thym, la sauge officinale, apigénol dans la bière, la ciboule, la marjolaine,
- leurs hétérosides : lutéolol 7-O-glucoside, dans les feuilles et les graines de céleri
- dérivés méthoxylés : tangérétine, nobilétine, dans le jus d'orange2. les flavonols réputés être les antioxydants les plus efficaces des flavonoïdes, très nombreux
- les aglycones : environ 380, kaempférol, dans les câpres, les mures, les tomates; quercétol, dans le piment, le cacao; myricétol dans la bière, le vin, la ciboule; fisétine
- leurs hétérosides : nombreux dans les produits alimentaires comme le kaempférol 3-O-glucoside dans le vin, les framboises, les haricots communs
- les dérivés méthoxylés : rhamnétine3. les dihydroflavonols ou flavanonol, sans double liaison entre C2 et C3 par rapport au précédent
- aglycones : dihydroquercétol dans l'origan américain Lippia graveolens
- leurs hétérosides : dihydroquercétol 3-O-rhamoside, dans le vin4. les flavanones, dérivés aussi 2,3-dihydrogénés
- aglycones : surtout présents dans les agrumes : ériodictyol dans la marjolaine; naringétol, dans le pomelo
- leurs hétérosides : naringine, dans le pamplemousse, le pomelo
- leurs dérivés méthoxylés : homoeriodictyol dans l'Herba Santa5. les aurones, 2-benzylidène-coumaranones, : hispidol, Aureusidin
6. les chalcones, au cycle pyranique ouvert
- aglycones : butéine, dans les fèves
- des hétérosides, des dérivés méthoxylés et prénylés : xanthohumorol dans le houblon et la bière7. les dihydrochalcones
- aglycones : phlorétine dans les feuilles de pommier
- leurs hétérosides : phloretin 2'-O-xylosyl-glucoside dans les pommes; naringine dihydrochalcone à la saveur sucrée intense; néohespéridine dihydrochalcone édulcorantCes 7 classes constituent les flavonoïdes sticto sensu. Au sens large, il faut inclure aussi :
FLAVANOLS, ANTHOCYANIDOLS CLASSE SQUELETTE Aglycones Gallates Polymères Hétérosides FLAVAN-3-OL 
Afzéléchol, Catéchine, (-)-épicatéchine, Gallocatéchine (-)-épicatéchine gallate EGC, (–)-épigallocatéchine gallate EGCG PROANTHOCYANIDOL (=tanin condensé), procyanidine, prodelphinidine
Théaflavine (dimère de catéchine), Théaflavine 3'-O-gallate, Théaflavine 3,3'-O-digallateépicatéchine (3-O-b)-D-glucopyranoside FLAVAN-3,4-DIOL Leucopélargonidol, Leucocyanidol,
LeucodelphinidolPROANTHOCYANIDOL (=tanin condensé) procyanidine,
prodelphinidines, proanthocyanidines oligomèresANTHOCYANIDOL
ou
ANTHOCYANIDINE
Cation flavyliumPélargonidol, Cyanidol, Delphinidol, Malvidol, Paéonidol ANTHOCYANOSIDES
(=anthocyanes) :
cyanidol 3,5-diglucoside,
cyanidol 3-O-(6"-acétyl-galactoside),
cyanidol 3-O-arabinoside,
delphinium 3,5-O-diglucoside8. les flavan-3-ols ou flavanols ou catéchines sans double liaison dans le cycle central
- - (+)-catéchine et (-)-épicatéchine dans le thé, le raisin, le cacao
- - leurs gallates : GC (+)-gallocatéchine, EGC, ECG, EGCG du thé vert
- - leurs polymères appelés proanthocyanidols ou tanins condensés sont classés dans les tanins. La théaflavine est un dimère du thé noir.
9. les flavan-3,4-diols ou flavanediols ou leucoanthocyanidines
- leucopélargonidol dans la noix de cajou, leucocyanidol (=procyanidol) dans la cacahouète, la cacao, le raisin, guibourtacacidine dans l'écorce d' Acacia cultriformis. Les proanthocyanidols sont des polymères de 3-flavanols, mais aussi de flavane-3,4--diols, de flavane, et de 5-désoxyflavan-3-ols.
10. les anthocyanidols (ou anthocyanidines sur le modèle anglais) construites sur le cation flavylium
- - aglycones : pélargonidol dans géraniums, framboises, prunes ; cyanidol dans les baies rouges, raisins, cerises
- - leurs hétérosides forment la classe des anthocyanes (ou anthocyanosides, ou anthocyanines sur le modèle anglais). Leur manifestation la plus spectaculaire se réalise dans les couleurs des feuilles à l'automne quand leur présence est révélée (ainsi que celle des caroténoïdes) par la disparition de la chlorophylle.
Les isoflavonoïdes, les néoflavonoïdes ou les tanins condensés sont structurellement rattachés aux flavonoïdes.
Propriétés physico-chimiques
Les hétérosides de flavonoïdes sont en général solubles dans l'eau et les alcools. Les génines sont pour la plupart, solubles dans les solvants organiques apolaires.
L'extraction est réalisée habituellement à l'aide du méthanol ou de mélanges méthanol-eau parfois d'acétonitrile-eau.
Propriétés biologiques
- Renforcement de la résistance des capillaires
Historiquement, c'est la première propriété reconnue aux flavonoïdes. On les dit "veinotoniques" car on peut montrer qu'ils sont capables de diminuer la perméabilité des capillaires et de renforcer leur résistance. Pour Bruneton[1] « les revues générales et les synthèses méthodiques avec méta-analyse récentes aboutissent plutôt à constater l'absence ou la faiblesse de preuves de l'effet des flavonoïdes dans le traitement de l'insuffisante veineuse chronique, effet au demeurant de valeur clinique incertaine ».
- Activité antioxydante
Les flavonoïdes agissent principalement comme antioxydants primaires, en stabilisant les radicaux peroxydes mais ils peuvent aussi désactiver les espèces oxygénées réactives (ion superoxyde, radical OH•, oxygène singulet), inhiber la lipoxygénase ou encore chélater les métaux[4]
La limitation principale de cette activité antioxydante est la faible biodisponibilité des flavonoïdes après ingestion d'aliments riches dans ces composés. La faible quantité absorbée entre en concurrence avec les autres piégeurs de radicaux libres (α-tocophérol, ascorbates et glutathione) présents dans des concentrations très supérieures[5]. Exception faite du tractus gastro-intestinal et peut-être du sang, l'action potentielle des polyphénols comme piégeurs de radicaux libres n'a probablement aucune signification physiologique dans la plupart des organes[6].
- Inhibiteurs enzymatiques
Les flavonoïdes sont, in vitro, des inhibiteurs enzymatiques de
-l'histidine-décarboxylase (par le quercétol et naringénine)
-l'élastase
-la hyaluronidase (par les flavones et les proanthocyanidols)
-la catéchol-O-méthyltransférase
etc.- Interactions avec les facteurs de transcription
Les flavanols (catéchines et procyanidines) peuvent moduler l'expression de nombreux gènes régulés par le facteur de transcription NF-κB[6].
Alimentation et santé
Les flavonoïdes sont naturellement présents dans les fruits et légumes de notre alimentation. On les retrouve aussi dans de nombreuses boissons : vin, bière, lait de soja, thé et chocolat. Deux études récentes évaluent la prise quotidienne au Royaume-Uni[7] à 182 mg et aux États-Unis[8] à 190 mg.
Les études épidémiologiques suggèrent un effet protecteur des fruits et légumes contre les maladies cardiovasculaires et le cancer. Outre les flavonoïdes, de nombreux constituants de ces fruits et légumes peuvent aussi concourir à expliquer cette association : fibres, vitamines et minéraux, glucosinolates, caroténoïdes etc. Arts & Hollman[9] après avoir passé en revue les études épidémiologiques les effets sur la santé de la consommation de flavonoïdes concluent que « Les données à l'heure actuelle suggèrent des effets bénéfiques des flavonoïdes et des lignanes sur les maladies cardiovasculaires mais pas sur le cancer, avec l'exception possible du cancer du poumon. ».
Histoire
Albert Szent-Gyorgyi découvrit par hasard les "bioflavonoïdes" en cherchant à traiter un patient souffrant d'une fragilité capillaire entraînant un saignement sous-cutané. Il donna d'abord une préparation impure de vitamine C, qui donna de bons résultats, mais quand plus tard, il eut recours à une solution pure, à sa grande surprise, il n'obtint aucun résultat.
Il retourna donc à la première préparation et avec son collègue, Rusznyak, ils isolèrent dans le jus de citron un facteur, nommé "citrine" qui diminue la perméabilité et accroît la résistance des capillaires (Nature 138, 1936). Il la nomma aussi vitamine P, avec la lettre P pour "perméabilité". Avec son associé, V. Bruckner, il montra que la citrine était un mélange d'hespéridine et de glycoside d'ériodictiol.
Après études, on s'aperçut qu'une carence en cette substance n'entrainant aucun syndrome particulier, et qu'on ne pouvait donc retenir le qualificatif de "vitamine"[10].
Références
- Bruneton, J., Pharmacognosie - Phytochimie, plantes médicinales, 4e éd., revue et augmentée, Paris, Tec & Doc - Éditions médicales internationales, 2009, 1288 p. (ISBN 978-2-7430-1188-8)
- Ueli A. Hartwig, Cecillia M. Joseph, and Donald A. Phillips, « Flavonoids Released Naturally from Alfalfa Seeds Enhance Growth Rate of Rhizobium meliloti », dans Plant Physiol., vol. 95, no 3, 1991, p. 797-803
- phenol-explorer
- P. Sarni-Manchado, V. Cheynier, Les polyphénols en agroalimentaire, Lavoisier, Editions Tec & Doc, 2006, 398 p. (ISBN 2-7430-0805-9)
- (en) Mónica Galleano, Sandra V. Verstraeten, Patricia I. Oteiza, Cesar G. Fraga, « Antioxidant actions of flavonoids: Thermodynamic and kinetic analysis », dans Archives of Biochemistry and Biophysics, vol. 501, 2010
- (en) Cesar G. Fraga, Monica Galleano, Sandra V. Verstraeten, Patricia I. Oteiza, « Basic biochemical mechanisms behind the health benefits of polyphenols », dans Molecular Aspects of Medicine, 2010, p. doi:10.1016/j.mam.2010.09.006
- Beking K, Vieira A., « An assessment of dietary flavonoid intake in the UK and Ireland. », dans Int J Food Sci Nutr., 2010
- Chun OK, Chung SJ, Song WO., « Estimated dietary flavonoid intake and major food sources of U.S. adults. », dans J. Nutr., vol. 137, no 5, 207, p. 1244-52
- Ilja CW Arts and Peter CH Hollman, « Polyphenols and disease risk in epidemiologic studies », dans The American Journal of Clinical Nutrition, vol. 81, 2005 [texte intégral]
- Miklos Gabor
Bruneton, J., Pharmacognosie - Phytochimie, plantes médicinales, 4e éd., revue et augmentée, Paris, Tec & Doc - Éditions médicales internationales, 2009, 1288 p. (ISBN 978-2-7430-1188-8)
- - (+)-catéchine et (-)-épicatéchine dans le thé, le raisin, le cacao
Wikimedia Foundation. 2010.


