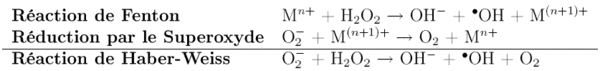- Superoxyde
-
 Notation de Lewis du superoxyde. Les 6 électrons de valence de chaque atome d'oxygène sont représentés en noir, l'électron supplémentaire en rouge.
Notation de Lewis du superoxyde. Les 6 électrons de valence de chaque atome d'oxygène sont représentés en noir, l'électron supplémentaire en rouge.
L'ion superoxyde, noté O2.- ou O2- (la deuxième écriture ne fait pas apparaître explicitement le caractère radicalaire) est issu de la réduction monoélectronique du dioxygène (O2)[1]. Contrairement à ce dernier, l'ion superoxyde est diamagnétique.
Sommaire
Composés de l'ion superoxyde
Des sels de l'ion superoxyde tels que le superoxyde de potassium (KO2) se forment naturellement par réaction directe du dioxygène avec certains métaux.
Stabilité en solution
Le superoxyde est thermodynamiquement instable, quel que soit le pH, par rapport à sa dismutation en peroxyde d'hydrogène H2O2 et en dioxygène O2. La réaction de dismutation nécessite des protons (H+).
Donc, aux pH élevés (faible concentration de H+) (donc une grande concentration de HO- , par rapport à la concentration de ions Hydrogène (H+) ) , les solutions contenant l'ion superoxyde peuvent avoir une certaine stabilité cinétique.
En revanche, l'ion superoxyde est stable en solution organique anhydre.
Importance biologique
L'ion superoxyde est une espèce réactive oxygénée (nom scientifique des « radicaux libres »). Il est naturellement produit dans toutes les cellules des êtres vivants respirant le dioxygène, en particulier dans les mitochondries.
L'ion superoxyde est toxique. Bien qu'il soit instable en solution aqueuse, sa concentration stationnaire serait trop élevée sans un système de protection : l'enzyme superoxyde dismutase.
La génération des radicaux hydroxyle par la réaction de Haber-Weiss.
Sa toxicité a principalement pour origine la réaction de Haber-Weiss. En effet le superoxyde peut réagir avec le peroxyde d'hydrogène, pour donner le radical hydroxyle hautement réactif, qui peut être à l'origine de l'oxydation des constituants cellulaires. Cette réaction est catalysé par des ions de certains métaux de transition, tels que le fer ou le cuivre.
Il peut aussi réagir avec le monoxyde d'azote pour donner l'anion peroxynitrite qui est un agent oxydant et nitrant puissant.
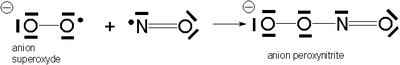 Équation chimique montrant la synthèse du peroxynitrite.
Équation chimique montrant la synthèse du peroxynitrite.
Bibliographie
- Sawyer, D. T. Superoxide Chemistry, McGraw-Hill, DOI:10.1036/1097-8542.669650
Wikimedia Foundation. 2010.