- Cancer Du Poumon
-
Cancer du poumon
Cancer du poumon
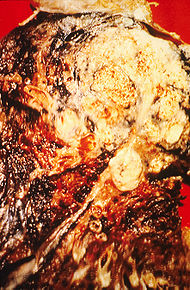
Classification et ressources externesSection d'un poumon humain. La partie blanche du lobe supérieur est cancéreuse ; les parties grises sont décolorées par le tabagisme CIM-10 C33.-C34. CIM-9 162 DiseasesDB 7616 MedlinePlus 007194 eMedicine med/1333 MeSH D002283 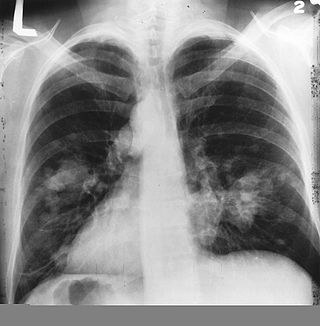 Radiographie du thorax vu de face montrant un cancer probable du poumon (taches claires à droite de chacun des poumons).
Radiographie du thorax vu de face montrant un cancer probable du poumon (taches claires à droite de chacun des poumons).
Le cancer du poumon ou cancer bronchique est une maladie due à une croissance cellulaire anarchique dans les tissus du poumon. Cette croissance peut donner des métastases, qui sont l'invasion de tissus adjacents ou l'infiltration en-dehors des poumons. La grande majorité des cancers du poumon primaires sont des carcinomes du poumon, qui proviennent des cellules épithéliales. Selon l'OMS, c'est la cause la plus fréquente de décès par cancer chez les hommes, et, après le cancer du sein, chez les femmes[1]. Il est la cause de 1,3 millions de décès par an dans le monde[2]. Les symptômes les plus fréquents sont le souffle court, la toux (éventuellement les crachements de sang), et l'amaigrissement[3].
Les principaux types de cancer du poumon sont le « carcinome à petites cellules » et le « carcinome non à petites cellules ». Cette distinction est importante, parce que le traitement en dépend : le carcinome du poumon non à petites cellules est souvent traité par chirurgie, tandis que le carcinome à petites cellues répond mieux généralement à la chimiothérapie et à la radiothérapie[4].
La cause la plus fréquente de cancer du poumon est l'exposition chronique à la fumée de tabac[5], y compris au tabagisme passif[6],[7]. L'incidence du cancer du poumon chez les non-fumeurs, qui représentent environ 15% des cas[8], est souvent attribuée à une combinaison de facteurs génétiques[9],[10], au radon dans l'air[11], à l'amiante[12], et à la pollution de l'air[13],[14]
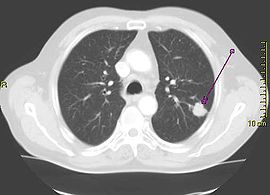
Le cancer du poumon peut être vu sur les radiographies thoraciques et le scanner. Le diagnostic est confirmé par une biopsie. Ceci se fait généralement par bronchoscopie, ou par biopsie guidée par scanner. Le traitement et le pronostic dépendent du type histologique du cancer, de son stade (degré de dissémination), et de l'état général de santé du patient.
Sommaire
Classification
La grande majorité des cancers du poumon sont des carcinomes – états de prolifération maligne des cellules épithéliales. Il y a deux types principaux de carcinomes du poumon, classés selon la taille et l'aspect des cellules malignes examinées au microscope par un histopathologiste : carcinomes non à petites cellules (80,4%) ou à petites cellules (16,8%)[15]. Cette classification, basée sur des critères histologiques, a des implications importantes pour la conduite clinique et le pronostic de la maladie.
Carcinomes non à petites cellules 80.4 Carcinomes à petites cellules 16.8 Carcinoïdes (tumeurs neuroendocrines)[16] 0.8 Sarcomes[17] 0.1 Cancers non caractérisés 1.9 Type histologique Fréquence (%) Fréquences des types histologiques du cancer du poumon
Carcinomes non à petites cellules
Les carcinomes non à petites cellules sont rassemblés parce que leur pronostic et leur traitement sont semblables. On en distingue trois sous-types : carcinomes du poumon épidermoïde, adénocarcinomes, parmi lesquels on distingue les sous-types papillaire, solide, acinaire et bronchioloalvéolaire et carcinomes du poumon à grandes cellules.
Carcinome épidermoïde 42 33 Adénocarcinome (tous types) 39 35 Carcinome bronchioloalvéolaire 4 10 Carcinoïde 7 16 Autres 8 6 Sous-type histologique Fumeurs Jamais-fumeurs Fréquence des carcinomes non à petites cellules (%) Carcinomes non à petites cellules : fumeurs et jamais-fumeurs[18]. Représentant 31,2% des cancers du poumons[15], le carcinome épidermoïde du poumon débute généralement près d'une bronche majeure. On trouve fréquemment au centre de la tumeur une cavité creuse contenant du tissu nécrosé. Les cancers épidermoïdes du poumon bien différenciés croissent souvent plus lentement que d'autres types de cancers[4].
L'adénocarcinome est responsable de 29,4 % des cancers du poumon[15]. Il a généralement son origine dans le tissu pulmonaire périphérique. La plupart des cas d'anénocarcinome sont associés au tabagisme ; cependant, parmi les personnes qui n'ont jamais fumé ("jamais-fumeurs"), l'adénocarcinome est la forme la plus fréquente de cancer du poumon[19].
Le sous-type bronchioloalvéolaire est plus commun chez les femmes jamais-fumeuses, et peut avoir des réactions différentes aux traitements[20].
Carcinome du poumon à petites cellules
Le carcinome du poumon à petites cellules (aussi appelé oat cell carcinoma ⇔ « carcinome à cellules avoine ») est moins courant. Il a tendance à survenir dans les voies aériennes les plus grandes (bronches primaires et secondaires), et grossit vite, pour devenir assez grand[21]. La « cellule avoine » contient des granules neurosécréteurs denses (vésicules contenant des neurohormones) qui donnent une association de syndromes endocriniens et paranéoplasiques[22]. Bien que plus sensible au début à la chimiothérapie, il entraîne cependant un pronostic plus défavorable, et en est souvent au stade des métastases à la détection. Les cancers du poumon à petites cellules sont divisés en maladie à un stade limité ou à un stade extensif. Ce type de cancer est fortement associé au tabagisme[23].
Autres
Chez les bébés et les enfants, les cancers du poumon primaires les plus répandus sont le blastome pleuropulmonaire et la tumeur carcinoïde[24].
Cancers secondaires
Le poumon est un endroit fréquent pour le développement de métastases de tumeurs d'autres parties du corps. Ces cancers secondaires sont identifiés par l'organe d'origine ; ainsi, une métastase de cancer du sein dans le poumon est encore reconnue comme cancer du sein. Ils ont souvent une apparence ronde caractéristique à la radiographie[25]. Chez les enfants, la majorité des cancers du poumon sont secondaires[24].
Les cancers primaires du poumon font des métastases préférentiellement vers les glandes surrénales, le foie, le cerveau et les os[4].
Évolution
Article détaillé : Stades du cancer du poumon.Les stades du cancer du poumon sont caractérisés par le degré d'extension du cancer à partir de son site originel. C'est un facteur important dans le pronostic et les traitements potentiels du cancer du poumon. Le carcinome du poumon non à petites cellules évolue du stade IA (« un A » ; le meilleur pronostic) IB ou II, à IV (« quatre » ; le cancer métastatique ou généralisé, le pire pronostic)[26]. Le carcinome du poumon à petites cellules est classé comme au stade limité s'il est confiné à une moitié de la poitrine, et dans le champ d'une seule radiothérapie ; autrement, il est classé au stade extensif[21].
Causes ou facteurs de risque
Les principales causes du cancer du poumon (et du cancer en général) comprennent les cancérigènes, (tels ceux qu'on trouve dans la fumée de tabac), les rayonnements ionisants, et les infections virales. L'exposition à ces causes provoque des changements, qui se cumulent, dans l'ADN du tissu recouvrant l'intérieur des bronches (l'épithélium bronchique). Plus le tissu est altéré, plus les risques de développer un cancer augmentent[4].
Le cancer bronchique est reconnu comme maladie professionnelle, en France, en cas d'exposition : aux radiations ionisantes, à l'amiante, au chrome, au nickel, aux goudrons, aux arséniates et à certains autres produits chimiques.
Tabagisme
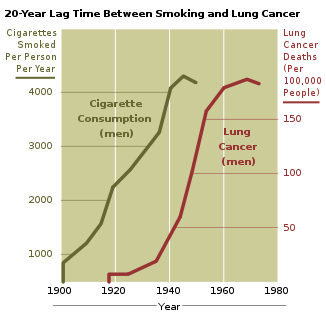
Le tabagisme, en particulier la fumée de cigarettes, est de loin la cause principale de cancer du poumon[27]. Dans le monde développé, presque 90% des décès dus au cancer du poumon sont dus au tabagisme[28]. Aux États-Unis, on estime que la fumée du tabac est responsable de 87% des cas de cancer du poumon (90% des hommes, 85% des femmes)[29]. Parmi les hommes qui fument, le risque, cumulé le long de toute la vie, de développer un cancer du poumon est 17,2% ; pour les femmes il est de 11,6%. Ce risque est significativement plus bas chez les non-fumeurs : 1,3% chez les hommes et 1,4% chez les femmes[30]. La fumée de tabac contient plus de 60 cancérigènes connus[31], comprenant les radioisotopes de la chaîne de désintégration du radon, la nitrosamine et le benzopyrène. En outre, il semble que la nicotine diminue la réponse immunologique aux développements malins dans les tissus exposés[32].
Le temps écoulé pendant qu'une personne fume, et le rythme de cette activité, accroissent le risque pour cette personne d'avoir un cancer du poumon. Si une personne s'arrête de fumer, le risque décroît constamment, à mesure que les dommages apportés au tissu des poumons sont réparés, et que les particules contaminantes sont progressivement éliminées[33]. En outre, il y a des indices que le cancer du poumon chez les jamais-fumeurs a un meilleur pronostic que chez les fumeurs[34], et que les patients qui fument au moment du diagnostic ont des temps de survie inférieur à ceux qui avaient cessé[35].
Le tabagisme passif – inhalation de la fumée de quelque autre fumeur – est une cause de cancer du poumon chez les non-fumeurs. Un fumeur passif peut être classé comme quelqu'un qui vit ou bien qui travaille avec un fumeur. Des études faites aux États-Unis[36], Europe[37], Grande-Bretagne[38], Australie[39] et France[40] ont démontré de façon cohérente un accroissement significatif du risque relatif parmi les individus exposés passivement à la fumée. Une étude récente sur le courant de fumée secondaire (échappé directement de la cigarette par le bout incandescent) suggère qu'il est plus toxique que la fumée inhalée directement[41].
Radon
Le radon est un gaz incolore et inodore, engendré par la radioactivité du radium, qui provient lui-même de celle de l'uranium, que l'on trouve dans la croûte terrestre. Le radon est lui-même à son tour radioactif, et ses produits de désintégration se désintègrent à leur tour, dans une chaîne se terminant par l'isotope 206, non radioactif, du plomb. Chacune de ces désintégrations s'accompagne de l'émission de rayonnements ionisants, qui sont capables de briser les molécules de matière sur leur passage, et en particulier les molécules de l'ADN formant les gènes, ce qui cause des mutations qui peuvent provoquer le cancer.
L'exposition au radon est la deuxième cause de cancer du poumon, après le tabac [11]. Elle serait responsable de 13 % des décès par cancer du poumon, soit environ 3 350 chaque année en France, et de 9 % en Europe.
La concentration en radon varie selon les lieux et la composition de leur sol et de leur sous-sol. Par exemple, dans des région comme les Cornouailles (en Grande-Bretagne), ou la Bretagne (en France), dont le sous-sol est en granit, qui a en outre fréquemment servi de matériau de construction, le radon est un problème majeur, et les maisons devraient être aérées avec des ventilateurs, pour abaisser la concentration en radon. La United States Environmental Protection Agency [n 1] (EPA) estime qu'une maison sur 15 aux États-Unis a un niveau de radon supérieur à la limite recommandée de 4 picocurie par litre (pCi/l) soit 146 becquerel par mètre cube (146 Bq/m³ c'est-à-dire 146 désintégrations/m³/s)[42]. L'Iowa a la plus haute concentration moyenne en radon aux États-Unis ; des études qui y ont été menées ont montré un accroissement de 50% du risque de cancer du poumon, par exposition prolongée à des concentrations au-dessus du niveau référence de l'EPA de 4 pCi/l [43], [44]. L'EPA estime qu'aux États-Unis le radon est la première cause de cancer du poumon chez les non-fumeurs, et la deuxième cause après le tabagisme actif[45].
Rayonnements ionisants
D'autres rayonnements ionisants (rayons X et gamma en particulier), peuvent induire des cancers dans la plupart des organes. Les radiographies fréquentes augmentent le risque de cancer du sein et, peut-être, d'autres cancers, a conclu une étude récente de l'Institut national de la santé et de la recherche médicale (Inserm) : en 2008, l’Inserm, à la demande de l'AFSET a produit une revue de la littérature scientifique mondiale relative aux liens entre 9 cancers en forte et récente augmentation et l'exposition passive à des cancérogènes, avérés ou suspectés dans l'environnement (incluant donc le tabagisme passif, mais non le tabagisme actif)[46]. Or ces examens sont de plus en plus fréquents (+ 5 à 8 % par an en France).
Amiante
L'amiante peut provoquer une variété de maladies du poumon, y compris le cancer. Il y a une synergie entre le tabagisme et l'amiante pour la survenue du cancer du poumon[12]. En Grande-Bretagne, l'amiante est à l'origine de 2 à 3 % des décès d'hommes par cancer du poumon[47]. L'amiante peut aussi provoquer le cancer de la plèvre, appelé mésothéliome (qui est différent du cancer du poumon).
En France, l'amiante est à l'origine de 2 000 à 3 000 cancers du poumon chaque année en France (ces chiffres pourraient augmenter dans l'avenir).
Autres produits chimiques
On a noté tout un ensemble de substances dont les composants inhalés pouvaient également conduire à des cancers du poumon, en particulier les composés de chrome, de nickel, d'arsenic, et les oxydes de fer.
Le cancer bronchique est reconnu comme maladie professionnelle, en France, en cas d'exposition : aux radiations ionisantes, à l'amiante, au chrome, au nickel, aux goudrons, aux arséniates et à certains produits chimiques.
Virus
On sait que les virus peuvent provoquer le cancer du poumon chez les animaux[48],[49], et des résultats récents suggèrent une possibilité analogue chez les humains. Les virus impliqués comprennent le papillomavirus de l'homme[50], qui est déjà la cause de nombreux cancers du col de l'utérus, le papovavirus JC40[51], le virus simien 40 (SV40), le polyomavirus BK, le cytomegalovirus[52] et le VIH. Ces virus peuvent affecter le cycle cellulaire et inhiber l'apoptose, ce qui permet une division cellulaire incontrôlée.
Étiologie
Comme beaucoup d'autres cancers, le cancer du poumon est provoqué par l'activation d'oncogènes, ou par l'inactivation de gènes suppresseurs de tumeurs[53]. Les oncogènes sont des gènes dont on pense qu'ils rendent leurs porteurs plus susceptibles de développer un cancer. Les proto-oncogènes sont soupçonnés de se transformer en oncogènes sous l'action de certains cancérigènes[54]. Des mutations dans le proto-oncogène K-ras sont responsables de 10 à 30 % des adénocarcinomes du poumon[55],[56]. Le récepteur à l'EGF (facteur de croissance épidermique), ou sous son sigle anglo-saxon EGFR, contrôle la prolifération, l'apoptose, l'angiogénèse et l'invasion par la tumeur[55]. Les mutations et l'amplification de l'EGFR sont fréquents dans le cancer du poumon non à petites cellules, et servent de base pour le traitement par les inhibiteurs de l'EGFR. HER2/neu est moins souvent affecté[55]. Des dommages chromosomiques peuvent conduire à une perte d’hétérozygotie. Ceci peut provoquer l'inactivation des gènes anti-oncogènes. Des dommages aux chromosomes 3p, 5q, 13q et 17p sont particulièrement fréquents dans le carcinome du poumon à petites cellules. Le gène suppresseur de tumeur p53, situé sur le chromosome 17p est affecté dans 60 à 75 % des cas[57]. D'autres gènes qui sont également souvent mutés ou amplifiés sont c-MET, NKX2-1, LKB1, PIK3CA et BRAF[55].
Une susceptibilité individuelle d'origine génétique peut aussi survenir. Différentes mutations favorisantes ont été ainsi décrites : sur l'EGFR[58] ou dans une région du chromosome 15q[59], correspondant à un gène codant pour un récepteur à un dérivé nicotinique[60]. La mutation sur un gène intervenant dans la réparation de l'ADN favoriserait également ces cancers[61].
Divers polymorphismes génétiques sont associés au cancer du poumon. Ils comprennent des gènes codant pour l'interleukine 1[62], le cytochrome P450[63], des promoteurs d'apoptose tels que la caspase-8[64], et les molécules réparatrices de l'ADN telles que l'XRCC1[65]. Les porteurs de tels polymorphismes ont plus de risques de développer un cancer du poumon après exposition aux cancérigènes.
Une étude récente a suggéré que l'allèle 309G du MDM2 est un facteur de risque à faible pénétration pour le développement de cancer du poumon chez les Asiatiques[66].
Prévention
La prévention est la meilleure et la moins coûteuse des manières de combattre le cancer du poumon. Tandis que dans la majeure partie des pays, les cancérigènes industriels et domestiques ont été identifiés et interdits, le tabagisme est encore très répandu. L'élimination du tabagisme est un but primordial dans la prévention du cancer du poumon, dont il demeure l'origine à 90 %, et l'arrêt du tabac est un instrument préventif majeur dans ce processus[67]. Les plus importants sont les programmes de prévention à l'égard des jeunes. En 1998, un Accord cadre de règlement (en:Master Settlement Agreement) permit à 46 états des États-Unis d'exiger un paiement annuel de la part de l'industrie du tabac[68]. Sur les montants de ces règlements et des taxes sur le tabac, les départements de la santé publique de chaque état financent leurs programmes de prévention, sans toutefois arriver au montant préconisé par le Center for Disease Control, qui s'élèverait à 15 % de ces sommes[68].
Les politiques d'intervention pour diminuer le tabagisme passif dans les lieux publics, comme les restaurants et les lieux de travail se sont répandues dans beaucoup de pays occidentaux. La Californie est venue en tête, en interdisant de fumer dans les lieux publics en 1998. L'Irlande a joué un rôle semblable en Europe en 2004, suivie par l'Italie et la Norvège en 2005, l'Écosse et plusieurs autres en 2006, l'Angleterre en 2007 et la France en 2008. La Nouvelle-Zélande a interdit de fumer dans les lieux publics dès 2004. L'état du Bhoutan a complètement interdit de fumer en 2005[69]. Dans beaucoup de pays, des groupes de pression font campagne pour des interdictions similaires. En 2007, Chandigarh devint la première ville d'Inde à devenir sans tabac. L'Inde a introduit une interdiction totale de fumer dans les lieux publics le 2 octobre 2008.
Les arguments cités contre l'interdiction sont la criminalisation du tabagisme, les risques croissants de contrebande, et tout simplement la difficulté de contrôler cette interdiction[70].
Une étude faite en 2008 sur 75 000 personnes d'âges moyen et avancé a démontré que l'usage à long terme de suppléments multivitaminiques – vitamines C, E et folate – ne réduit pas le risque de cancer du poumon. Au contraire, l'étude indique que la prise à long terme à hautes doses de suppléments en vitamine E peut même augmenter ce risque[71].
L'Organisation mondiale de la santé (OMS) a demandé aux gouvernements d'instituer une interdiction totale sur la publicité pour le tabac, pour éviter aux jeunes de commencer à fumer. Elle a estimé que ce genre d'interdiction a réduit la consommation de 16 % là où il a été institué[72].
Dépistage
Le dépistage est l'utilisation de tests médicaux pour détecter une maladie chez les personnes qui ne manifestent pas encore de symptôme. Des tests de dépistage envisageables pour le cancer du poumon comprennent la radiographie ou le scanner de la poitrine. Jusqu'à présent, les programmes de dépistage contre le cancer du poumon n'ont pas démontré d'avantages clairs. Des essais systématiques randomisés sont lancés dans ce domaine pour déterminer si une décroissance de la mortalité à long terme peut être directement observée par examens au scanner[73].
Diagnostic
Signes et symptômes
Les signes cliniques suggérant un cancer du poumon sont multiples mais souvent peu expressifs[74],[3] :
- difficulté à respirer
- essoufflement anormal
- respiration sifflante
- dysphonie (voix rauque)
- toux chronique ou changement dans les rythmes habituels de toux chronique
- hémoptysie (crachements de sang)
- infections respiratoires récidivantes ou répondant mal au traitement
- douleurs thoraciques, parfois liées à une pleurésie, ou dans l'abdomen, l'épaule ou le bras
- cachexie (perte de poids), fatigue, altération de l'état général, asthénie (état de faiblesse, grande fatigue), perte d'appétit
- hippocratisme digital – bombement des doigts à l'extrémité, en particulier des ongles (peu fréquent)
- dysphagie (difficulté à avaler)
Si le cancer se développe dans les voies aériennes, il peut gêner le flux d'air, causant ainsi des difficultés à respirer. Ceci peut amener à une accumulation de sécrétions derrière l'obstacle, prédisposant le patient à la pneumonie. Beaucoup de cancers du poumon sont richement irrigués par la circulation sanguine. La surface du cancer peut être fragile, ce qui amène le cancer à saigner dans les voies aériennes. Ce sang peut ensuite être expectoré.
Diagnostic différentiel
Selon le type de tumeur, un syndrome paranéoplasique peut attirer l'attention sur la maladie à son début[75]. Dans le cancer du poumon, ces phénomènes peuvent comprendre le syndrome myasthénique de Lambert-Eaton (faiblesse musculaire due à des auto-anticorps), l'hypercalcémie, ou le syndrome de Schwartz-Bartter (sécrétion anormale d'hormone antidiurétique par la tumeur). Les tumeurs du sommet du poumon[76], peuvent (syndrome de Pancoast-Tobias) envahir la partie voisine du système nerveux sympathique, conduisant à des changements dans la transpiration, et à des problèmes des muscles de l'œil (une combinaison désignée par syndrome de Claude Bernard-Horner), ainsi qu'une faiblesse des muscles de la main due à l'invasion du plexus brachial.
Beaucoup des symptômes du cancer du poumon (douleurs osseuses, fièvre et perte de poids) sont non-spécifiques ; chez les patients âgés, ils peuvent être attribués à une comorbidité[4]. Chez beaucoup de patients, le cancer s'est déjà étendu au-delà du site original au moment où le patient ressent les premiers symptômes et consulte. Des sites fréquents de métastases sont le cerveau, les os, les glandes surrénales, le poumon contralatéral (de l'autre côté), le foie, le péricarde et les reins[77]. Environ 10% de tous les patients atteints par le cancer du poumon n'ont pas de symptôme diagnostic ; ces cancers sont découverts par hasard à la suite d'une radiographie de la poitrine[3].
La radiographie thoracique est la première mesure à prendre si un patient se plaint de symptômes pouvant suggérer un cancer du poumon. Ceci peut révéler une masse évidente, un élargissement du médiastin (qui suggère une extension aux ganglions lymphatiques qui s'y trouvent), une atélectasie (affaissement), une inflammation (pneumonie) ou une effusion pleurale. En l'absence de signes radiographiques, mais si les soupçons sont élevés (par exemple, un gros fumeur avec hémoptysie), une bronchoscopie ou un scanner peuvent donner l'information nécessaire. La bronchoscopie ou la biopsie guidée par scanner sont souvent utilisées pour identifier le type de tumeur[3].
La présence de cellules atypiques dans les crachats est associée à un risque accru de cancer du poumon. Un examen cytopathologique des crachats (ECBC), combiné à d'autres examens de détection peut jouer un rôle important dans le diagnostic précoce du cancer du poumon[78].
Le diagnostic différentiel pour les patients qui présentent des anomalies de la radiographie thoracique consiste à distinguer le cancer du poumon des maladies non malignes. Ces dernières peuvent être des infections, telles que la tuberculose ou la pneumonie, ou des inflammations comme la sarcoïdose. Ces maladies peuvent donner lieu à des lymphadénopathies du médiastin, ou à des nodules du poumon, qui peuvent imiter des cancers du poumon[4]. Le cancer du poumon peut par contre être une trouvaille incidentelle : un nodule pulmonaire solitaire (lésion en "pièce de monnaie") vu sur une radiographie du thorax ou un scanner pris pour une toute autre raison.
En outre, il existe un ensemble de marqueurs tumoraux pour divers types de cancers :
Traitement
Le traitement du cancer du poumon dépend du type exact de cellule du cancer, de l'extension du cancer, et de l'état général de santé du patient. Les traitements les plus courants comprennent la chirurgie, la chimiothérapie et les divers types de radiothérapie[3],[79].
Chirurgie
Si les examens confirment le cancer du poumon, le scanner et souvent la tomographie à émission de positons (TEP) sont utilisés pour déterminer si le cancer est localisé et possible à traiter par chirurgie, ou bien s'il s'est étendu au point de ne plus pouvoir être éliminé par la chirurgie. Des tests sanguins et la spirométrie (test de la fonction respiratoire) sont également nécessaires pour déterminer si le patient va assez bien pour supporter l'opération. Si la spirométrie révèle une faible réserve respiratoire (souvent due à un syndrome ventilatoire obstructif), la chirurgie peut être contre-indiquée.
L'opération chirurgicale en elle-même a un taux de décès d'environ 4,4 %, en fonction de l'état des poumons du patient et d'autres facteurs de risque[80]. La chirurgie est d'habitude seulement une option sur les carcinomes non à petites cellules, limités à un seul poumon, jusqu'au stade IIIA. Ceci est déterminé par imagerie médicale (scanner ou TEP). Une réserve respiratoire préopératoire suffisante doit être présente, pour permettre au poumon de fonctionner correctement après résection du tissu.
Les procédures comprennent la résection cunéiforme périphérique (résection d'une partie d'un lobe), la segmentectomie (résection d'une division anatomique d'un lobe), la lobectomie (un lobe), la bilobectomie (deux lobes), ou la pneumonectomie (poumon entier). Chez les patients disposant d'une réserve respiratoire suffisante, la lobectomie est le choix préféré, car c'est la méthode qui minimise le risque d'une récurrence locale. Si la réserve respiratoire est insuffisante, on peut préférer la résection cunéiforme[81]. Une brachytherapy ⇔ brachythérapie (utilisation de l'intervention chirurgicale pour introduire un élément radioactif, conduisant ainsi à une intervention radiologique en même temps que chirurgicale) à l'iode radioactif sur les lèvres de la résection cunéiforme peut abaisser le taux de récurrence à celui de la lobectomie[82]
La chirurgie thoracoscopique par vidéo-endoscopie (CTVE) et même la lobectomie par CTVE ont permis des méthodes avec effraction minimale pour la chirurgie de cancer du poumon, qui peuvent avoir les avantages de récupération plus rapide, séjour hospitalier diminué, et frais hospitaliers plus bas[83].
Chimiothérapie
Le carcinome du poumon à petites cellules est traité principalement par la chimiothérapie et la radiothérapie, car la chirurgie n'a pas montré d'avantage pour la survie. Une chimiothérapie primaire est aussi utilisée pour les carcinomes non à petites cellules déjà métastasés.
Le traitement dépend du type de tumeur. Le carcinome non à petites cellules est souvent traité par le cisplatine ou le carboplatine, en combinaison avec la gemcitabine, le paclitaxel, le docétaxel, l'étoposide, ou la vinorelbine[84]. Pour le carcinome à petites cellules, le cisplatine et l'étoposide sont le plus fréquemment utilisés[85]. Mais on utilise aussi des combinaisons de carboplatine, gemcitabine, paclitaxel, vinorelbine, topotecan, et irinotecan[86],[87].
Dans le stade étendu du cancer du poumon à petites cellules, le célécoxib peut être combiné avec l'étoposide, avec sécurité, cette combinaison ayant montré des améliorations dans le résultat[88]. Malheureusement le cancer rechute en général très rapidement, sans possibilité de traitement efficace. La survie médiane des patients avec un cancer bronchique à petites cellules métastatiques est de 9 mois. Un essai clinique (IFCT-0802) est en cours pour évaluer l'intérêt du bevacizumab en association avec la chimiothérapie standard (cisplatine + étoposide).
Chimiothérapie adjuvante pour le carcinome du poumon non à petites cellules
Une chimiothérapie adjuvante est une chimiothérapie utilisée après la chirurgie pour en améliorer les chances de succès. Pendant la chirurgie, on prélève des échantillons des ganglions lymphatiques. Si ces échantillons contiennent des cellules cancéreuses, le patient en est au stade II ou III de la maladie. Dans ce cas, une chimiothérapie adjuvante peut accroître les chances de survie jusqu'à 15%[89],[90].
La pratique courante est de proposer une chimiothérapie à base de platine (cisplatine ou carboplatine)[91]
La chimiothérapie adjuvante pour les patients souffrant d'un cancer au stade IB est controversée, les essais cliniques n'ayant pas clairement démontré de bénéfice en termes de survie[92],[93]. Les essais de chimiothérapie préopératoire (chimiothérapie néoadjuvante) pour les carcinomes du poumon non à petites cellules réséquables se sont montrés non concluants[94].
Radiothérapie
La radiothérapie est souvent menée en parallèle avec la chimiothérapie, et peut être utilisée dans une intention curative chez les patients souffrant de carcinomes du poumon non à petites cellules qui ne sont pas susceptibles d'être opérés chirurgicalement. Cette forme de radiothérapie à haute intensité est appelée radical radiotherapy ⇔ radiothérapie radicale[95]. Une amélioration de la technique consiste en radiothérapie continue hyperfractionnée accélérée, où une forte dose de radiothérapie est donnée sur un temps bref[96]. Pour le carcinome du poumon à petites cellules potentiellement curable, l'irradiation de la poitrine est souvent recommandée en addition de la chimiothérapie[97]. L'utilisation de la radiothérapie thoracique adjuvante après une chirurgie à but curatif, dans les cas de carcinome du poumon non à petites celllules n'a pas de statut bien établi, et reste controversée. Les bénéfices éventuels seraient limités à ceux où la tumeur s'est étendue aux ganglions lymphatiques médiastinaux[98],[99].
Tous stades confondus, seulement 10 % des patients présentant un cancer bronchique ont une survie à 5 ans, essentiellement parmi ceux présentant un stade précoce, opérable d'emblée. Au moment du diagnostic, environ 30 % des patients se présentent avec un stade précoce, 30 % avec une tumeur localisée au thorax mais trop avancée pour pouvoir bénéficier d'un traitement chirurgical, et 30 % avec une maladie au stade métastatique.
Pour les patients affectés de carcinomes tant à petites cellules que non à petites cellules, de plus faibles doses de radiation à la poitrine peuvent être utilisées pour le contrôle des symptômes (radiothérapie palliative), notamment la douleur provoquée par les métastases dans les os. Contrairement aux autres traitements, il est possible de prescrire une radiothérapie palliative sans diagnostic histologique de cancer du poumon.
La brachytherapy ⇔ brachythérapie (radiothérapie localisée à haute dose) peut être appliquée directement sur la voie aérienne quand le cancer affecte une courte portion de bronche[100]. Elle est utilisée quand un cancer du poumon inopérable bloque une grosse voie aérienne[101].
Les patients affectés d'un carcinome du poumon à petites cellules, à un stade limité, reçoivent souvent une irradiation crânienne prophylactique (ICP). C'est un type de radiothérapie du cerveau, utilisé pour réduire les risques de métastase[102]. Plus récemment, l'ICP a été montrée bénéfique pour les patients affectés d'un cancer du poumon à petites cellules étendu. Chez les patients dont le cancer a été amélioré suite à une chimiothérapie, l'ICP a montré sa capacité à réduire le risque total de métastase cérébrale dans l'année de 40,4% à 14,6%[103].
Les améliorations récentes dans la visée et l'imagerie ont permis le développement d'irradiation extracorporelle stéréotaxique dans le traitement du cancer du poumon aux stades précoces. Dans cette forme de radiothérapie, de très hautes doses sont appliquées en un petit nombre de séances en utilisant des techniques de visée stéréotaxique. Elle est utilisée en première intention chez les patients non susceptibles de chirurgie en raison de contre-indications médicales dues à d'autres maladies[104].
Radiologie d'intervention
L'ablation par radiofréquence devrait à l'heure actuelle être considérée comme une technique de recherche dans le traitement du carcinome bronchogénique. Elle se fait par insertion d'une petite tête chauffante dans la tumeur pour tuer les cellules cancéreuses[105].
Thérapie ciblée
Dans les années récentes, diverses thérapies avec des molécules ciblées ont été développées pour le traitement du cancer du poumon avancé. Le en:gefitinib ⇔ gefitinib (Iressa) est un de ces médicaments, dont la cible est le domaine tyrosine kinase de l'EGFR, exprimé dans beaucoup de cas de carcinomes non à petites cellules. Il n'a pas montré d'accroissement du taux de survie, bien que les femmes, les Asiatiques, les non-fumeurs et les patients souffrant de carcinome bronchioloalvéolaire paraissent tirer des bénéfices du gefitinib[20], [106].
L'erlotinib (Tarceva), un autre inhibiteur de la tyrosine kinase, a montré son aptitude à accroître le taux de survie des patients souffrant du cancer du poumon[107] et a été récemment approuvé par la Food and Drug Administration comme traitement en seconde intention du carcinome avancé à petites cellules. Semblable au gefitinib, il semble avoir les meilleurs effets sur les femmes, les Asiatiques, les non-fumeurs et les patients souffrant de carcinome bronchioloalvéolaire[106].
L'inhibiteur d'angiogenèse, le bevacizumab, (en combinaison avec le paclitaxel et le carboplatine) améliore le taux de survie affectés de carcinome du poumon avancé à petites cellules[108]. Mais ceci augmente le risque de saignement du poumon, particulièrement chez les patients affectés de carcinome épidermoïde.
Les avancées dans l'étude des médicaments cytotoxiques[109], la pharmacogénétique[110] et la conception de médicaments ciblés[111] montrent des promesses. Un certain nombre de molécules ciblées en sont aux stades préliminaires de la recherche clinique, comme les inhibiteurs de COX-2[112], l' en:exisulind ⇔ exisulind, un promoteur de l'apoptose[113], les inhibiteurs de proteasome[114], le en:Bexarotene ⇔ bexarotène (Targretin)[115] et les vaccins[116]. D'autres domaines de recherche concernent l'inhibition du proto-oncogène Ha-ras, l'inhibition de la 3-kinase du phosphoinositide, l'inhibition de l'histone-déacétylase, et le remplacement d'un gène suppresseur de tumeurs[117].
Suivi des patients après traitement
Il n'existe pas de modalités standardisées de surveillance des patients ayant été traités pour un cancer bronchique. Compte tenu de la faible efficacité des traitements actuellement disponibles en cas de rechute, la question est de savoir s'il est intéressant de dépister précocément une rechute de la maladie, pour administrer à temps un traitement pouvant améliorer la survie des patients. Les modalités de surveillance comprennent l'examen clinique, la radiographie thoracique, le scanner thoracique, la fibroscopie bronchique. La pratique de ces examens et leur rythmicité est très variable en fonction des équipes médicales, mais aussi du type et du stade de la maladie traitée, et du traitement préalablement administré.
Pronostic
Les facteurs de pronostic dans les cancers du poumon non à petites cellules comprennent la présence ou l'absence de symptômes pulmonaires, la taille de la tumeur, le type histologique de cellule, le degré d'extension (stade), les métastases à plusieurs ganglions lymphatiques, et l'extension vasculaire. Pour les patients inopérables, le pronostic est détérioré par un mauvais état général et une perte de poids de plus de 10 %[118].
Les facteurs de pronostic pour le cancer du poumon à petites cellules comprennent l'état général de santé, le sexe, le stade de la maladie et l'implication du système nerveux central ou du foie au moment du diagnostic[119].
Pour le carcinome du poumon non à petites cellules, le pronostic est en général mauvais. Après une résection chirurgicale complète au stade IA, la survie à 5 ans est de 67 %. Au stade IB, elle descend à 57 %[120]. Le taux de survie à 5 ans de patients atteints de carcinome du poumon non à petites cellules au stade IV est environ de 1 %[5].
Le pronostic du carcinome du poumon à petites cellules est également en général mauvais. Le taux de survie général à 5 ans de ces patients est d'environ 5 %[3]. Les patients à un stade étendu ont un taux de survie moyen à 5 ans inférieur à 1 %. Le temps de survie médian pour un stade limité est de 20 mois, avec un taux de survie à 5 ans de 20 %[5].
Selon les données fournies par le National Cancer Institute, l'âge médian d'incidence du cancer du poumon est de 70 ans, et l'âge médian de décès par cancer du poumon est de 71 ans[121].
Épidémiologie
Dans le monde, le cancer du poumon est le cancer le plus fréquent en termes tant d'incidence que de mortalité (1,35 million de nouveaux cas par an et 1,18 million de décès), avec les taux les plus élevés en Europe et en Amérique du Nord[122].
Fréquence
Le réseau français des registres des cancers (Francim) et l’Institut national de la santé et de la recherche médicale (Inserm) estiment le nombre total de nouveaux cas de cancers en France, en 2000, à 280 000, dont 58 % survenant chez les hommes. Pour la même année, le nombre de décès par cancer est estimé à 150 000 dont 61 % chez l’homme. Le cancer du poumon vient en 4e position pour son incidence (28 000 nouveaux cas) après le cancer du sein (42 000), de la prostate (40 000), et du colon et rectum (36 000) et en première place pour sa mortalité.23 152 cancers du poumon ont été diagnostiqués chez l’homme en 2000 et 4 591 chez la femme. Compte tenu de l’efficacité modeste des traitements, le cancer du poumon est la première cause de mort par cancer avec environ 27 000 décès en 2000, dont 23 000 chez l’homme et 4 500 chez la femme[123]. Selon l'Assurance maladie, 14 237 nouveau cas en France métropolitaine en 2002.
Il fait partie des 9 cancers dont la fréquence a nettement augmenté de 1980 à 2005. Son incidence (23 937 nouveaux cas en 2005 en France) tend à augmenter chez l'homme jusqu'à la fin des années 1990, puis diminue sur la période 2000-2005, alors qu'elle augmente (de 4 % par an) chez les femmes sur la période la plus récente 2000-2005[124]. Le tabagisme est responsable dans plus de 90 % des cas. C'est de très loin le principal facteur de risque.
Cancer du poumon et tabagisme
Le segment de population développant un cancer du poumon le plus fréquemment est celui des plus de 50 ans ayant des antécédents de tabagisme. Le cancer du poumon est la forme de cancer arrivant en second rang en fréquence dans la plupart des pays occidentaux, et c'est la première cause de décès reliée au cancer.
Bien que le taux d'hommes mourant du cancer du poumon soit en baisse dans les pays occidentaux, il s'accroît chez les femmes, en raison de la montée du tabagisme dans ce groupe. L'évolution du lobby du tabac (Big Tobacco [n 2]) joue un rôle significatif dans la culture tabagique[125]. Les industriels du tabac ont concentré leurs efforts depuis les années 1970 vers le marché des femmes et jeunes filles, spécialement avec des cigarettes « light » ou « low-tar »[126].
À partir des années 1950, l'incidence de l'adénocarcinome du poumon a commencé à augmenter par rapport aux autres types de cancer[127]. Ceci est en partie dû à l'introduction des cigarettes à filtre. L'utilisation de filtres élimine les plus grosses particules de la fumée de tabac, réduisant ainsi les dépôts dans les plus grosses voies aériennes. Cependant le fumeur doit aspirer plus à fond pour recevoir la même quantité de nicotine, ce qui accroît le dépôt de particules dans les voies les plus fines, où c'est l'adénocarcinome qui a tendance à survenir[128].
Aux États-Unis, le nombre de femmes décédées d'un cancer du poumon dépasse depuis peu celui des décès par cancer du sein. En France, le tabagisme est responsable dans plus de 90 % des cas. C'est de très loin le principal facteur de risque.
L'Europe de l'Est a le plus grand taux de mortalité par cancer du poumon parmi les hommes, tandis que l'Europe du Nord et les États-Unis ont la plus haute mortalité parmi les femmes. L'incidence du cancer du poumon est actuellement moindre dans les pays en développement[129]. Comme le tabagisme croît dans les pays en développement, on s'attend à avoir une croissance de l'incidence dans les années à venir, notamment en Chine[130] et en Inde[131].
Autres facteurs
Tous les cas de cancer du poumon ne sont pas dus à la fumée de tabac, mais le rôle du tabagisme passif est de plus en plus reconnu comme un facteur de risque pour le cancer du poumon – ce qui conduit à des intervention de politique pour diminuer l'exposition indésirable des non-fumeurs à la fumée d'autrui. Les émissions des automobiles, des usines et des centrales électriques à charbon ou au fuel exposent aussi à des risques potentiels[13],[14],[132]. L'incidence de l'adénocarcinome aux États-Unis a diminué depuis 1999. Ceci peut être dû à une réduction de la pollution environnementale de l'air[127].
En France, les particules fines émises par les automobiles en ville seraient ainsi responsables de la mort de 6 500 à 9 500 personnes, dont plus de 1 000 par cancer du poumon ; l'amiante, elle, y est à l'origine de 2 000 à 3 000 cancers du poumon chaque année (ces chiffres pourraient augmenter dans l'avenir).
L'exposition au radon serait responsable, en France, de 13 % des décès par cancer du poumon, soit environ 3 350 chaque année, en Europe de 9 % des décès par cancer du poumon.
L'incidence du cancer du poumon (par pays) a une corrélation inverse avec l'exposition à la lumière du soleil et aux UVB. Une explication possible est un effet préventif de la vitamine D (qui est produite par la peau à l'exposition au soleil)[133].
Histoire
Le cancer du poumon n'était pas fréquent avant l'arrivée de la cigarette ; il n'a même pas été identifié comme une maladie distincte jusqu'à 1761[134]. Divers aspects du cancer du poumon ont été décrits plus à fond en 1810[135]. Les tumeurs malignes du poumon ne faisaient que 1% de tous les cancers vus à l'autopsie en 1878, mais étaient montés à 10–15% au début du XXe siècle[136]. Le nombre de cas cités dans la littérature médicale mondiale ne s'élevait qu'à 374 en 1912[137], référence citée dans[138], mais une revue des autopsies montre que l'incidence du cancer du poumon a augmenté de 0,3% en 1852 à 5,66% en 1952[139]. En Allemagne en 1929, le médecin Fritz Lickint reconnut le lien entre tabagisme et cancer du poumon[136], ce qui conduisit à une campagne anti-tabac agressive[140]. L'Étude des médecins britanniques, publiée dans les années 1950, était la première preuve épidémiologique solide du lien entre le cancer du poumon et le tabagisme[141]. Le résultat est en 1964 que le Surgeon General of the United States[n 3] recommande aux fumeurs de s'arrêter de fumer[142].
Le lien avec le radon a été reconnu pour la première fois chez les mineurs de l'Erzgebirge (Allemagne), près de Schneeberg, Saxe. L'argent a été exploité dans cette région depuis 1470, et ces mines sont riches en uranium, avec ses descendants, dont le radium et le radon. Les mineurs étaient atteints d'une quantité exceptionnelle de maladies du poumon, finalement reconnues comme cancers du poumon dans les années 1870. On estime à 75 % le nombre d'ex-mineurs morts du cancer du poumon[143]. Malgré cette découverte, l'activité minière a continué jusqu'aux années 1950, en raison de la demande de l'URSS en uranium[144].
La première pneumectomie réussie pour le cancer du poumon a été réalisée en 1933[145].
La radiothérapie palliative a été utilisée depuis les années 1940[146].
La radiothérapie radicale, utilisée dès les années 1950, a été une tentative pour utiliser de plusieurs doses de radiation chez les patients à un stade relativement précoce du cancer du poumon, mais inopérables[147].
En 1997, la radiothérapie continue hyperfractionnée accélérée a été considérée comme une amélioration de la radiothérapie radicale conventionnelle[96].
Pour les carcinomes à petites cellules, les premiers essais de résection chirurgicale des années 1960[148], et de radiothérapie radicale[149] n'ont pas eu de succès. Dans les années 1970, des combinaisons de chimiothérapie efficaces ont été mises au point[150].
Notes
Références
- ↑ (en) WHO, « Deaths by cause, sex and mortality stratum », 2004, World Health Organization. Consulté le 25 décembre 2008
- ↑ (en) WHO, « Cancer », 2006, World Health Organization. Consulté le 25 juin 2007
- ↑ a , b , c , d , e et f (en) J.D. Minna, J.H. Schiller, Harrison's Principles of Internal Medicine, McGraw-Hill , 17e éd., 2008, (ISBN 0-07-146633-9), p. 551–562.
- ↑ a , b , c , d , e et f (en) A.A. Vaporciyan, J.C. Nesbitt, J.S. Lee et al., Cancer Medicine, B C Decker, LieuPub , 2000, (ISBN 1-55009-113-1), p. 1227–1292.
- ↑ a , b et c (en) Lung Carcinoma : Tumors of the Lungs, Merck Manual Professional Edition, Online edition. Consulté le 15 août 2007
- ↑ (en) R.H. Carmona, « The Health Consequences of Involuntary Exposure to Tobacco Smoke: A Report of the Surgeon General », 27 juin 2006, U.S. Department of Health and Human Services
- ↑ (en) WHO, « Tobacco Smoke and Involuntary Smoking », dans IARC Monographs on the Evaluation of Carcinogenic Risks to Humans, WHO International Agency for Research on Cancer, vol. 83, 2002 [[pdf] texte intégral]
There is sufficient evidence that involuntary smoking (exposure to secondhand or 'environmental' tobaco smoke) causes lung cancer in humans. […] Involuntary smoking (exposure to secondhand or 'environmental' tobacco smoke) is carcinogenic to humans (Group 1).Il y a assez de preuves que l'exposition involontaire à la fumée de tabac provoque le cancer du poumon chez les humains. […] Le tabagisme involontaire (exposition à la fumée de tabac d'autrui) est cancérigène chez les humains (Groupe1).
- ↑ (en) M.J. Thun et L.M. Hannan, L.L. Adams-Campbell et al., « Lung Cancer Occurrence in Never-Smokers: An Analysis of 13 Cohorts and 22 Cancer Registry Studies », dans PLoS Medicine, vol. 5, no 9, 2008, p. 185
- ↑ (en) O.Y. Gorlova et S.F. Weng, Y. Zhang et al., « Aggregation of cancer among relatives of never-smoking lung cancer patients », dans International Journal of Cancer, vol. 121, no 1, juillet 2007, p. 111–118 [résumé lien DOI]
- ↑ (en) A.K. Hackshaw et M.R. Law, N.J. Wald, « The accumulated evidence on lung cancer and environmental tobacco smoke », dans British Medical Journal, vol. 315, no 7114, 18 octobre 1997, p. 980–988 [résumé, texte intégral]
- ↑ a et b (en) O. Catelinois et A. Rogel, D. Laurier, et al., « Lung cancer attributable to indoor radon exposure in France : impact of the risk models and uncertainty analysis », dans Environ. Health Perspect., vol. 114, no 9, septembre 2006, p. 1361–1366 [résumé, texte intégral lien DOI]
- ↑ a et b (en) K.M. O'Reilly et A.M. Mclaughlin, W.S. Beckett, P.J. Sime, « Asbestos-related lung disease », dans American Family Physician, vol. 75, no 5, mars 2007, p. 683–688 [résumé, texte intégral]
- ↑ a et b (en) Z. Kabir et K. Bennett, L. Clancy, « Lung cancer and urban air-pollution in Dublin : a temporal association ? », dans Irish Medical Journal, vol. 100, no 2, février 2007, p. 367–369 [résumé lien DOI]
- ↑ a et b (en) H.F. Chiu et M.H. Cheng, S.S. Tsai et al., « Outdoor air pollution and female lung cancer in Taiwan. », dans Inhalation Toxicology, vol. 18, no 13, décembre 2006, p. 1025–1031 [résumé]
- ↑ a , b et c (en) W.D. Travis et L.B. Travis, S.S. Devesa, « Lung cancer », dans Cancer, vol. 75, no Suppl. 1, janvier 1995, p. 191–202 [résumé lien DOI]
- ↑ (en) U. Morandi et C. Casali, G. Rossi, « Bronchial typical carcinoid tumors », dans Seminars in Thoracic and Cardiovascular Surgery, vol. 18, no 3, 2006, p. 191–198 [résumé lien DOI]
- ↑ (en) B. Etienne-Mastroianni et L. Falchero, L. Chalabreysse et al., « Primary sarcomas of the lung : a clinicopathologic study of 12 cases », dans Lung Cancer, vol. 38, no 3, décembre 2002, p. 283–289 [résumé lien DOI]
- ↑ (en) A. Bryant et R.J. Cerfolio, « Differences in epidemiology, histology, and survival between cigarette smokers and never-smokers who develop non-small cell lung cancer », dans Chest, vol. 132, no 1, juillet 2007, p. 1 [résumé, texte intégral lien DOI]
- ↑ (en) J. Subramanian et R. Govindan, « Lung cancer in never smokers : a review », dans Journal of Clinical Oncology, American Society of Clinical Oncology, vol. 25, no 5, février 2007, p. 561–570 [résumé lien DOI]
- ↑ a et b (en) D.J. Raz et B. He, R. Rosell, D.M. Jablons, « Bronchioloalveolar carcinoma: a review », dans Clinical Lung Cancer, Cancer Information Group, vol. 7, no 5, mars 2006, p. 313–322 [résumé lien DOI]
- ↑ a et b (en) L.G. Collins et C. Haines, R. Perkel, R.E. Enck, « Lung cancer : diagnosis and management », dans American Family Physician, American Academy of Family Physicians, vol. 75, no 1, janvier 2007, p. 56–63 [résumé, texte intégral]
- ↑ (en) G. Rosti et G. Bevilacqua, P. Bidoli et al., « Small cell lung cancer », dans Annals of Oncology, vol. 17, no Suppl. 2, mars 2006, p. 5–10 [résumé, texte intégral lien DOI]
- ↑ (en) F. Barbone et M. Bovenzi, F. Cavallieri, G. Stanta, « Cigarette smoking and histologic type of lung cancer in men », dans Chest, American College of Chest Physicians, vol. 112, no 6, décembre 1997, p. 1474–1479 [résumé, [pdf] texte intégral lien DOI]
- ↑ a et b (en) M.K. Dishop et S. Kuruvilla, « Primary and metastatic lung tumors in the pediatric population: a review and 25-year experience at a large children's hospital », dans Arch. Pathol. Lab. Med., vol. 132, no 7, juillet 2008, p. 1079–1103 [résumé, texte intégral]
- ↑ (en) J.B. Seo et J.G. Im, J.M. Goo et al., « Atypical pulmonary metastases: spectrum of radiologic findings », dans Radiographics, vol. 21, no 2, 1er mars 2001, p. 403–417 [résumé, texte intégral]
- ↑ (en) C.F. Mountain, H.I. Libshitz, K.E. Hermes, A Handbook for Staging, Imaging, and Lymph Node Classification, Charles P. Young, 2003, [lire en ligne (page consultée le 1er septembre 2007)].
- ↑ (en) H.K. Biesalski et B. Bueno de Mesquita, A. Chesson et al., « European Consensus Statement on Lung Cancer : risk factors and prevention. Lung Cancer Panel », dans CA Cancer J. Clin., vol. 48, no 3, 1998, p. 164–176 [résumé, texte intégral lien DOI]
Fumer est le facteur de risque majeur, qui rend compte d'environ 90% du taux d'incidence du cancer du poumon
- ↑ (en)R. Peto, A.D. Lopez, J. Boreham et al., Mortality from smoking in developed countries 1950–2000 : Indirect estimates from National Vital Statistics, Oxford University Press, 2006, (ISBN 0-19-262535-7), [lire en ligne].
- ↑ (en) J.M. Samet et C.L. Wiggins, C.G. Humble, D.R. Pathak, « Cigarette smoking and lung cancer in New Mexico », dans American Review of Respiratory Disease, vol. 137, no 5, mai 1988, p. 1110–1113 [résumé]
- ↑ (en) P.J. Villeneuve et Y. Mao, « Lifetime probability of developing lung cancer, by smoking status, Canada », dans Canadian Journal of Public Health, vol. 85, no 6, novembre 1994, p. 385–388 [résumé]
- ↑ (en) S. Hecht, « Tobacco carcinogens, their biomarkers and tobacco-induced cancer », dans Nature Reviews. Cancer, Nature Publishing Group, vol. 3, no 10, octobre 2003, p. 733–744 [résumé, texte intégral lien DOI]
- ↑ (en) M. Sopori, « Effects of cigarette smoke on the immune system », dans Nature Reviews. Immunology, vol. 2, no 5, mai 2002, p. 372–377 [résumé lien DOI]
- ↑ (en) US Department of Health and Human Services, « The Health Benefits of Smoking Cessation: a Report of the en:Surgeon General », 1990, Centers for Disease Control (CDC), Office on Smoking and Health.. Consulté le 18 novembre 2007
- ↑ (en) L.T. Nordquist et G.R. Simon , A. Cantor et al., « Improved survival in never-smokers vs current smokers with primary adenocarcinoma of the lung », dans Chest, American College of Chest Physicians, vol. 126, no 2, août 2004, p. 347–351 [résumé, texte intégral lien DOI]
- ↑ (en) C.M. Tammemagi et C. Neslund-Dudas , M. Simoff , P. Kvale, « Smoking and lung cancer survival: the role of comorbidity and treatment », dans Chest, American College of Chest Physicians, vol. 125, no 1, janvier 2004, p. 27–37 [résumé, texte intégral lien DOI]
- ↑ (en) CDC, « 1986s Surgeon General's report: the health consequences of involuntary smoking », 1986, Centers for Disease Control and Prevention. Consulté le 10 août 2007
(en) National Research Council, Environmental tobacco smoke: measuring exposures and assessing health effects, National Academy Press, 1986 (ISBN 0-309-07456-8)
(en) EPA, « Respiratory health effects of passive smoking: lung cancer and other disorders », 1992, EPA. Consulté le 10 août 2007
(en) California Environmental Protection Agency, « Health effects of exposure to environmental tobacco smoke », dans Tobacco Control, vol. 6, no 4, 1997, p. 346–353 [résumé, texte intégral lien DOI]
(en) CDC, « State-specific prevalence of current cigarette smoking among adults, and policies and attitudes about secondhand smoke—United States, 2000 », dans Morbidity and Mortality Weekly Report, CDC, Atlanta, Georgia, vol. 50, no 49, décembre 2001, p. 1101–1106 [résumé, texte intégral]
(en) A.J. Alberg et J.M. Samet, « Epidemiology of lung cancer », dans Chest, American College of Chest Physicians, vol. 123, no S1, janvier 2003, p. 21S–49S [résumé, texte intégral lien DOI] - ↑ (en) P. Boffetta et A. Agudo, W. Ahrens et al., « Multicenter case-control study of exposure to environmental tobacco smoke and lung cancer in Europe », dans Journal of the National Cancer Institute, Oxford University Press, vol. 90, no 19, octobre 1998, p. 1440–1450 [résumé, texte intégral lien DOI]
- ↑ (en) Department of Health, « Report of the Scientific Committee on Tobacco and Health », 1998, Department of Health. Consulté le 9 juillet 2007
(en) A.K. Hackshaw, « Lung cancer and passive smoking », dans Statistical Methods in Medical Research, vol. 7, no 2, juin 1998, p. 119–136 [résumé lien DOI] - ↑ (en) National Health and Medical Research Council, « The health effects and regulation of passive smoking », 1994, Australian Government Publishing Service. Consulté le 10 août 2007
- ↑ Cancer du poumon, l'éviter, Comité contre les maladies respiratoires. Consulté le 9 juillet 2009
- ↑ (en) S. Schick et S. Glantz, « Philip Morris toxicological experiments with fresh sidestream smoke : more toxic than mainstream smoke », dans Tobacco Control, vol. 14, no 6, décembre 2005, p. 396–404 [résumé lien DOI]
- ↑ (en) EPA, « Radiation information : radon », octobre 2006, EPA. Consulté le 11 août 2007
- ↑ (en) R.W. Field et D.J. Steck, B.J. Smith et al., « Residential radon gas exposure and lung cancer : the Iowa Radon Lung Cancer Study », dans American Journal of Epidemiology, Oxford Journals, vol. 151, no 11, 1er juin 2000, p. 1091–1102 [résumé, texte intégral]
- ↑ (en) EPA, « Iowa Radon Lung Cancer Study », juin 2000, EPA. Consulté le 11 août 2007
- ↑ –, « Les risques liés à l'exposition domestique au radon », dans Prescrire, vol. 281, mars 2007
- ↑ Expertise collective, « Cancer, approche méthodologique du lien avec l'environnement », 2005, INSERM. Consulté le 4 octobre 2008
- ↑ (en) A.J. Darnton et D.M. McElvenny, J.T. Hodgson, « Estimating the number of asbestos-related lung cancer deaths in Great Britain from 1980 to 2000 », dans Annals of Occupational Hygiene, vol. 50, no 1, janvier 2006, p. 29–38 [résumé, texte intégral lien DOI]
- ↑ (en) C. Leroux et N. Girard, V. Cottin et al., « Jaagsiekte Sheep Retrovirus (JSRV) : from virus to lung cancer in sheep », dans Veterinary Research, vol. 38, no 2, mars-avril 2007, p. 211–228 [résumé lien DOI]
- ↑ (en) M. Palmarini et H. Fan, « Retrovirus-induced ovine pulmonary adenocarcinoma, an animal model for lung cancer », dans Journal of the National Cancer Institute, Oxford University Press, vol. 93, no 21, novembre 2001, p. 1603–1614 [résumé, texte intégral lien DOI]
- ↑ (en) Y.W. Cheng et H.L. Chiou, G.T. Sheu et al., « The association of human papillomavirus 16/18 infection with lung cancer among nonsmoking Taiwanese women », dans Cancer Research, American Association for Cancer Research, vol. 61, no 7, 1er avril 2001, p. 2799–2803 [résumé, texte intégral]
- ↑ (en) H. Zheng et H.A. Aziz, Y. Nakanishi et al., « Oncogenic role of JC virus in lung cancer », dans Journal of Pathology, vol. 212, no 3, mai 2007, p. 306–315 [résumé lien DOI]
- ↑ (en) L. Giuliani et T. Jaxmar, C. Casadio et al., « Detection of oncogenic viruses (SV40, BKV, JCV, HCMV, HPV) and p53 codon 72 polymorphism in lung carcinoma », dans Lung Cancer, vol. 57, no 3, septembre 2007, p. 273–281 [résumé lien DOI]
- ↑ (en) K.M. Fong et Y. Sekido, A.F. Gazdar, J.D. Minna, « Lung cancer. 9 : Molecular biology of lung cancer : clinical implications », dans Thorax, BMJ Publishing Group Ltd., vol. 58, no 10, octobre 2003, p. 892–900 [résumé lien DOI]
- ↑ (en) R. Salgia et A.T. Skarin, « Molecular abnormalities in lung cancer », dans Journal of Clinical Oncology, vol. 16, no 3, mars 1998, p. 1207–1217 [résumé]
- ↑ a , b , c et d (en) R.S. Herbst et J.V. Heymach, S.M. Lippman, « Molecular origins of cancer : lung cancer », dans N. Engl. J. Med., vol. 359, no 13, septembre 2008, p. 1367–1380 [résumé, texte intégral lien DOI]
- ↑ (en) S. Aviel-Ronen et F.H. Blackhall, F.A. Shepherd, M.S. Tsao, « K-ras mutations in non-small-cell lung carcinoma : a review », dans Clinical Lung Cancer, Cancer Information Group, vol. 8, no 1, juillet 2006, p. 30–38 [résumé lien DOI]
- ↑ (en) T.R. Devereux et J.A. Taylor, J.C. Barrett, « Molecular mechanisms of lung cancer. Interaction of environmental and genetic factors », dans Chest, American College of Chest Physicians, vol. 109, no Suppl 3, mars 1996, p. 14S–19S [résumé, texte intégral (pages consultées le 16 septembre 2009)]
- ↑ (en) D.W. Bell et I. Gore, R.A. Okimoto et al., « Inherited susceptibility to lung cancer may be associated with the T790M drug resistance mutation in EGFR », dans Nat. Genet., vol. 37, 2005, p. 1315-1316 [texte intégral]
- ↑ (en) C.I. Amos et X. Wu, P. Broderick et al., « Genome-wide association scan of tag SNPs identifies a susceptibility locus for lung cancer at 15q25.1 », dans Nat. Genet., vol. 40, 2008, p. 616-622 [texte intégral]
- ↑ (en) R.J. Hung et J.D. McKay, V. Gaborieau et al., « A susceptibility locus for lung cancer maps to nicotinic acetylcholine receptor subunit genes on 15q25 », dans Nature, vol. 452, 2008, p. 633-637 [texte intégral]
- ↑ (en) D. Yu et X. Zhang, J. Liu, et al., « Characterization of functional excision repair cross-complementation group 1 variants and their association with lung cancer risk and prognosis », dans Clin. Cancer Res., vol. 14, 2008, p. 2878-2886 [texte intégral]
- ↑ (en) E.A. Engels et X. Wu, J. Gu et al., « Systematic evaluation of genetic variants in the inflammation pathway and risk of lung cancer », dans Cancer Research, American Association for Cancer Research, vol. 67, no 13, juillet 2007, p. 6520–6527 [résumé lien DOI]
- ↑ (en) A.S. Wenzlaff et M.L. Cote, C.H. Bock et al., « CYP1A1 and CYP1B1 polymorphisms and risk of lung cancer among never smokers : a population-based study », dans Carcinogenesis, Oxford University Press, vol. 26, no 12, décembre 2005, p. 2207–2212 [résumé lien DOI]
- ↑ (en) J.W. Son et H.K. Kang, M.H. Chae et al., « Polymorphisms in the caspase-8 gene and the risk of lung cancer », dans Cancer Genetics and Cytogenetics, vol. 169, no 2, septembre 2006, p. 121–127 [résumé lien DOI]
- ↑ (en) J. Yin et U. Vogel, Y. Ma et al., « The DNA repair gene XRCC1 and genetic susceptibility of lung cancer in a northeastern Chinese population », dans Lung Cancer, vol. 56, no 2, mai 2007, p. 153–160 [résumé lien DOI]
- ↑ (en) K. Tomoda et T. Ohkoshi, K. Hirota, et al., « Preparation and properties of inhalable nanocomposite particles for treatment of lung cancer », dans Colloids Surf. B : Biointerfaces, vol. 71, février 2009, p. 177 [résumé, texte intégral lien DOI]
- ↑ (en) P. Vineis et G. Hoek, M. Krzyzanowski et al., « Lung cancers attributable to environmental tobacco smoke and air pollution in non-smokers in different European countries : a prospective study », dans Environmental Health, BioMed Central, vol. 6, février 2007, p. 7 [résumé lien DOI]
- ↑ a et b (en) [url=http://www.tobaccofreekids.org/reports/settlements/2009/fullreport.pdf A Decade of Broken Promises: The 1998 State Tobacco Settlement Ten Years Later], Campaign for Tobacco-Free Kids. Consulté le 3 décembre 2008
- ↑ (en) G. Pandey, « Bhutan's smokers face public ban », février 2005, BBC. Consulté le 7 septembre 2007
- ↑ (en) N. Gray, « A global approach to tobacco policy », dans Lung Cancer, BioMed Central, vol. 39, no 2, février 2003, p. 113–117 [résumé lien DOI]
- ↑ (en) C.G. Slatore et A.J. Littman, D.H. Au, J.A. Satia, E. White, « Long-term use of supplemental multivitamins, vitamin C, vitamin E, and folate does not reduce the risk of lung cancer », dans American Journal of Respiratory and Critical Care Medicine, vol. 177, no 5, 2008, p. 524–530 [résumé lien DOI]
- ↑ (en) Organisation des Nations Unies, service de presse, « UN health agency calls for total ban on tobacco advertising to protect young », 30 mai 2008
- ↑ (en) J.K. Gohagan et P.M. Marcus, R.M. Fagerstrom et al., « Final results of the Lung Screening Study, a randomized feasibility study of spiral CT versus chest X-ray screening for lung cancer », dans Lung Cancer, vol. 47, no 1, janvier 2005, p. 9–15 [résumé lien DOI]
- ↑ (en) W. Hamilton et T.J. Peters, A. Round, D. Sharp, « What are the clinical features of lung cancer before the diagnosis is made? A population based case-control study », dans Thorax, BMJ Publishing Group, vol. 60, no 12, décembre 2005, p. 1059–1065 [résumé lien DOI]
- ↑ (en) J Honnorat et J.C. Antoine, « Paraneoplastic neurological syndromes », dans Orphanet Journal of Rare Diseases, BioMed Central, vol. 2, mai 2007, p. 22 [résumé, texte intégral lien DOI]
- ↑ (en) D.R. Jones et F.C. Detterbeck, « Pancoast tumors of the lung », dans Current Opinion in Pulmonary Medicine, vol. 4, no 4, juillet 1998, p. 191–197 [résumé lien DOI]
- ↑ (en) Frederick L. Greene, AJCC cancer staging manual, Springer-Verlag, LieuPub, 2002, (ISBN 0-387-95271-3).
- ↑ (en) Y.G. Fan et P. Hu, Y. Jiang, et al., « Association between sputum atypia and lung cancer risk in an occupational cohort in Yunnan, China », dans Chest, vol. 135, no 3, mars 2009, p. 778–785 [résumé lien DOI]
- ↑ (en) J.H. Schiller, R.M. Vidaver, S. Novello, J. Brahmer, L. Monroe, « Living with a Diagnosis of Lung Cancer », 2007, National Lung Cancer Partnership. Consulté le 1er décembre 2008
- ↑ (en) T.E. Strand et H. Rostad, R.A. Damhuis, J. Norstein, « Risk factors for 30-day mortality after resection of lung cancer and prediction of their magnitude », dans Thorax, BMJ Publishing Group, vol. 62, juin 2007, p. 991 [résumé lien DOI]
- ↑ (en) A. El-Sherif et W.E. Gooding, R. Santos et al., « Outcomes of sublobar resection versus lobectomy for stage I non-small cell lung cancer : a 13-year analysis », dans Annals of Thoracic Surgery, vol. 82, no 2, août 2006, p. 408–415 [résumé lien DOI]
- ↑ (en) H.C. Fernando et R.S. Santos, J.R. Benfield et al., « Lobar and sublobar resection with and without brachytherapy for small stage IA non-small cell lung cancer », dans Journal of Thoracic and Cardiovascular Surgery, vol. 129, no 2, février 2005, p. 261–267 [résumé lien DOI]
- ↑ (en) G. Casali et W.S. Walker, « Video-assisted thoracic surgery lobectomy : can we afford it ? », dans Eur. J. Cardiothorac. Surg., vol. 35, no 3, mars 2009, p. 423–428 [résumé lien DOI]
- ↑ (en) A. Clegg et D.A. Scott, P. Hewitson et al., « Clinical and cost effectiveness of paclitaxel, docetaxel, gemcitabine, and vinorelbine in non-small cell lung cancer : a systematic review », dans Thorax, BMJ Publishing Group, vol. 57, no 1, janvier 2002, p. 20–28 [résumé lien DOI]
- ↑ (en) N. Murray et A.T. Turrisi, « A review of first-line treatment for small-cell lung cancer », dans Journal of Thoracic Oncology, vol. 1, no 3, mars 2006, p. 270–278 [résumé]
- ↑ (en) H.A. Azim et A.K. Ganti, « Treatment options for relapsed small-cell lung cancer », dans Anticancer drugs, vol. 18, no 3, mars 2007, p. 255–261 [résumé lien DOI]
- ↑ (en) C. MacCallum et H.H. Gillenwater, « Second-line treatment of small-cell lung cancer », dans Current Oncology Reports, vol. 8, no 4, juillet 2006, p. 258–264 [résumé lien DOI]
- ↑ (en) A.M. Araujo et J.C. Mendez, A.L. Coelho, et al., « Phase II Study of Celecoxib with Cisplatin Plus Etoposide in Extensive-Stage Small Cell Lung Cancer », dans Cancer Invest., vol. 27, mars 2009, p. 1 [résumé, texte intégral lien DOI]
- ↑ (en) T. Winton et R. Livingston, D. Johnson, et al., « Vinorelbine plus cisplatin vs. observation in resected non-small-cell lung cancer », dans New England Journal of Medicine, Massachusetts Medical Society, vol. 352, no 25, juin 2005, p. 2589–2597 [résumé lien DOI] :
« « Le cisplatine ou le carboplatine en thérapie adjuvante ont un niveau de toxicité acceptable, et prolongent la survie sans symptômes et en général parmi les patients dont le cancer du poumon non à petites cellules a été complètement réséqué. » »
- ↑ (en) J.Y. Douillard et R. Rosell, M. De Lena et al., « Adjuvant vinorelbine plus cisplatin versus observation in patients with completely resected stage IB-IIIA non-small-cell lung cancer (Adjuvant Navelbine International Trialist Association [ANITA]) : a randomised controlled trial », dans Lancet Oncology, Elsevier, vol. 7, no 9, septembre 2006, p. 719–727 [résumé lien DOI]
- ↑ (en) M. Tsuboi et T. Ohira, H. Saji et al., « The present status of postoperative adjuvant chemotherapy for completely resected non-small cell lung cancer », dans Annals of Thoracic and Cardiovascular Surgery, vol. 13, no 2, avril 2007, p. 73–77 [résumé, [pdf] texte intégral]
- ↑ (en) L. Horn et A.B. Sandler, J.B. Putnam Jr, D.H. Johnson, « The rationale for adjuvant chemotherapy in stage I non-small cell lung cancer », dans Journal of Thoracic Oncology, vol. 2, no 5, mai 2007, p. 377–383 [résumé lien DOI]
- ↑ (en) H.A. Wakelee et J.H. Schiller, D.R. Gandara, « Current status of adjuvant chemotherapy for stage IB non-small-cell lung cancer: implications for the New Intergroup Trial », dans Clinical Lung Cancer, Cancer Information Group, vol. 8, no 1, juillet 2006, p. 18–21 [résumé lien DOI]
- ↑ (en) BMJ, Clinical evidence concise : the international resource of the best available evidence for effective health care., vol. 14, BMJ Publishing Group, Londres, décembre 2005 (ISBN 1-905545-00-2) (ISSN 1475-9225), p. p. 486–488
- ↑ (en) R. Arriagada et P. Goldstraw, T. Le Chevalier, Oxford Textbook of Oncology, Oxford University Press, 2002, 2e éd. (ISBN 0-19-262926-3), p. p. 2094
- ↑ a et b (en) M. Saunders et S. Dische, A. Barrett et al., « Continuous hyperfractionated accelerated radiotherapy (CHART) versus conventional radiotherapy in non-small-cell lung cancer: a randomised multicentre trial », dans Lancet, Elsevier, vol. 350, no 9072, juillet 1997, p. 161–165 [résumé lien DOI]
- ↑ (en) H. Wagner, « Radiation therapy in the management of limited small cell lung cancer : when, where, and how much ? », dans Chest, American College of Chest Physicians, vol. 113, no Suppl. 1, janvier 1998, p. 92S–100S [résumé, texte intégral lien DOI (pages consultées le 16 septembre 2009)]
- ↑ (en) PORT Meta-analysis Trialists Group, « Postoperative radiotherapy for non-small cell lung cancer », dans Cochrane database of systematic reviews (Online), no 2, 2005, p. CD002142 [résumé, texte intégral lien DOI (pages consultées le 5 juillet 2009)]
- ↑ (en) B.E. Lally et D. Zelterman, J.M. Colasanto et al., « Postoperative Radiotherapy for Stage II or III Non–Small-Cell Lung Cancer Using the Surveillance, Epidemiology, and End Results Database », dans Journal of Clinical Oncology, John Wiley & Sons, vol. 24, no 19, juillet 2006, p. 2998–3006 [résumé, texte intégral lien DOI (pages consultées le 16 septembre 2009)]
- ↑ (en) A. Raben et B. Mychalczak, « Brachytherapy for non-small cell lung cancer and selected neoplasms of the chest », dans Chest, American College of Chest Physicians, vol. 112, no Suppl. 4, octobre 1997, p. 276S–286S [résumé, texte intégral lien DOI (pages consultées le 16 septembre 2009)]
- ↑ (en) B. Celebioglu et O.U. Gurkan, S. Erdogan et al., « High dose rate endobronchial brachytherapy effectively palliates symptoms due to inoperable lung cancer », dans Japanese Journal of Clinical Oncology, Oxford University Press, vol. 32, no 11, novembre 2002, p. 443–448 [résumé, texte intégral lien DOI]
- ↑ (en) M. Ng et J. Chong, A. Milner et al., « Tolerability of accelerated chest irradiation and impact on survival of prophylactic cranial irradiation in patients with limited-stage small cell lung cancer: review of a single institution's experience », dans Journal of Thoracic Oncology, International Association for the Study of Lung Cancer, vol. 2, no 6, juin 2007, p. 506–513 [résumé lien DOI]
- ↑ (en) B. Slotman et C. Faivre-Finn, G. Kramer et al., « Prophylactic cranial irradiation in extensive small-cell lung cancer », dans New England Journal of Medicine, vol. 357, no 7, août 2007, p. 664–672 [résumé, texte intégral lien DOI]
- ↑ (en) H. Hof et M. Muenter, D. Oetzel et al., « Stereotactic single-dose radiotherapy (radiosurgery) of early stage nonsmall-cell lung cancer (NSCLC) », dans Cancer, Wiley InterScience, vol. 110, no 1, juillet 2007, p. 148–155 [résumé, texte intégral lien DOI]
- ↑ (en) C.J. Simon et D.E. Dupuy, T.A. DiPetrillo et al., « Pulmonary radiofrequency ablation: long-term safety and efficacy in 153 patients », dans Radiology, vol. 243, no 1, avril 2007, p. 268–275 [résumé lien DOI]
- ↑ a et b (en) K. Bencardino et M. Manzoni, S. Delfanti et al., « Epidermal growth factor receptor tyrosine kinase inhibitors for the treatment of non-small-cell lung cancer : results and open issues », dans Internal and Emergency Medicine, vol. 2, no 1, mars 2007, p. 3–12 [résumé lien DOI]
- ↑ (en) R. Feld et S.S. Sridhar, F.A. Shepherd et al., « Use of the epidermal growth factor receptor inhibitors gefitinib and erlotinib in the treatment of non-small cell lung cancer: a systematic review », dans Journal of Thoracic Oncology, International Association for the Study of Lung Cancer, vol. 1, no 4, mai 2006, p. 367–376 [résumé lien DOI]
- ↑ (en) A. Sandler et R. Gray, M. Perry et al., « Paclitaxel–carboplatin alone or with bevacizumab for non–small cell lung cancer », dans New England Journal of Medicine, Massachusetts Medical Society, vol. 355, no 24, décembre 2006, p. 2542–2550 [résumé lien DOI]
- ↑ (en) M.J. Edelman, « Novel cytotoxic agents for non-small cell lung cancer », dans ournal of Thoracic Oncology, vol. 1, no 7, septembre 2006, p. 752–755 [résumé]
- ↑ (en) R. Danesi et G. Pasqualetti, E. Giovannetti, M. Del Tacca, « The role of pharmacogenetics in adjuvant treatment of non-small cell lung cancer », dans Journal of Thoracic Oncology, vol. 2, no 5 Suppl., mai 2007, p. S27–S30 [résumé lien DOI]
- ↑ (en) F.H. Blackhall et F.A. Shepherd, « Small cell lung cancer and targeted therapies », dans Current Opinion in Oncology, vol. 19, no 2, mars 2007, p. 103–108 [résumé lien DOI]
- ↑ (en) J.M. Lee et J.T. Mao, K. Krysan, S.M. Dubinett, « Significance of cyclooxygenase-2 in prognosis, targeted therapy and chemoprevention of NSCLC », dans Future Oncology, vol. 2, no 2, avril 2007, p. 149–153 [résumé lien DOI]
- ↑ (en) C.M. Whitehead et K.A. Earle, J. Fetter et al., « Exisulind-induced Apoptosis in a Non-Small Cell Lung Cancer Orthotopic Lung Tumor Model Augments Docetaxel Treatment and Contributes to Increased Survival », dans Molecular Cancer Therapeutics, American Association for Cancer Research, vol. 2, no 5, 1er mai 2003, p. 479–488 [résumé, texte intégral]
- ↑ (en) G. Scagliotti, « Proteasome inhibitors in lung cancer », dans Critical Reviews in Oncology/Haematology, vol. 58, no 3, juin 2006, p. 177–189 [résumé lien DOI]
- ↑ (en) K.H. Dragnev et W.J. Petty, S.J. Shah et al., « A proof-of-principle clinical trial of bexarotene in patients with non-small cell lung cancer », dans Clinical Cancer Research, American Association for Cancer Research, vol. 13, no 6, mars 2007, p. 1794–1800 [résumé lien DOI]
- ↑ (en) S. Sun et J.H. Schiller, M. Spinola, J.D. Minna, « New molecularly targeted therapies for lung cancer », dans Journal of Clinical Investigation, American Society for Clinical Investigation, vol. 117, no 10, octobre 2007, p. 2740–2750 [résumé, texte intégral lien DOI]
- ↑ (en) S. Sun et J.H. Schiller, M. Spinola, J.D. Minna, « New molecularly targeted therapies for lung cancer », dans Journal of Clinical Investigation, American Society for Clinical Investigation, vol. 117, no 10, octobre 2007, p. 2740–2750 [résumé, texte intégral lien DOI]
- ↑ (en) PDQ for Health Professionals, « Non-Small Cell Lung Cancer Treatment », National Cancer Institute. Consulté le 22 novembre 2008
- ↑ (en) PDQ for Health Professionals, « Small Cell Lung Cancer Treatment », National Cancer Institute. Consulté le 22 novembre 2008
- ↑ (en) C.F. Mountain, « Revisions in the international system for staging lung cancer », dans Chest, American College of Chest Physicians, vol. 111, no 6, 1997, p. 1710–1717 [résumé, [pdf] texte intégral lien DOI]
- ↑ (en) Surveillance Epidemiology and End Results (SEER), « Cancer Statistics Review 1975-2002 - Search ». Consulté le 18 novembre 2007
- ↑ (en) Commonly diagnosed cancers worldwide, avril 2005, Cancer Research UK. Consulté le 11 janvier 2008
- ↑ Inserm, année 2000
- ↑ Belor A, Grosclaude P, Bossard N, Jougla E, Benhamou E, et coll. Cancer incidence and mortality in France over the period 1980-2005. Revue d'Épidémiologie et de Santé Publique 2008, 56 :159-175
- ↑ (en) K.L. Lum et J.R. Polansky, R.K. Jackler, S.A. Glantz, « Signed, sealed and delivered: « big tobacco » in Hollywood, 1927-1951 », dans Tobacco Control, vol. 17, no 5, octobre 2008, p. 313–323 [résumé, texte intégral lien DOI]
- ↑ (en) [http://www.tobaccofreekids.org/reports/women/ Rapport de l'organisation « Tobacco-free kids »]
- ↑ a et b (en) F. Chen et W.F. Bina, P. Cole, « Declining incidence rate of lung adenocarcinoma in the United States », dans Chest, vol. 131, no 4, avril 2007, p. 1000–1005 [résumé, texte intégral lien DOI]
- ↑ (en) A. Charloux et E. Quoix, N. Wolkove et al., « The increasing incidence of lung adenocarcinoma: reality or artefact ? A review of the epidemiology of lung adenocarcinoma », dans International Journal of Epidemiology, février, vol. 26, no 1, 1997, p. 14–23 [résumé, texte intégral lien DOI]
- ↑ (en) World Health Organization, « Gender in lung cancer and smoking research », 2004. Consulté le 26 mai 2007
- ↑ (en) B.Q. Liu et R. Peto, Z.M. Chen et al., « Emerging tobacco hazards in China : 1. Retrospective proportional mortality study of one million deaths », dans British Medical Journal, vol. 317, no 7170, 21 novembre 1998, p. 1411–1422 [résumé, texte intégral]
- ↑ (en) D. Behera et T. Balamugesh, « Lung cancer in India », dans Indian Journal of Chest Diseases and Allied Sciences, vol. 46, no 4, 2004, p. 269–281 [résumé, [pdf] texte intégral]
- ↑ (en) M.E. Parent et M.C. Rousseau, P. Boffetta et al., « Exposure to diesel and gasoline engine emissions and the risk of lung cancer », dans American Journal of Epidemiology, vol. 165, no 1, janvier 2007, p. 53–62 [résumé lien DOI]
- ↑ (en) S.B. Mohr et C.F. Garland, E.D. Gorham et al., « Could ultraviolet B irradiance and vitamin D be associated with lower incidence rates of lung cancer ? », dans Journal of Epidemiology and Community Health, vol. 62, no 1, 2008, p. 69–74 [résumé lien DOI]
- ↑ (en) Giovanni Battista Morgagni, De sedibus et causis morborum per anatomen indagatis, 1761
- ↑ Gaspard-Laurent Bayle, Recherches sur la phtisie pulmonaire, Paris, 1810
- ↑ a et b (en) H. Witschi, « A short history of lung cancer », dans Toxicological Sciences, vol. 64, no 1, novembre 2001, p. 4–6 [résumé, texte intégral lien DOI]
- ↑ (en) I. Adler, Primary Malignant Growths of the Lungs and Bronchi, Longmans, Green, and Company, New York, 1912.
OCLC id =14783544
- ↑ (en) S.G. Spiro et G.A. Silvestri, « One hundred years of lung cancer », dans American Journal of Respiratory and Critical Care Medicine, vol. 172, no 5, 2005, p. 523–529 [résumé lien DOI]
- ↑ (en) F.W. Grannis, « History of cigarette smoking and lung cancer », smokinglungs.com. Consulté le 6 août 2007
- ↑ (en) R Proctor, The Nazi War on Cancer, Princeton University Press, 2000 (ISBN 0-691-00196-0), p. p. 173–246
- ↑ (en) R. Doll et A.B. Hill, « Lung cancer and other causes of death in relation to smoking ; a second report on the mortality of British doctors », dans British Medical Journal, vol. 2, no 5001, novembre 1956, p. 1071–1081 [lien DOI]
PubMed id =13364389
- ↑ (en) US Department of Health Education and Welfare, « Smoking and health : report of the advisory committee to the Surgeon General of the Public Health Service », 1964, US Government Printing Office, Washington, DC
- ↑ (en) M. Pirozynski, « 100 years of Lung Cancer », dans Respiratory Medicine, vol. 100, no 12, décembre 2006, p. 2073–2084 [résumé lien DOI]
- ↑ (en) M. Greaves, Cancer : the Evolutionary Legacy, Oxford University Press, 2000 (ISBN 0-19-262835-6), p. p. 196–197
- ↑ (en) L. Horn et D.H. Johnson, « Evarts A. Graham and the first pneumonectomy for lung cancer », dans Journal of Clinical Oncology, vol. 26, no 19, juillet 2008, p. 3268–3275 [résumé, texte intégral lien DOI]
- ↑ (en) A.T. Edwards, « Carcinoma of the bronchus », dans Thorax, vol. 1, no 1, 1946, p. 1–25 [lien DOI]
- ↑ (de) M. Kabela, « Expérience avec l'irradiation radicale du cancer des bronches », dans Ceskoslovenská Onkológia, vol. 3, no 2, 1956, p. 109–115 [résumé]
- ↑ (en) S.C. Lennox et G. Flavell, D.J. Pollock et al., « Results of resection for oat-cell carcinoma of the lung », dans Lancet, Elsevier, vol. 2, novembre 1968, p. 925–927 [résumé lien DOI]
- ↑ (en) A.B. Miller et W. Fox, R. Tall, « Five-year follow-up of the Medical Research Council comparative trial of surgery and radiotherapy for the primary treatment of small-celled or oat-celled carcinoma of the bronchus », dans Lancet, Elsevier, vol. 2, no 7619, septembre 1969, p. 501–505 [résumé lien DOI]
- ↑ (en) M. Cohen et P.J. Creaven, B.E. Fossieck Jr et al., « Intensive chemotherapy of small cell bronchogenic carcinoma », dans Cancer Treatment Reports, vol. 61, no 3, 1977, p. 349–354 [résumé]
Sources
- (en) Cet article est partiellement ou en totalité issu d’une traduction de l’article de Wikipédia en anglais intitulé « Lung cancer ».
Articles connexes
- Poumon, voies aérodigestives supérieures, système respiratoire
- Oncologie, cancer, cancérogène
- Chimiothérapie
- Tomographie
- Mésothéliome
- Tabagisme
Liens externes
- Intergroupe Francophone de Cancérologie Thoracique (IFCT): Essais cliniques
- (en) Chest Radiology « Leçons sur le cancer du poumon »
- (en) National Cancer Institute
- (en) Tobacco Smoke and Involuntary Smoking, Summary of Data Reported and Evaluation 2004 par l'IARC
- (en) Lung Cancer Articles & Information Articles sur l'arrêt du tabac et informations du National Institutes of Health
- (en) Interactive Health Tutorials Medline Plus : Lung Cancer Animations et leçons audiovisuelles.
- Portail de la médecine
Catégories : Pneumologie | Maladie tumorale en pneumologie | Maladie de l'appareil respiratoire | Radiobiologie | Traitement médical en cancérologie | Diagnostic du cancer | Radio-Oncologie
Wikimedia Foundation. 2010.