- Catechine
-
Catéchine
Catéchine 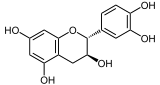
(+)-Catéchine Général Nom IUPAC ()-2-(3,4-dihydroxyphenyl)chromane-3,5,7-triol Synonymes catéchol, cianidanol No CAS No EINECS SMILES Propriétés chimiques Formule brute C15H14O6 [Isomères] Masse molaire 290,2681 g∙mol-1
C 62,07 %, H 4,86 %, O 33,07 %,
290,27Propriétés physiques T° fusion 214 °C Solubilité 6 31 mg⋅L-1 Écotoxicologie DL50 10 mg⋅kg-1, rat, oral Composés apparentés Autres composés Afzéléchol Unités du SI & CNTP, sauf indication contraire. La catéchine est une molécule de la famille des flavonoïdes de la sous-classe des flavanols. Elle est aussi connue sous le nom de catéchol, avec le risque de confusion avec le pyrocatéchol parfois dénommé lui aussi catéchol. L’usage dans la communauté scientifique a fini par imposer le terme de catéchine, dérivé du terme anglais catechin.
Initialement découverte dans les fruits de l'acacia à cachou (Acacia catechu) duquel elle dérive son nom, la catéchine et ses nombreux isomères sont de puissants antioxydants qui aident à prévenir les maladies inflammatoires et coronariennes.
Le terme de catéchine est aussi parfois utilisé pour désigner la classe des flavanols (flavan-3-ols, flavan-3,4-ols et leurs esters galliques). Pour éviter la confusion entre la classe et le composé, ce dernier est désigné dans ce contexte par (+/-)-catéchine.
Sommaire
Les stéréo-isomères
La catéchine existe sous forme de plusieurs stéréoisomères provenant de deux carbones asymétriques. Les formes énantiomères (en image spéculaire) dans les positions 2 et 3 de l’hétérocycle central, nommée configuration R/S, donnent les quatre structures suivantes[1] :
Structures des énantiomères de la catéchine/épicatéchine Nom Configuration Formule (+)-catéchine 2R, 3S 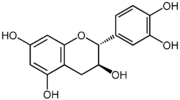
(-)-épicatéchine 2R, 3R 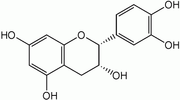
(-)-catéchine 2S, 3R 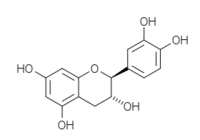
(+)-épicatéchine 2S, 3S 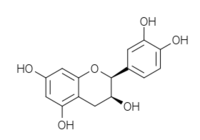
Dans la nature, les isomères les plus fréquents sont la (+)-catéchine et la (-)-épicatéchine. Les deux autres énantiomères sont beaucoup plus rares et leur présence semble liée à des réactions enzymatiques ou à des traitements thermiques. C’est ainsi que la fève de cacao fraîche contient principalement de la (-)-épicatéchine et un peu de (+)-catéchine. Mais une fois torréfiée, la fève (et le chocolat) révèle en plus de la (-)-catéchine. La haute température nécessaire à la torréfaction déplace l’équilibre d’épimérisation vers la (-)-catéchine :
(-)-épicatéchine → (-)-catéchine
Certaines plantes synthétisent en égales quantités les énantioméres (+) et (-). Ainsi la racine de centaurée maculée[2] (Centaurea maculata) exude une (±)-catéchine racémique avec une composante (-)-catéchine développant une activité herbicide puissante susceptible de repousser les plantes voisines compétitives.
Le chauffage de la catéchine au-delà de son point de décomposition libère du pyrocatéchol, dénommé aussi catéchol, au risque de confusion.
Les tanins condensés sont des oligomères ou des polymères dérivés de la (+)-catéchine ou de ses isomères.
Quelques catéchines communes
Catéchines communes du thé et du vin avec une configuration –cis dans les positions 2, 3 :
Structures de catéchines 2,3-cis Composés R3 R5’ Structures (-)-épicatéchine EC OH H 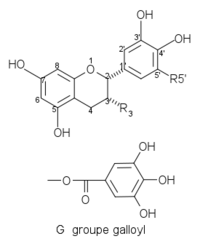
(-)-épigallocatéchine EGC OH OH (-)-épicatéchine gallate ECG G H (-)-épigallocatéchine gallate EGCG G OH Quelques catéchines communes avec une configuration -trans dans les positions 2, 3 :
Structures de catéchines 2,3-trans Composés R3 R5’ Structures (+)-catéchine C OH H 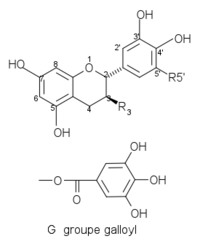
(+)-gallocatéchine GC OH OH (+)-gallocatéchine gallate GCG G OH Plantes riches en catéchines
- le théier (Camellia sinensis) : les flavonoïdes de la feuille de théier sont constitués à 80% de flavanols, à savoir (+)-catéchine C, (-)-épicatéchine EC, (+)-gallocatéchine GC et leur esters galliques[3]
Composition moyenne des feuilles de thé fraîches en flavanols Flavanols Résultats en g/kg MS (-)-Epigallocatéchine gallate EGCG 90-130 (-)-Epigallocatéchine EGC 30-60 (-)-Epicatéchine gallate ECG 30-60 (+)-Gallocatéchine GC 30-40 (-) Epicatéchine EC 10-30 (+) Catéchine C 10-20 Les thés verts, oolong et noirs se différencient par l’importance de l’oxydation enzymatique subies par les feuilles lors d’un processus improprement appelé « fermentation »[4]. Les flavonoïdes du thé vert, comme ceux de la feuille fraiche, sont à 80% des flavanols mais après oxydation, il n'en reste plus que 20 à 30% dans le thé noir.[5].
La composition en flavanols des thés trouvés dans le commerce varie de manière importante suivant les différents paramètres liés à la culture des théiers puis au processus de fabrication. Voici quelques valeurs tirées de Chen[6] et collaborateurs pour le thé vert de Chine et de Kuroda et Hara[7] pour un thé noir de Darjeeling.
Composition des thés marchands en flavanols
(Résultats en g/kg MS)Flavanols Thé vert Thé noir Maxi Mini Moyenne EGCG 106,2 58,67 93,03 40,2 EGC 47,94 28,13 33,59 . ECG 40,60 13,37 34,68 39,20 EC 13,38 7,20 9,79 6,7 Total 171,09 86,10 .
En infusant 20 g de thé vert dans un litre d’eau à 90 °C durant 5 mn, on obtient la composition en flavanols suivante[8] :
Composition en flavanols d’une infusion de thé vert
(Résultats en mg/L)EGCG EGC ECG EC C Total 489,6 705,9 48,1 84,9 7,8 1336,3 Dans ces conditions optimum, une tasse de thé vert de 150 ml contient donc environ 200 mg de flavanols. Mais en raison des nombreux paramètres de variation allant de la culture, de l'époque de la récolte, de la fabrication jusqu’à l’infusion, les valeurs varient beaucoup suivant les auteurs. Bronner et Beecher[9] trouvent des valeurs 10 fois moindre, en infusant 3 g de feuilles durant 3 mn dans un litre d'eau bouillante, ils estiment qu'une tasse (de 150 ml) de thé vert contient 18 mg de flavanols et qu'une tasse de thé noir en contient 49,5 mg. Pour le thé noir, Arts et collaborateurs[10] estiment qu'une tasse de 150 ml contient 20 mg de flavanols (monomères).
- la vigne (Vitis vinifera) : le raisin est riche en (+)-catéchine, (-)-épicatéchine et son ester gallique, l’épicatéchine-3-gallate. Ces flavanols sont concentrés dans les pépins, à des doses diverses suivant le cépage, le terroir, le millésime, la maturité phénolique. On trouve des concentrations élevées dans les pépins de raisin Merlot et Cabernet Sauvignon[11] :
Composition des pépins de raisin en flavanols récoltés en Toscane (Italie)
Résultats en mg/kg MSCépages (+)-Catéchine (-)-Epicatéchine Merlot 1388 1318 Cabernet Sauvignon 1418 1276 Lors de la vinification, diverses techniques de macération permettent d’extraire plus ou moins de flavonoïdes des pellicules et des pépins. Ces composés se retrouvent donc dans les vins rouges en concentration encore assez élevées[12] :
Composition moyenne des vins rouges en flavanols
Résultats en mg/LFlavanols Maxi Mini Moyenne (+)-Catéchine 300 20 130 (-)-Epicatéchine 120 5 60 (+)-Gallocatéchine 80 7 35 (-)-Epigallocatéchine 35 2 13 Soit en moyenne, un total de 238 mg/L de flavanols, ce qui fait pour un verre de 12 cl une valeur de 28,5 mg.
- le cacaoyer (Theobroma cacao) : la fève de cacao contient de 12 à 18% de polyphénols (en % de matières sèches) avec environ 35% de ceux-ci sous forme de (-)-épicatéchine[13] (pour la fève de Forastero non fermentée). Pour devenir du cacao, les fèves doivent subir une fermentation, un séchage et une torréfaction. Durant ces nombreuses opérations la majeure partie des catéchines et procyanidols sont convertis en quinones. Dans le cacao, les flavanols restent cependant majoritaires parmi les polyphénols, avec en premier la (-)-épicatéchine puis la (+)-catéchine, le (+)-gallocatéchine, et (-)-épigallocatéchine ainsi que des proanthocyanidols constitués de 2 ou 3 unités de (+)-catéchol et/ou (-)-épicatéchol, à savoir les procyanidols B1, B2, B3, B4, B5, C1, et D. Les hautes températures de la torréfaction convertissent une partie de la (-)-épicatéchine en son épimère la (-)-catéchine[1]. Les cacaos marchands de la Côte-d’Ivoire contiennent de 2,2 à 4,8 g/kg d’épicatéchine[14].
Les catéchines se retrouvent dans le chocolat, à raison de 53,5 mg/100g dans le chocolat noir et de 15,9 mg/100g dans le chocolat blanc[15].
Pour avoir une idée des ordres de grandeur, on peut dire que 4 carrés de chocolat noir (soit 40g), une tasse de thé et un verre de vin rouge fournissent grosso-modo la même quantité de flavanols.
- les fèves sont riches en catéchines mais pas les haricots ni les choux. De nombreux fruits sont aussi riches en catéchines : les mûres en premier, bien sûr le raisin, puis les cerises, abricots, framboises, pommes, prunes, fraises, poires et pêches[16] :
Composition en flavanols de fruits et légumes, crus
(Résultats en mg/kg de matière fraîche)(-)-épicatéchine (+)-catéchine Total Fève (Vicia faba), graine crue 225,1 128,3 353,4 Mûre (Rubus sp.) 180,8 6,6 187,4 Raisin noir 86,4 89,4 175,8 Cerise 95,3 21,7 11,70 Abricot 60,6 49,5 110,1 Framboise 82,6 9,7 92,3 Pomme avec sa peau 81,4 9,5 90,9 Prune 28,4 33,5 61,9 Fraises 0 44,7 44,7 Absorption et biodisponibilité des catéchines
Après consommation de thé, de vin ou de chocolat, les catéchines de ces produits subissent dans le système digestif d’importantes transformations. Les bactéries intestinales et les entérocytes de l'intestin en métabolisent la plus grande partie. Une fois traversées la paroi de l’intestin, 45% de la catéchine et de l’épicatéchine se retrouvent sous forme glucuronidée, 30% sous forme o-méthylée et 20% sous forme o-méthylglucuronidée (d’après une étude sur l’intestin grêle du rat de Kuhnle et collaborateurs[17]). Chez l’homme aussi, on sait que seulement 1,68% des catéchines ingérées se retrouvent dans le plasma sanguin, les urines et les excréments[18]. L’EGCG ne va pratiquement pas dans le sang et la partie absorbée est principalement excrétée par la bile dans le colon[19]. L’EGC et l’EC sont un peu plus biodisponibles. Mais l’EGC est malgré tout détectée principalement sous forme glucuronidée (57-71%) ou sulfatée (23-36%) et seulement une faible partie se trouve à l’état libre (3-13%). L’EC est détectée pour les 2/3 sous forme sulfatée et 1/3 glucuronidée[20].
Les métabolites apparaissent relativement rapidement dans la circulation sanguine puisqu'un pic de concentration est observable 2,5 h après l'ingestion d'un aliment riche en flavanol[21]. Ils sont ensuite rapidement excrétés dans la bile et l'urine.
Activités biologiques
Activités anti-oxydantes
Une production excessive de radicaux libres dans l’organisme peut provoquer des dégâts importants sur les macromolécules et les cellules de cet organisme. La dégradation des lipides par le stress oxydant provoque des dépôts de lipides oxydés dans les vaisseaux à l’origine des plaques d’athérome, perturbe le fonctionnement des membranes cellulaires et génère des dérivés carcinogènes.
Les catéchines, comme tous les polyphénols, possèdent des groupes hydroxyles phénoliques, Ar-OH, pouvant fournir des H aux radicaux peroxyles L-OO• et par là, les neutraliser sous la forme d’hydroxydes L-OOH :
Ar-OH + L-OO• → Ar-O• + L-OOH
Le radical Ar-O• étant assez stable et moins réactif, va briser la chaîne.
Comme il n’existe pas de mesure absolue d’évaluation du potentiel anti-oxydant d’un composé, il faut recourir à des évaluations comparatives avec d’autres composés. De plus ces comparaisons vont dépendre de la méthode d’évaluation et en particulier du radical libre péroxyle utilisé.
- En comparant la capacité in vitro à piéger les radicaux libres du DPPH• (2,2-diphényl 1-picrylhydrazyl)[22] par les catéchines, Nanjo et collaborateurs[23] ont montré qu’il n’y avait pas de différence significative entre d’une part la (+)-C, (-)-EC, (-)-EGC, (-)-EGCG et d’autre part leurs épimères respectifs la (+)-EC, (-)-C, (-)-GC, (-)-CG, (-)-GCG. Ainsi la capacité de piégeage des catéchines ne dépend pas de leur stéréoisomérie. Les dérivés galloylés de catéchines sont par contre des piégeurs plus puissants que les nongalloylés. On obtient ainsi l’ordre décroissant d’activité anti-oxydante suivante :
- (-)-EGCG > (-)-EGC > (-)-ECG > (-)-EC
- Les diverses méthodes de mesure du pouvoir anti-oxydant des composés phénoliques donnent en général des résultants différents[24]. La moyenne pondérée des résultats obtenus par quatre méthodes différentes donne toutefois un classement concordant des flavanols :
- GC >> EGCG > EGC > EC = C
- Le pouvoir anti-oxydant du gallocatéchine gallate GC l’emporte largement sur les autres.
- Si le pouvoir anti-oxydant des flavanols est bien établi par les études in vitro, il n’en est pas de même in vivo en raison de leur faible biodisponibilité. Les études in vivo ont porté sur des boissons ou des aliments riches en flavanols mais comportant aussi d’autres polyphénols et des vitamines dotés eux aussi d’un potentiel anti-oxydant très puissant.
Il existe une demi douzaine de méthodes pour évaluer le potentiel anti-oxydant du plasma sanguin après consommation d’aliments riches en flavanoïdes. Beaucoup d’études ont montré qu’il existe une corrélation significative entre le potentiel anti-oxydant mesuré et le contenu total en polyphénols du produit alimentaire étudié, bien que le plasma puisse contenir d’importantes concentrations d’anti-oxydants vitaminiques (vitamines C et E) et urique, associé à de très faible concentration de flavonoïdes.
Plusieurs études ont porté sur la capacité anti-oxydante du plasma de sujets avant et après qu’ils aient consommé du thé et toutes ont observé une augmentation significative de la capacité anti-oxydante du plasma environ une heure après l’ingestion (avec un avantage pour le thé vert)[25].
Des observations in vivo semblables ont été faites pour le vin et le chocolat. Toutes les études s’accordent sur une augmentation significative de la capacité anti-oxydante du plasma environ une heure après consommation de vin rouge[25].
Suite à la consommation de chocolat, la concentration plasmatique en (-)-épicatéchine croît rapidement jusqu’à atteindre un pic au bout de 2 heures puis diminue lentement[26]. Après une consommation régulière de chocolat sur une longue période, il a été observé une meilleure résistance des particules de LDL au stress oxydant et une augmentation de la capacité anti-oxydante totale du serum[27]. Par contre le même genre d’études portant sur une consommation régulière sur une longue période de thé ou de vin n’ont pas apporté de résultats cohérents[25].
Une découverte récente dans l’analyse du plasma après consommation de produits riches en flavonoïdes a permis d’éclairer les divergences qui peuvent parfois apparaître entre mesures in vitro et in vivo. Lolito et collaborateurs[25] ont observé l’apparition surprenante d’un pic de concentration d’acide urique dans le plasma sanguin (suite à la consommation de pommes) suivant précisément le pic de capacité antioxydante du plasma. L’acide urique est un anti-oxydant qui ne se trouve pas dans les pommes mais dont l’apparition dans le sang proviendrait de la consommation du fructose contenu dans les pommes. Le rôle de l’urate a été confirmé par une étude sur le vin rouge de Modun et collaborateurs[28]. En faisant consommer successivement du vin rouge, du vin rouge déalcoolisé, du vin rouge débarrassé de ses polyphénols, de l’éthanol et de l’eau, ces auteurs ont pu établir clairement que l’augmentation de la capacité anti-oxydante du plasma pouvait s’expliquer par à la fois le pic de cétachines (et de polyphénols) dans le plasma et le pic d’urate.
..............
Ces molécules permettent aussi d’inhiber la germination de graines lors de compétition entre plantes, ce qui induit une diminution du recrutement d’espèces voisines et donc un effet sur la dynamique des populations avec lesquelles elles sont en compétition.
Notes et références
- ↑ a et b (en) Michael Kofink, Menelaos Papagiannopoulos and Rudolf Galensa, « (-)-Catechin in Cocoa and Chocolate: Occurence and Analysis of an Atypical Flavan-3-ol Enantiomer », dans Molecules, vol. 12, 2007, p. 1274-1288
- ↑ (en) Harsh Pal Bais, Travis S. Walker, Frank R. Stermitz, Ruth A. Hufbauer, and Jorge M. Vivanco, « Enantiomeric-Dependent Phytotoxic and Antimicrobial Activity of (-)-Catechin. A Rhizosecreted Racemic Mixture from Spotted Knapweed », dans Plant Physiology, vol. 128, 202, p. 1173-1179
- ↑ (en) Fereidoon Shahidi, Marian Naczk, Phenolics in Food and Nutraceuticals, CRC Press, 2004 (ISBN 1-58716-138-9)
- ↑ P. Sarni-Manchado, V. Cheynier, Les polyphénols en agroalimentaire, Lavoisier, Editions Tec & Doc, 2006, 398 p. (ISBN 2-7430-0805-9)
- ↑ (en) Bauer E Sumpio, Alfredo C Cordova, David W Berke-Schlessel, Feng Qin, Quan Hai Chen, « Green Tea, the “Asian Paradox,” and Cardiovascular Disease and Cardiovascular Disease », dans J Am Coll Surg., vol. 202, no 5, 2006
- ↑ (en) Quansheng Chen, Zhiming Guo, Jiewen Zhao, « Identification of green tea’s (Camellia sinensis (L.)) quality level according to measurement of main catechins and caffeine contents by HPLC and support vector classification pattern recognition », dans Journal of Pharmaceutical and Biomedical Analysis, vol. 48, 2008, p. 1321-1325
- ↑ (en) Yukiaki Kuroda (Ed.), Yukihiko Hara (Ed.), Health Effects of Tea and Its Catechins: Mystery of Tea Catechins, Springer, 2004
- ↑ (en) David Labbé, Angelo Tremblay, Laurent Bazinet, « Effect of brewing temperature and duration on green tea catechin solubilization: Basis for production of EGC and EGCG-enriched fractions », dans Separation and Purification Technology, vol. 49, 2006, p. 1-9
- ↑ (en) W.E. Bronner, G.R. Beecher, « Method for determining the content of catechins in tea infusions by high-performance liquid chromatography », dans Journal of Chromatography A, vol. 805, 1998, p. 137-142
- ↑ (en) Ilja C W Arts, Peter C H Hollman, Daan Kromhout, « Chocolate as a source of tea flavonoids », dans The Lancet, vol. 354, 1999
- ↑ (en) P. Iacopini, M. Baldi, P. Storchi, L. Sebastiani, « Catechin, epicatechin, quercetin, rutin and resveratrol in red grape: Content,in vitro antioxidant activity and interactions », dans Journal of Food Composition and Analysis, vol. 21, 2008, p. 589-598 [[doi:10.1016/j.jfca.2008.03.011 texte intégral]]
- ↑ Nicolas Vivas, Les composés phénoliques et l’élaboration des vins rouges, Editions Féret, Bordeaux, 2007
- ↑ (en) Fereidoon Shahidi, Marian Naczk, Phenolics in Food and Nutraceuticals, CRC Press, 2004 (ISBN 1-58716-138-9)
- ↑ (en) J. Pontillon (coord.), Cacao et Chocolat, production, utilisations, caractéristiques, Lavoisier, TEC& DOC, 1997
- ↑ (en) I.C. Arts, P.C.H. Hollman, D. Kromhout, « Chocolate as a source of tea flavanoids », dans The Lancet, no 354, 1999
- ↑ U.S. Department of Agriculture, « USDA Database for the Flavonoid Content of Selected Foods » sur http://www.nal.usda.gov, 2003, National Agricultural Library, p. 1-78. Consulté le 31/10/2008 [pdf]
- ↑ (en) Gunter Kuhnle, Jeremy P. E. Spencer, Hagen Schroeter, Baskar Shenoy, Edward S. Debnam, S. Kaila S. Srai, Catherine Rice-Evans, and Ulrich Hahn, « Epicatechin and Catechin are O-Methylated and Glucuronidated in the Small Intestine », dans Biochemical and Biophysical Research Communications, vol. 277, 2000, p. 507-512
- ↑ (en) Beverly A. Warden, Lametta S. Smith, Gary R. Beecher, Douglas A. Balentine and Beverly A. Clevidence, « Catechins Are Bioavailable in Men and Women Drinking Black Tea throughout the Day », dans The Journal of Nutrition, vol. 131, 2001, p. 1731-1737
- ↑ (en) Mao-Jung Lee, Pius Maliakal, Laishun Chen, Xiaofeng Meng, Flordeliza Y. Bondoc, Saileta Prabhu, George Lambert, Sandra Mohr, and Chung S. Yang3, « Pharmacokinetics of Tea Catechins after Ingestion of Green Tea and (-)-Epigallocatechin-3-gallate by Humans: Formation of Different Metabolites and Individual Variability », dans Cancer Epidemiology, Biomarkers & Prevention, vol. 11, 2002, p. 1025-1032
- ↑ (en) Joshua D. Lambert, Chung S. Yang, « Cancer chemopreventive activity and bioavailability of tea and tea polyphenols », dans Mutation Research, vol. 523-524, 2003, p. 201-208
- ↑ (en) Wang JF, Schramm DD, Holt RR, Ensunsa JL, Fraga CG, Schmitz HH, Keen CL, « A dose-response effect from chocolate consumption on plasma epicatechin and oxidative damage », dans J Nutr, vol. 130, 2000
- ↑ quand un agent antiradicalaire est ajouté au DPPH•, l’électron libre est apparié et la couleur pourpre change en jaune
- ↑ (en) Nanjo F, Goto K, Seto R, Suzuki M, Sakai M, Hara Y., « Scavenging effects of tea catechins and their derivatives on 1,1-diphenyl-2-picrylhydrazyl radical. », dans Free Radic Biol Med., vol. 21, no 6, 1996, p. 895-902
- ↑ (en) Jessica Tabart, Claire Kevers, Joël Pincemail, Jean-Olivier Defraigne et Jacques Dommes, « Comparative antioxidant capacities of phenolic compounds meausured by various tests », dans Food Chemistry, vol. 113, 2009, p. 1226-1233
- ↑ a , b , c et d (en) Silvina B. Lotito, Balz Frei, « Consumption of flavonoid-rich foods and increased plasma antioxidant capacity in humans: Cause, consequence, or epiphenomenon? », dans Free Radical Biology & Medicine, vol. 41, 2006, p. 1727-1746
- ↑ (en) Janice F. Wang, Derek D. Schramm, Roberta R. Holt, Jodi L. Ensunsa, Cesar G. Fraga, Harold H. Schmitz and Carl L. Keen, « A Dose-Response Effect from Chocolate Consumption on Plasma Epicatechin and Oxidative Damage », dans The Journal of Nutrition, vol. 130, 2000
- ↑ (en) Ying Wan, Joe A Vinson, Terry D Etherton, John Proch, Sheryl A Lazarus and Penny M Kris-Etherton, « Effects of cocoa powder and dark chocolate on LDL oxidative susceptibility and prostaglandin concentrations in humans », dans Am J Clin Nutr., vol. 74, no 5, 2001, p. 596-602
- ↑ (en) Darko Modun, Ivana Music, Jonatan Vukovic, Ivica Brizic, Visnja Katalinic, Ante Obad, Ivan Palada, Zeljko Dujic, Mladen Boban, « The increase in human plasma antioxidant capacity after red wine consumption is due to both plasma urate and wine polyphenols », dans Atherosclerosis, vol. 197, 2008, p. 250-256
Liens externes
Estimation de l'apport en catéchines et procyanidines relatif à une consommation modérée et régulière de vins en France, Carando S., Teissedre P. L., et Cabanis J. C. du Centre de formation et de recherche en œnologie, Faculté de pharmacie, Montpellier.
- Portail de la chimie
- Portail de la médecine
Catégories : Antioxydant | Flavonoïde
Wikimedia Foundation. 2010.

