- Tanin condensé
-
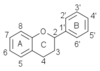
Les tanins condensés sont des polymères de flavanols. Ils sont constitués d'unités de flavan-3-ols liées entre elles par des liaisons carbone-carbone de type 4→8 ou 4→6 (voir la structure ci-dessous).
Ces tanins sont très abondants dans certains végétaux consommés par l'homme comme les prunes, fraises et pommes ou des boissons comme le vin[1]. C'est eux qui confèrent une astringence à ces produits alimentaires.
D'autre part, leur aptitude à piéger les radicaux libres pourrait réduire les risques de maladies cardiovasculaires et de cancer[2] et ils accéléreraient de 50% la vitesse de cicatrisation des plaies superficielles[3].
Sommaire
Définition
Les tanins condensés sont des composés non hydrolysables[N 1] mais qui peuvent être dépolymérisés en anthocyanidols lorsqu'ils sont traités à chaud par un acide. Ils sont habituellement dénommés d'après l'anthocyanidols ainsi libérés.
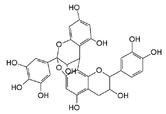
Par exemple, le monomère (+)-catéchol (un flavan-3-ol) est une unité constitutive du dimère catéchol-(4α→8)-catéchol que l'on nommera procyanidol B-3 en raison de sa dégradation en milieu acide en cyanidol. C'est la raison pour laquelle on dénomme[4] aussi les tanins condensés « proanthocyanidol » ou « proanthocyanidines » (sur le modèle de l'anglais proanthocyanidins). Les hydroxyles OH sont dans les mêmes positions sur le monomère et le produit de dépolymérisation, seul change le cycle central.
monomère polymère produit de dégradation FLAVAN-3-OL → TANIN CONDENSE
=PROANTHOCYANIDOL
(exemple)→ ANTHOCYANIDOL 
(+)-Catéchine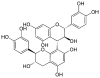
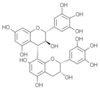
Catéchol-(4α→8)-catéchol
=Procyanidol B-3 
Cyanidol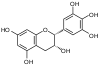
(-)-Epigallocatéchol
(+)-Gallocatéchol
(+)-Gallocatéchol-(4→8)-(-)épigallocatéchol
= Prodelphinidol B-4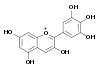
DelphinidolEn milieu acide à chaud, la libération de cyanidol est typique des procyanidols, celle de delphinidols caractérise les prodelphinidols. Les anthocyanidols sont des pigments très colorés.
Les liaisons entre les unités flavaniques se font entre le cycle C et le cycle A, lorsqu'elles ont lieu entre les cycles A et A ou A et B, on ne ne les classe pas dans les proanthocyanidols stricto sensu (comme la theasinensine).
Jack Masquelier, de l'université de Bordeaux, a été le premier dans les années 1950 a mener une étude approfondie des composés flavaniques de l'écorce de pin et des pépins de raisin. Il détermina la structure chimique de nombreux composés chimiques de la série catéchique et déposa plusieurs brevets sur la purification des procyanidines oligomères (sous le nom commercial de pycnogénol[5]) et leurs utilisations thérapeutiques. Les termes de oligo-proanthocyanidines (OPC), oligo-procyanidines[6],[N 2] ou procyanidines oligomériques ou polymériques sont aussi utilisés[N 3].
Structures des tanins condensés
Il existe une douzaine d'unités monomères flavanols entrant dans la construction des tanins condensés. Elles peuvent en outre être substituées par l'acide gallique ou par des sucres, généralement en position 3 et parfois en position 5 et 7.
Flavanols et anthocyanidols comportent tous trois cycles : un cycle A avec en général un ou deux hydoxyles OH, un hétérocycle C avec des carbones asymétriques 2 et 3 (et un hydroxyle en 3), et un cycle B avec un hydroxyle OH (afzeléchol, épiafzeléchol), deux OH (catéchol et épicatéchol), trois OH (gallocatéchol, épigallocatéchol). Les composés avec la configuration cis- (2R,3R) ont un nom préfixé par épi-, les autres sont dans la configuration trans- (2R,3S).
La liaison interflavanique des unités est majoritairement de type C-4 → C-8 parfois C-4 → C-6. Dans la nature, les deux groupes de proanthocyanidols les plus abondants sont les procyanidols et les prodelphinidols.
Si une deuxième liaison apparait entre le cycle C et le cycle A (de type 2→O→7 éther), on parle de proanthocyanidols de type A. Ceux avec une seule liaison 4→8 ou 4→6 sont dits de type B.
Par additions successives d'unités flavanols, il se forme des dimères, trimères et jusqu'à des polymères pouvant compter plusieurs dizaines d'unités élémentaires.
Dimères
Les proanthocyanidols dimériques les plus simples sont les procyanidols[7] (ou procyanidines).
- Procyanidols de type B-1, B-2, B-3 et B-4
Ce sont des dimères constitués à partir des deux unités (+)-catéchol et (-)-épicatéchol, liées en C-4 → C-8.
- Procyanidols de type B-5, B-6, B-7 et B-8
Ce sont des dimères constitués aussi à partir des deux unités (+)-catéchol et (-)-épicatéchol mais avec une liaison en C-4 → C-6.
Il existe aussi des O- et C-glucosides de procyanidols, par exemple chez la rhubarbe et le théier.
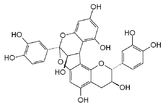
- Prodelphinidols : ce sont des dimères construits sur le même modèle mais avec le gallocatéchol et l'épigallocatéchol.
Certains de ces dimères ont été isolés à l'état de gallates chez les hamamélis[4].
- Proanthocyanidols de type A
Ce sont des dimères ayant une liaison interflavanique double :
1) liaison C-4 → C-8 et
2) liaison éther C-2 → O → C-7- Propélargonidols et prodelphinidols sont plus rares
- On trouve des profisétinidols[8] constitués de deux monomères différents : (-)-fisétinidol-(4,8)-(-)-épicatéchol dans le Guibourtia coleosperma, une fabacée africaine.
- Dans l'écorce de Stryphnodendron adstringens , une fabacée du Brésil, il a été trouvé plusieurs prorobinetinidols[9] : robinetinidol-(4β → 8)-epigallocatechin, robinetinidol-(4α → 8)-epigallocatechin, robinetinidol-(4β → 8)-epigallocatechin 3-O-gallate, robinetinidol-(4α → 8)-epigallocatechin 3-O-gallate etc.
Oligomères
Ils se forment par additions successives d'unités flavaniques.
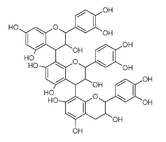
- Trimère C-1 : formés de trois épicatéchols avec des liaisons 4β→8
- Trimère C-2 : formés avec trois catéchols liés 4β→8
- Trimères et oligomères peuvent aussi être formés par addition d'unités flavaniques sur un dimère doublement lié (de type A).
Polymères
Les structures polymériques des proanthocyanidols sont constituées d'une unité supérieure, d'une unité intermédiaire réitérée et d'une unité inférieure. Le nombre moyen d'unité monomériques définit le degré moyen de polymérisation.
Les pépins de raisins contiennent des proanthocyanidols formés de 4 à 18 unités flavanol monomères et jusqu'à 30 unités dans la pellicule. Mais certains polymères naturels peuvent aller jusqu'à une cinquantaine d'unités. Ils tendent alors à être insolubles et difficiles à étudier.
Les polymères les plus largement répandus sont des poly-épicatéchols et des copolymères procyanidol-prodelphinidol[4] avec pour la plupart des liaisons interflavaniques C4→C8.
Les unités inférieures (ou terminales) peuvent contenir des flavonoïdes autres que les flavanols. Par exemple, l'écorce de certains pin contient des quantités mesurables de flavanones qui en raison de leur fonction carbonyle en C-4 peuvent seulement être présents dans l'unité terminale[10].
Distribution chez les végétaux
Aliments et boissons d'origine végétale
Le légume le plus riche en proanthocyanidols est de loin le haricot commun. Les pois et lentilles en contiennent très peu. Les carottes et aubergines en sont dépourvues[11].
Les fruits les plus riches sont par ordre décroissant[12] : prune, fraise, cassis, pomme, raisin noir. Les noisettes et noix sont aussi très riches. Un fruit nord américain, l'aronie à fruits noirs, bat tous les records[13],[14],[15].
Les proanthocyanidols des légumes, fruits et noix
teneur moyenne en mg/100 g MF, d'après la base de l'INRA et Gu et als[14] (2004)Végétal Dimères Trimères 4-6 mères 7-10 mères Polymères
(>10 mères)Total Aronie à fruit noir
Photinia melanocarpa12,5 10,3 40,3 52,9 542,6 658,6 Haricot commun, cru
Phaseolus vulgaris25,3 25,2 107,9 105,5 325,3 589,2 Noisette
Corylus avellana12,5 13,6 67,7 74,6 322,4 490,8 Noix de pécan
Carya illinoinensis42,1 26,0 101,4 84,2 223,0 476,7 Prune fraîche
Prunus domestica23,6 20,5 57,3 36,6 89,1 227,1 Amande
Prunus dulcis9,5 8,8 40,0 37,7 80,3 176,3 Fraise
Fragaria x ananassa6,5 6,5 28,1 23,9 75,8 140,8 Cassis
Ribes nigrum3 2,3 8,7 9,7 113,6 137,3 Pomme, entière
Malus pumila12,0 7,8 26,5 22,4 32,6 101,3 Raisin noir
Vitis vinifera2,0 1,5 6,1 6,2 44,6 60,4 Noix
Juglans regia5,6 7,2 22,1 5,4 20,0 60,3 Groseille
Ribes rubrum2 1,5 6,9 7,9 41,2 59,5 Toutes ces grandeurs indiquent des ordres de grandeur car il faut savoir que les variations peuvent être très importantes sur un même produit d'une année à l'autre et suivant les variétés cultivées et les techniques de cultures. Pour les produits transformés, s'ajoutent les variations sur les processus de transformation.
Toujours d'après l'étude déjà citée, de Gu Liwei et al (2004) sur des produits qu'ils se sont procurés dans quatre régions des États-Unis et au cours de deux saisons, le jus de raisin et le vin sont les meilleures sources de proanthocyanidols pour les boissons. La bière l'est beaucoup moins et le café pas du tout.
Les proanthocyanidols des boissons
en mg/100 ml MF, d'après Gu et als (2004)Végétal Monomère Dimères Trimères 4-6 mères 7-10 mères Polymères
(>10 mères)Total jus de raisin 1,8 3,4 1,9 8,0 6,9 30,3 52,3 vin rouge 2,0 4,0 2,7 6,7 5,0 11,0 31,4 chocolat au lait
(boisson)0,4 2,20 0,0 0,0 0,0 0,0 2,6 bière 0,4 1,1 0,3 0,4 nd nd 2,2 Pour le vin, le cépage et le millésime semblent jouer un rôle déterminant. Une étude comparative[16], menée en 2001 et 2002 en Uruguay, sur trois cépages différents, cultivés dans la même région, avec les mêmes techniques culturales et vinifiés dans les mêmes conditions, a montré le plus grand potentiel phénolique du Tannat par rapport au Cabernet-Sauvignon et au Merlot.
Composition flavanique de vins en 2002
en mg/100 ml, d'après González-Neves et alsVin Tannat Cabernet-Sauvignon Merlot Catéchine 190,85 104,34 109,94 Proanthocyanidols 405,14 239,06 197,67 Total 595,99 343,40 307,61 La même analyse menée l'année précédente, en 2001, avait donné des valeurs presque moitié pour les proanthocyadidols du tannat :
- tannat : 208,9 mg/100 ml
- cabernet-sauvignon : 171,8 mg/100 ml
- merlot : 144,9 mg/100 ml
mais encore très supérieures aux données américaines (6,6 fois). Roger Corder[17] qui a mené des analyses sur des vins de différentes régions du monde confirme ce classement :« D'après mon expérience en la matière, le cépage donnant les vins les plus riches en procyanidines est le Tannat, l'un des cépages traditionnels du Sud-Ouest de la France. ». Durant le vieillissement, la concentration en tanins condensés diminue rapidement. La technique de vinification joue aussi un rôle déterminant puisque plus le temps de macération du moût en présence des pellicules et des pépins est grand, plus importante est l'extraction des procyanidines. C'est pourquoi Roger Corder[N 4] affirme que « Les procyanidines sont pratiquement absentes du jus de raisin, car elles sont surtout présentes dans les pépins et ne se dissolvent dans le vin qu'au moment de la fermentation ».
Bien que le thé soit une boisson très riche en flavanols monomères, il n'entre pas dans les comparaisons avec le vin en raison de la nature différente de ses oligomères flavaniques[18] (la theasinensine à liaison 2 → 2' entre les deux cycles A ou le gallate biflavaniques à liaison 8 → 8' ne sont pas classés dans les proanthocyanidols stricto sensu).
Les fèves de cacao sont un des fruits les plus riches en proanthocyanidols mais les processus modernes de fabrication du chocolat en éliminent la plus grande partie. La plupart des marques de chocolat du marché contiennent peu de procyanidols mais d'après Roger Corder[17] le chocolat noir à forte teneur en cacao venant de l'Équateur en est le plus riche. Gu et ses collaborateurs (2004) donnent une concentration de proanthocyanidols et catéchine de 246 mg/100 g d'un chocolat noir de marque et origine inconnues. Il suffirait donc de 16 g de ce chocolat pour obtenir la même quantité de proanthocyanidol qu'un verre (125 mml) de vin californien qu'ils ont aussi analysé mais il en faudrait 303 g pour équivaloir au verre de tannat uruguayen de 2002 de qualité exceptionnelle. Corder donne une fourchette beaucoup plus restreinte « 25 à 30 g d'un « bon » chocolat noir contenant 70 à 85 % de cacao...sont équivalents à 125 ml de vin rouge riche en procyanidines ». Ce résultat donne un ordre de grandeur en accord avec l'étude comparative des contenus en flavonoïdes du chocolat et du vin menée au Brésil où Pimentel et al[19] (2010) ont trouvé qu'il faut 31 g de chocolat noir à 71 % pour obtenir la même quantité de flavonoïdes qu'un verre de 125 ml de tannat.
Plantes à tanins utilisées par la phytothérapie[4]
Les principales plantes médicinales dont l'activité pourrait être liée à la présence de tanins condensés sont :
- La feuille d'hamamélis (Hamamelis virginiana) contient jusqu'à 10% de tanins au sens large dont des proanthocyanidols (oligomères à unités O-galloylées en C-3). Elle est traditionnellement utilisée dans les manifestations subjectives de l'insuffisance veineuse (jambes lourdes, hémorroïdes) et en usage local en cas d'irritations.
- L'aubépine (Crataegus monogyna et C. laevigata) comporte des feuilles et fleurs contenant des procyanidols dimères B-2, B-4, B-5, des procyanidols trimères C-1 et autres, tétramère D-1, pentamères et hexamères. L'(-)-épicatéchol est aussi présent en quantité notable. Elle est réputée active sur le cœur.
- L'airelle à gros fruits (Vaccinum macrocarpon) appelée canneberge au Canada, ou cranberry, est caractéristique par ses proanthocyanidols dimères A-2, B-2 et trimères de l'épicatéchol à liaison interflavanique de type A. Le jus est bénéfique dans le traitement des infections urinaires.
- La vigne (Vitis vinifera) est utilisée pour ses feuilles et ses pépins de raisins. Ces derniers très riches en procyanidols sont utilisés pour l'amélioration des symptômes en rapport avec l'insuffisance veinolymphatique (jambes lourdes, douleurs).
- Le pin (Pinus spp.) est utilisé pour son écorce riche en oligomères proanthocyanidoliques. Elle améliorerait les symptômes fonctionnels de l'insuffisance veineuse chronique.
Biodisponibilité
Déprez et coll[20]. (2001) ont démontré que le (+)-catéchol, les dimères et trimères de proanthocyanidols étaient transportés au travers de la paroi intestinale mais que la perméabilité aux proanthocyanidols ayant un degré de polymérisation moyen de 6 était 10 fois inférieure ; ce qui semble indiquer que seuls les dimères et trimères seraient en partie absorbés et que les polymères atteindraient intacts le côlon où ils seraient dégradés. La microflore colique dégraderait ces polymères en acides phénols qui une fois absorbés se retrouvent dans les urines.
Deux études ont montré[21] qu'après la consommation d'extrait de pépins de raisins ou de cacao riche en flavanols, on pouvait détecter dans le plasma de faible quantité de procyanidol B-1 et B-2. Dans la dernière analyse, la quantité de dimère B-2 dans le plasma était 100 fois inférieure à celle des monomères de flavan-3-ols.
Activités biologiques in vivo
Les procyanidols purifiés sont faiblement actifs in vitro mais de nombreuses études d'intervention menées in vivo ont mis en évidence les effets biologiques de la consommation de produits riches en proanthocyanidols (cacao, raisins et vins). Comme ces produits contiennent aussi des monomères flavaniques (catéchine et épicatéchine) et qu'une polymérisation un peu élevée empêche l'absorption, il est difficile de savoir si les effets sont attribuables aux procyanidols ou à la composante monomérique. La quarantaine d'études passées en revue par Williamson et Manach[22] (2005) concernent principalement les effets sur le système vasculaire des aliments riches en procyanidols : augmentation notable de l'activité antioxydante du plasma, diminution du cholestérol LDL (le mauvais cholestérol), et augmentation du HDL, diminution de la susceptibilité à l'oxydation du LDL, diminution de la tension etc.
Mécanismes d'action
Les mécanismes d'actions mis en jeu dans ces effets restent mytérieux mais plusieurs hypothèses sont en cours d'examen :
- Activité antioxydante
Les procyanidols dimériques ont une activité antioxydantes plus élevée que les flavanols (monomériques), les flavonols, ou les acides hydroxycinnamiques[23]. Cependant cette activité non spécifique est limitée du fait de la faible biodisponibilité des proanthocyanidols. La faible quantité absorbée entre en concurrence avec les autres piégeurs de radicaux libres (α-tocophérol, ascorbates et glutathione) présents dans des concentrations très supérieures[24]. Exception faite du tractus gastro-intestinal et peut-être du sang, l'action potentielle des polyphénols comme piégeurs de radicaux libres n'a probablement aucune signification physiologique dans la plupart des organes[25].
- Activation de l'oxyde nitrique synthétase eNOS de l'endothélium des vaisseaux sanguins.
L'extrait polyphénolique de pellicules de raisins stimule une réaction vasodilatatrice qui viendrait d'une activation de eNOS, enzyme responsable de l'augmentation de la production d'oxyde nitrique NO. Les fractions actives des extraits contiennent des procyanidols et des anthocyanidols[26] (pétunidine-O-coumaroyl-glucoside). L'activité vasodilatatrice des procyanidols tend à augmenter avec le degré de polymérisation (Fitzpatrick et al[27], 2002).
Deux études ont montré que la prise orale de L-arginine et de pycnogénol[28],[29] (procyanidols oligomères) était capable d'améliorer de manière significative la fonction sexuelle chez des hommes souffrant de dysfonctionnement érectile. Dans la première étude, après deux mois de traitement, 80% des hommes ont retrouvé une érection normale et 92,5% après trois mois. Dans la deuxième étude, la prise de pycnogenol pendant un mois a ramené l'indice de fertilité à sa valeur normale. On sait en effet que l'érection pénienne résulte de la relaxation des muscles lisses caverneux déclenchée par l'oxyde nitrique NO.
- L'inhibition de la synthèse de l'endothéline-1 in vitro.
L'endothéline est un peptide vasoconstricteur puissant qui jouerait un rôle essentiel dans la survenue de l'athérosclérose. Corder et ses collaborateurs[30],[17] ont montré sur des cellules endothéliales en culture que les polyphénols du vin les plus puissants pour inhiber l'endothéline-1 étaient précisément ces procyanidols trouvés par Fitzpatrick et coll. Il s'agit d'OPC, des oligomères de procyanidols[N 5]. Plus la concentration en OPC augmente, plus la synthèse d'endothéline diminue[31].
Le passage des études in vitro aux études in vivo sur l'homme ont apporté quelques déconvenues car si elles ont confirmé qu'une forte absorption de vin rouge (ou de vin rouge sans alcool) faisait bien diminuer le niveau d'endothéline-1, elles n'ont trouvé aucun changement dans le diamètre des coronaires épicardiques et leur débit (Kiviniemi et al[32], 2010).
- Compétition pour la liaison aux récepteurs membranaires des androgènes[33]
Un traitement avec des procyanidols dimériques B2 et B5 (et aux monomères) provoquent une redistribution du cytosquelette d'actine et une induction de l'apoptose et la régression des tumeurs. Une autre étude montre que les procyanidols dimériques du vin rouge suppriment la biosynthèse des œstrogènes in situ par inhibition des aromatases.
Notes
- à la différence des tanins hydrolysables qui en milieu acide à chaud sont hydrolysés. Ces tanins hydrolysables (polyesters du glucose) libèrent sucre, acide gallique et/ou acide hexahydroxydiphénique
- En anglais : proanthocyanidin, oligomeric proanthocyanidin (OPC), leukocyanidin ou leucoanthocyanin
- bien que moins généraux que la terminologie de Jean Bruneton ici adoptée
- de l'université Queen Mary de Londres
- tétra-épicatéchine; procyanidine trimérique-gallate, procyanidine tétramérique and pentamérique-gallate
Références
- P. Sarni-Manchado, V. Cheynier, Les polyphénols en agroalimentaire, Lavoisier, Editions Tec & Doc, 2006, 398 p. (ISBN 2-7430-0805-9)
- Santos-Buelga, C. & Scalbert, A., « Proanthocyanidins and tannin-like compounds-nature, occurrence, dietary intake and effects on nutrition and health », dans J. Sci. Food Agric., vol. 80, 2000, p. 1094-1117
- Blazsó G, Gábor M, Schönlau F, & Rohdewald P., « Pycnogenol accelerates wound healing and reduces scar formation », dans Phytother Res., vol. 18, no 7, 2004, p. 579-81 [texte intégral]
- Bruneton, J., Pharmacognosie - Phytochimie, plantes médicinales, 4e éd., revue et augmentée, Paris, Tec & Doc - Éditions médicales internationales, 2009, 1288 p. (ISBN 978-2-7430-1188-8)
- (fr)Le pycnogénol, un puissant antioxydant, extrait du pin maritime sur www.nutranews.org, 1er juillet 2004. Consulté le 25 juin 2010.
- En français : « Oligo-proanthocyanidine », « procyanidine » et « oligo-procyanidine » sont équivalents.
- Camille Perret, Analyse de tannins inhibiteurs de la stilbène oxydase produite par Botrytis cinera, Thèse de l'université de Neuchâtel, faculté des sciences, 2001
- JP Steynberg et als, « Natural (-)-fisetinidol-(4,8)-(-)-epicatechin profisetinidins », dans Phytochemistry, vol. 29, no 1, 1990
- Prorobinetinidins from Stryphnodendron adstringens. Palazzo de Mello J.; Petereit F.; Nahrstedt A., Phytochemistry, 1996.
- Peter J. Hernes, J I Hedges, « Tannin signature of barks, needles, leaves, cones and wood at the molecular level », dans Geochimica et Cosmochimica Acta, vol. 68, no 6, 2004
- Erreur dans la syntaxe du modèle ArticleNutrient Data Laboratory, Beltsville, « USDA Database for the Proanthocyanidin content of selected foods », dans , 2004 [texte intégral]
- INRA Phenol-Explorer
- (en) Wu, X., Gu, L., Prior, R. L., & McKay, S. (2004). Characterization of anthocyanins and proanthocyanidins in some cultivars of Ribes, Aronia and Sambucus and their antioxidant capacity. J Agric Food Chem. 52 (26): 7846-7856. PMID 15612766. DOI: 10.1021/jf0486850
- Liwei Gu, Mark A. Kelm, John F. Hammerstone, Gary Beecher, Joanne Holden, David Haytowitz, Susan Gebhardt, and Ronald L. Prior, « Concentrations of Proanthocyanidins in Common Foods and Estimations of Normal Consumption », dans J; Nutr., vol. 134, 2004 [texte intégral]
- (en) Gu, L et al. Procyanidin and catechin contents and antioxidant capacity of cocoa and chocolate products. J Agric Food Chem. 2006 May 31;54(11):4057-61.
- (en) G. González-Neves, D. Charamelo, J. Balado, L. Barreiro, R. Bochicchio, G. Gatto, G. Gil, A. Tessore, A. Carbonneau and M. Moutounet, « Phenolic potential of Tannat, Cabernet-Sauvignon and Merlot grapes and their correspondence with wine composition », dans Analytica Chimica Acta, vol. 513, no 1, 2003
- Roger Corder, Boire mieux pour vivre vieux, Thierry Souccar Editions, 2009
- Alan Crozier, Indu B. Jaganath, Michael N. Clifford, « Dietary phenolics: chemistry, bioavailability and effects on health », dans Nat. Prod. Rep., vol. 26, 2009, p. 1001-1043
- Fernanda Araujo Pimentel, Julio Alberto Nitzke, Cláudia Blauth Klipel, Erna Vogt de Jong, « Chocolate and red wine – A comparison between flavonoids content », dans Food Chemistry, vol. 120, 2010
- Stephanie Deprez, Isabelle Mila, Jean-François Huneau, Daniel Tome, Augustin Scalbert., « Transport of Proanthocyanidin Dimer, Trimer, and Polymer Across Monolayers of Human Intestinal Epithelial Caco-2 Cells », dans Antioxidants & Redox Signaling, vol. 3, no 6, 2001, p. 957-967
- Alan Crozier, Daniele Del Rio, Michael N. Clifford, « Bioavailability of dietary flavonoids and phenolic compounds », dans The American Journal of Clinical Nutrition, vol. 81 (suppl), 2005 [[doi:10.1016/j.mam.2010.09.007 texte intégral]]
- Gary Williamson and Claudine Manach, « Bioavailability and bioefficacy of polyphenols in humans. II. Review of 93 intervention studies », dans The American Journal of Clinical Nutrition, vol. 81 (suppl), 2005
- Soobrattee, Neergheena, Luximon-Rammaa, Aruomab, Bahoruna, « Phenolics as potential antioxidant therapeutic agents : mechanism and actions », dans Mut. Res. Fund. Mol. Mech. Mutagen, vol. 53, 2005
- (en) Mónica Galleano, Sandra V. Verstraeten, Patricia I. Oteiza, Cesar G. Fraga, « Antioxidant actions of flavonoids: Thermodynamic and kinetic analysis », dans Archives of Biochemistry and Biophysics, vol. 501, 2010
- (en) Cesar G. Fraga, Monica Galleano, Sandra V. Verstraeten, Patricia I. Oteiza, « Basic biochemical mechanisms behind the health benefits of polyphenols », dans Molecular Aspects of Medicine, 2010, p. doi:10.1016/j.mam.2010.09.006
- Cyril Auger, Mehdi Chaabi, Eric Anselm, Annelise Lobstein, Valérie B. Schini-Kerth, « The red wine extract-induced activation of endothelial nitric oxide synthase is mediated by a great variety of polyphenolic compounds », dans Molecular Nutrition & Food Research, vol. 54, no S2, 2010 [[DOI: 10.1002/mnfr.200900602 texte intégral]]
- Fitzpatrick DF, Bing B, Maggi DA, Fleming RC, O'Malley RM., « Vasodilating procyanidins derived from grape seeds. », dans Ann N Y Acad Sci, no May: 957, 2002
- STANISLAVOV R., NIKOLOVA V., « Treatment of erectile dysfunction with Pycnogenol and L-arginine », dans Journal of sex and marital therapy, vol. 29, no 3, 2003
- Stanislavov R, Nikolova V, Rohdewald P., « Improvement of seminal parameters with Prelox®: a randomized, double-blind, placebo-controlled, cross-over trial », dans Phytother Res., vol. 23, no 3, 2009
- Corder R, Douthwaite JA, Lees DM, Khan NQ, Viseu Dos Santos AC, Wood EG, Carrier MJ., « Endothelin-1 synthesis reduced by red wine », dans Nature, vol. 414, 2001
- R. Corder, W. Mullen, N. Q. Khan, S. C. M Marks, E. G. Wood, M. J. Carrier, A. Crozier, « OENOLOGY Red wine procyanidins and vascular health », dans Nature, vol. 444, 2006
- (en) Tuomas O. Kiviniemi, Antti Saraste, Terho Lehtimäki, Jyri O. Toikka, Markku Saraste, Olli T. Raitakari, Jaakko J. Hartiala, Jorma Viikari, Juha W. Koskenvuo, « Decreased endothelin-1 levels after acute consumption of red wine and de-alcoholized red wine », dans Atherosclerosis, vol. 211, 2010
- Artemissia-Phoebe Nifli , Antoine Bosson-Kouame, Natalia Papadopoulou, Christina Kogiaa, Marilena Kampa , Chantal Castagnino , Christos Stournaras, Joseph Vercauterenc, Elias Castanasa, « Monomeric and oligomeric flavanols are agonists of membrane androgen receptors », dans Experimental Cell Research, vol. 309, 2005
Bibliographie
- Roger Corder, Boire mieux pour vivre vieux, Thierry Souccar Éditions, 2009 ( vinquebec.com Résumé du livre)
Liens externes
- (en) Transcription du Podcast avec le docteur Roger Corder, magazine Nature
- (en) Roger Corder, « Oenology: Red wine procyanidins and vascular health », Nature, 30 novembre 2006.
- (en) Roger Corder, [PDF] « Red wine procyanidins and vascular health », Nature
- (en) Fine AM, « Oligomeric proanthocyanidin complexes: history, structure, and phytopharmaceutical applications », dans Altern Med Rev, vol. 5, no 2, avril 2000, p. 144–51 [texte intégral, lien PMID]
- Portail de la vigne et du vin
- Portail de la chimie
Wikimedia Foundation. 2010.