- Cancer
-
 Pour les articles homonymes, voir Cancer (homonymie).
Pour les articles homonymes, voir Cancer (homonymie).Cancer
Classification et ressources externesLe crabe, symbole du cancer. DiseasesDB 28843 MedlinePlus 001289 MeSH D009369  Quand des cellules normales sont endommagées et qu'elles ne peuvent pas être soignées, elles meurent : c'est l'apoptose. Les cellules cancéreuses ne meurent pas et continuent de se développer.
Quand des cellules normales sont endommagées et qu'elles ne peuvent pas être soignées, elles meurent : c'est l'apoptose. Les cellules cancéreuses ne meurent pas et continuent de se développer.
Le cancer est une maladie caractérisée par une prolifération cellulaire anormalement importante au sein d'un tissu normal de l'organisme, de telle manière que la survie de ce dernier est menacée. Ces cellules dérivent toutes d'un même clone, cellule initiatrice du cancer qui a acquis certaines caractéristiques lui permettant de se diviser indéfiniment. Au cours de l'évolution de la maladie, certaines cellules peuvent migrer de leur lieu de production et former des métastases. Pour ces deux raisons, le dépistage du cancer doit être le plus précoce possible.
« Cancer » est un terme général désignant une maladie pour lesquelles certaines cellules d'un organisme adoptent un comportement anormal caractérisé par[1],[2],[3],[4] :
- une indépendance vis-à-vis des signaux qui stimulent normalement la prolifération cellulaire ;
- une insensibilité aux signaux et mécanismes anti-prolifératifs ;
- une capacité proliférative qui n'est plus limitée (croissance à l'infini) ;
- la disparition du phénomène d'apoptose ;
- une capacité anormale à susciter l'angiogenèse ;
- l'acquisition d'un pouvoir invasif et de production de métastase.
Les nouvelles cellules résultantes, dites cancéreuses ou tumorales peuvent former une tumeur maligne (un néoplasme) ou se propager à travers le corps.
Les facteurs de risques sont internes (génome, mutation[5], etc.), induction par un agent infectieux, etc. et/ou externes (alimentation, exposition à des substances cancérigènes ou à des conditions telles que l' irradiation, etc.). Des facteurs hormonaux, épigénétiques et psychosomatiques sont possibles.
Durant la dernière décennie, plusieurs types de cancers semblent en augmentation, si dans certains cas cette progression est facilement liée à des facteurs de risque identifiés (tabac, alcool, polluants industriels reconnus cancérigènes, obésité, sédentarité, exposition au soleil) dans certains cas il est difficile d'attribuer à des facteurs précis l'augmentation observée. L'amélioration des outils de diagnostic[6]et le vieillissement de la population[7] explique une part importante de la progression de l'incidence de certains cancers. À l'inverse une étude de l'InVS montre que les cancers de l'estomac, de l'oesophage (chez l'homme), du col de l'utérus et le lymphome Hodghinien ont régressé entre 1980 et 2000[8].
Sommaire
Terminologie
L'oncologie (ou cancérologie) est la spécialité médicale d'étude, de diagnostic et de traitement des cancers. Elle est pratiquée par des médecins oncologues ou cancérologues. Ceux-ci peuvent être suivant leur spécialité chimiothérapeutes ou radiothérapeutes.
Du fait d'une image négative sur le pronostic auprès du public, le cancer a de nombreux synonymes employés par les médecins : tumeur maligne, néoplasie, néoplasme, polymitose, carcinome, etc.
Certains termes sont plus répandus dans la langue populaire : tumeur, crabe, etc.
Étymologie
Du latin cancer (« crabe, chancre, cancer »), apparenté au grec ancien καρκινος, karkinos (« écrevisse »). Ce nom aurait été donné par Hippocrate, parce que le cancer « a des veines étendues de tous côtés, de même que le crabe a des pieds » [9]. La même source (Paul d’Égine) ajoute que « son nom lui vient, selon quelques-uns, de ce que quand il s’est emparé d’un organe, il ne le lâche plus, de même que fait le crabe quand il s’est attaché à quelque chose ».
Biologie
Typologie
On distingue généralement :
- Les carcinomes : cancer d'un épithélium, c'est-à-dire une surface composée uniquement de cellules
- Les sarcomes : cancers proliférant dans des tissus conjonctifs comme les os.
- Les cancers hématopoïétiques : cancer des cellules sanguines.
On peut aussi les classer selon les organes touchés, par exemple :
- Le cancer du sein
- Le cancer du côlon : cancer du côlon et, proche, celui du rectum
- Le cancer du pancréas
- Le myélome multiple : cancer de la moelle osseuse
- les leucémies : cancers du sang
- Le sarcome de Kaposi : cancer des vaisseaux sanguins
- Lymphomes : maladie de Hodgkin et lymphome non-hodgkinien.
- Le cancer des testicules
- Le cancer des poumons, causé le plus souvent par la cigarette ou autres.
Il existe presque autant de sources de cancer que de tissus dans l'organisme. Certains sont toutefois plus fréquents que d'autres.
Génétique et cancer
D'un point de vue pathologique, les cancers sont des maladies génétiques, c’est-à-dire qu’ils ont pour origine une modification quantitative et/ou qualitative de nos gènes. Comme il s’agit d’altérations génétiques somatiques qui ne sont présentes que dans le tissu malade, la plupart des cancers ne sont donc pas eux-mêmes héréditaires, seul un terrain plus ou moins favorable pouvant l'être. Les cancers familiaux (10 % des cancers humains) sont associés à une altération constitutionnelle (ou germinale) d’un gène. Cette altération est donc présente dans toutes les cellules de l'organisme, gamètes incluses. Elle peut être transmise à la descendance.
Il y a trois grandes catégories de gènes associés aux maladies cancéreuses : les oncogènes, les gènes suppresseurs de tumeurs et les gènes de réparation de l’ADN.
- Les oncogènes (appelés proto-oncogènes lorsqu'ils sont dans leur état normal et oncogènes lorsqu'ils sont mutés, ou c-onc) sont les régulateurs positifs de la prolifération cellulaire. Ils deviennent hyperactifs et leur modification est dominante car il suffit qu'une des deux copies du gène soit modifiée. On a identifié actuellement plus de cent oncogènes. Les plus connus sont les gènes Ha-ras, myc, ou abl.
- La seconde catégorie comprend les gènes suppresseurs de tumeurs qui sont des régulateurs négatifs de la prolifération cellulaire (les freins). Les deux copies de ces gènes sont inactivées dans les cancers.
- La troisième catégorie correspond aux gènes des multiples systèmes de réparation qui sont capables de détecter et de réparer les lésions de l’ADN qui ont modifié les oncogènes ou les gènes suppresseurs de tumeur. Ces systèmes de réparation sont également inactivés dans les cellules cancéreuses.
Transformation cellulaire
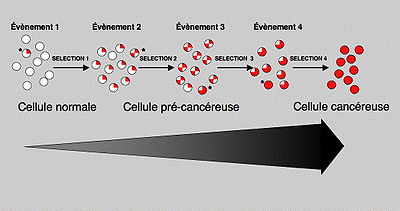 Durant toute la vie cellulaire, notre patrimoine génétique (l'acide désoxyribonucléique ou ADN) est soumis à des agressions. Dans la majeure partie des cas, ces modifications de l'ADN passent inaperçues car des mécanismes réparateurs corrigent ces défauts. Pourtant, dans de rares cas, une mutation peut atteindre et modifier la structure d'un gène spécifiant un facteur qui règle le contrôle de la multiplication cellulaire (oncogène ou gène suppresseur de tumeur). Dans ce cas, la cellule peut acquérir un avantage sélectif qui lui permettra de donner naissance à un premier clone de cellules anormales (lésion précancéreuse). Dans ces cellules qui ont un avantage sélectif, la probabilité qu'une seconde mutation apparaisse et soit sélectionnée est plus importante. Dans ce cas, une seconde population sera générée, plus anormale que la première et qui va se développer à ses dépens. On peut ainsi, par diverses étapes successives, accumuler plusieurs mutations, chacune d'entre elles permettant la sélection d’un clone de plus en plus malin pour finir par une cellule hautement cancéreuse. La progression tumorale correspond donc à un processus dynamique qui, à chaque étape, sélectionne une nouvelle cellule ayant subi une ou plusieurs altérations.
Durant toute la vie cellulaire, notre patrimoine génétique (l'acide désoxyribonucléique ou ADN) est soumis à des agressions. Dans la majeure partie des cas, ces modifications de l'ADN passent inaperçues car des mécanismes réparateurs corrigent ces défauts. Pourtant, dans de rares cas, une mutation peut atteindre et modifier la structure d'un gène spécifiant un facteur qui règle le contrôle de la multiplication cellulaire (oncogène ou gène suppresseur de tumeur). Dans ce cas, la cellule peut acquérir un avantage sélectif qui lui permettra de donner naissance à un premier clone de cellules anormales (lésion précancéreuse). Dans ces cellules qui ont un avantage sélectif, la probabilité qu'une seconde mutation apparaisse et soit sélectionnée est plus importante. Dans ce cas, une seconde population sera générée, plus anormale que la première et qui va se développer à ses dépens. On peut ainsi, par diverses étapes successives, accumuler plusieurs mutations, chacune d'entre elles permettant la sélection d’un clone de plus en plus malin pour finir par une cellule hautement cancéreuse. La progression tumorale correspond donc à un processus dynamique qui, à chaque étape, sélectionne une nouvelle cellule ayant subi une ou plusieurs altérations.
La transformation cellulaire correspond au passage d’une cellule eucaryote normale vers une cellule eucaryote cancéreuse.
Contrairement aux maladies génétiques comme la mucoviscidose, les myopathies ou certaines hémophilies qui sont des maladies monogéniques (un seul gène est généralement altéré), le cancer est une maladie multigénique. Chaque cancer a pour origine l’altération de 10 à 20 gènes. Ces altérations se produisent de manières successives, chacune d’entre elles favorisant la suivante (voir encadré). Cette suite d’altérations se produit généralement sur une très longue plage chronologique (5 à 20 ans). Cette suite d’altération n’est pas aléatoire et pour chaque type de cancer, on a pu mettre en évidence d'une part une certaine spécificité des gènes altérés et d'autre part une chronologie dans le développement des évènements.
Dans les cancers du côlon, cette succession d’événements comprend (entre autres) tout d’abord l’inactivation du gène suppresseur de tumeur APC, puis une mutation de l’oncogène Ha-ras suivi de l’inactivation du gène suppresseur de tumeur p53. Il y a d’autres événements qui restent à identifier. Le point essentiel est la spécificité des gènes altérés et leur chronologie. Dans un autre type de cancer, les gènes impliqués et la chronologie sont totalement différents. APC n’est altéré que dans les cancers du côlon et jamais dans les cancers de la peau. Par contre l’altération de p53 peut être retrouvée dans pratiquement tous les types de cancers. Dans le cancer de la peau, contrairement au cancer du côlon, l’altération du gène p53 est l’un des premiers événements. Cette très grande diversité génétique est à la base de l’hétérogénéité de la pathologie cancéreuse. À l’intérieur même d’un type de cancer particulier comme le cancer bronchique, existent plusieurs sous-types (cancer bronchique à petites cellules, adénocarcinome, cancer bronchique à grandes cellules, etc.) chacun étant associé à des altérations génétiques particulières. La situation est identique pour d’autres cancers comme celui du sein, de l’estomac ou de la peau, chaque organe pouvant être associé à plusieurs types de cancers suivant le type histologique de la cellule ayant été à l’origine de la maladie.
Chronologie de la transformation cancéreuse
La formation d'un cancer - au sens strict - comporte 2 étapes distinctes et nécessairement successives :
- Cancérogenèse
- Tumorogenèse
- Carcinogenèse
C'est l'action de substances dites carcinogènes. Elles entraînent des anomalies génétiques touchant l'architecture ou la séquence de l'ADN. A ce stade, le cancer en formation n'est cliniquement pas observable et il n'a pas de conséquence fonctionnelle.
- Cancérogenèse
Ce stade de la transformation cancéreuse nécessite deux étapes : l'initiation et la promotion. Ces deux étapes sont obligatoirement successives et l'initiation précède toujours la promotion, sans quoi le processus cancéreux s'arrête. L'initiation correspond à l'accumulation des anomalies génétiques, la promotion à la réception par la cellule de facteurs de prolifération qui vont entraîner les divisions. Ces signaux vont donc pérenniser les anomalies au cours des divisions, et ainsi assurer la descendance de la cellule anormale, qui va de surcroît accumuler de nouvelles anomalies génétiques. (voir Transformation cellulaire).
La transformation cellulaire comporte deux éléments majeurs, l'immortalisation (les cellules deviennent incapables d'initier leur propre mort (apoptose) ou deviennent indépendantes aux signaux extérieurs qui la déclenchent) et la perte d’homéostasie (caractérisée normalement par une balance divisions/mort qui assure le maintien de la taille et de la fonctionnalité d'un organe, les cellules cancéreuses perdent la sensibilité aux signaux qui régulent la prolifération).
L' initiation est la conséquence de la carcinogenèse. L'action des carcinogènes mute des gènes importants dans le maintien de l'intégrité et des caractéristiques de chaque type cellulaire. Il en résulte des pertes ou gains de fonctions cellulaires : activation ou dérépression d'un oncogène, inhibition ou répression d'un gène suppresseur de tumeur. Les oncogènes sont souvent des activateurs de la multiplication ou des inhibiteurs de l'apoptose (BCL, BCLX1, etc.) tandis que les gènes suppresseurs sont inducteurs de l'apoptose ou bloquent le cycle cellulaire (P53, BAC, etc.).
La promotion est caractérisée par une grande instabilité génomique et une augmentation de la perte d'homéostasie. L'instabilité génomique est due à des mutations de deux types de gènes :
- Les gènes portiers (gate keeper genes) : ils assurent le contrôle du passage à une étape ultérieure du cycle cellulaire, ce sont des « points de contrôle » du cycle cellulaire. Une perte de fonction de ces gènes permet à la cellule cancéreuse de passer rapidement à la phase ultérieure du cycle cellulaire, donc in fine de proliférer de façon incontrôlée.
- Les gènes soignants (care taker genes) : ils assurent physiologiquement la réparation des anomalies liées à l'ADN. Leur inactivation entraîne une instabilité accrue et une accumulation d'anomalies génétiques (mutation, perte d'hétérozygotie, modifications épigénétiques : hypo/hyperméthylation, désacétylation, etc.).
Ces points de contrôle et de réparation altérés, la cellule cancéreuse a désormais perdu la capacité à « reconnaître sa vieillesse », initier sa mort et réparer les dommages de son ADN. La réponse aux signaux de croissance physiologiques est en outre disproportionnée, puis la cellule commence à produire ses propres signaux de prolifération (cf. infra) : la croissance incontrôlée d'un pool de cellules n'a alors plus de limite.
À ce stade, le cancer est infraclinique: c'est une masse de cellules qui survit dans l'organisme. L'environnement des cellules cancéreuses (ou stroma, microenvironnement) est dit non coopératif : il ne fournit pas aux cellules cancéreuses les nutriments et le soutien que leur développement réclame. Cette phase est critique dans le développement clinique du cancer : si le stroma reste non-permissif, le cancer n'évolue pas, ou alors très lentement. Si en revanche il s'établit une réciprocité de maintien entre cancer et stroma (le cancer envoie des signaux permissifs au stroma, qui se modifie en faveur du cancer et va lui apporter nutriments et soutien, le cancer grossit, produit de plus en plus de signaux permissifs, etc.), l'évolution du cancer reprend et passe à un stade clinique. Le stroma devient permissif lorsqu'il est le siège d'une néoangiogenèse (sécrétion par la tumeur de facteurs de croissance angiogéniques (VEGF), apparition des récepteurs à ces facteurs sur le stroma (VEGF-R)) et de l'apparition de récepteurs tumoraux aux facteurs de croissances cellulaires (boucle autocrine) ou microenvironnementaux (boucle paracrine).
- Tumorogenèse
Il s'agit du développement du cancer donnant des conséquences cliniques : il grossit dans des limites histologiques précises (on parle de cancer in situ), puis les dépasse et devient donc invasif avec dissémination très probable de métastases.
La néoangiogenèse et la mise en place d'une circulation sanguine stable et relativement efficace est un préalable indispensable à cette phase : la croissance tumorale est telle qu'elle ne peut plus se contenter d'une diffusion à partir d'un stroma non permissif mais nécessite des apports importants et dédiés. La tumeur grossit jusqu'à atteindre la lame basale : le cancer est dit in situ et son risque de métastase est faible. La croissance tumorale continue et la membrane basale se rompt, le cancer devient invasif : les cellules cancéreuses ont alors de grandes facilités à atteindre les courants métastatiques (circulations lymphatique pour les carcinomes et veineuse pour les sarcomes) et la dissémination dans le corps débute.
Origine des cancers
Environs 15 % des cancers humains peuvent être associés à des agents infectieux. Cela peut être des virus (HBV et cancer du foie, HPV et cancer du col de l’utérus, EBV et lymphome de Burkitt), plus rarement des bactéries (Helicobacter et cancer gastrique) ou encore plus rarement des parasites (Schistosomes et cancer du foie). Dans tous ces cas, outre l’infection, on trouve également des altérations d’oncogènes ou de gènes suppresseurs dans les tumeurs. L’agent infectieux n’intervient qu‘à une étape du processus de transformation cellulaire.
L’origine des altérations qui modifient les oncogènes et les gènes suppresseurs de tumeurs est multiple. On les classe généralement en deux grandes catégories, exogène et endogène.
- L’origine exogène correspond à toutes les expositions environnementales auxquelles un organisme est soumis. Cela va du tabac aux ultraviolets du soleil en passant par l'amiante, les radiations gamma, l’alcool et de nombreuses autres substances auxquelles un individu est exposé volontairement ou involontairement. Elles peuvent agir directement au niveau de notre ADN et provoquer des altérations comme certaines molécules dans le tabac ou les ultraviolets ou provoquer des états inflammatoires favorisant l’apparition de cellules cancéreuses (alcool).
- Les altérations d’origine endogène sont provoquées en partie par des molécules issues de notre métabolisme comme les espèces réactives à l’oxygène. Chaque jour notre ADN subit des millions d’agressions de la part de ces molécules mais dans la très grande majorité des cas, celles-ci sont réparées de manière très efficace. Néanmoins, il suffit d’une défaillance dans la réparation d’un gène important pour enclencher ou continuer un processus de transformation cellulaire. Des travaux récents (2007) suggèrent que les systèmes de réparation de l’ADN ont une efficacité qui diminue avec l'âge.
En 2000, dans leur article « The hallmarks of cancer »[1], Robert Weinberg et Douglas Hanahan ont suggéré que la transformation cellulaire passe par l’acquisition d'au moins six propriétés :
- Indépendance vis-à-vis des signaux stimulant la prolifération. Les cellules normales ne se divisent que lorsqu'elles reçoivent un stimulus particulier. Les cellules tumorales n'ont plus besoin de ce signal.
- Insensibilité aux signaux inhibiteurs
- Abolition de l’apoptose ou mort cellulaire programmée. En cas de stress ou d’anomalie ne pouvant pas être éliminée, une cellule normale se suicide en utilisant l’apoptose. Les cellules tumorales ont inactivé tous ces mécanismes pour mieux survivre.
- Capacité proliférative illimitée : le nombre usuel de divisions cellulaires pour une cellule humaine est de 50 à 60 (sénescence cellulaire, limite de Hayflick), après quoi elle cesse de pouvoir se diviser (voir article Télomère). Les cellules tumorales continuent de se diviser sans limite visible grâce à l’activité de la télomérase qui est fortement active dans toutes les cellules cancéreuses.
- Capacité de susciter l’angiogenèse. Les cellules tumorales (et la tumeur) ont un besoin important en oxygène pour survivre. Elles vont donc stimuler la formation de nouveaux vaisseaux sanguins afin d’oxygéner la tumeur.
- Acquisition d’un pouvoir invasif. Les cellules tumorales sont capables de passer à l'intérieur d’un vaisseau sanguin afin d’être transportées dans un autre organe où elles vont générer une seconde tumeur (métastase)
Évolution
De son foyer initial, le cancer va (en dehors de tout traitement ou si le traitement n'est pas efficace) :
- se développer de manière locale. Il provoque dans ce cas une compression des organes voisins, voire un envahissement et une destruction des tissus adjacents ;
- se développer de manière régionale. Il envahit les ganglions lymphatiques, où logent les cellules du système immunitaire ;
- se propager à distance de la tumeur initiale et former des métastases. Il y a souvent une confusion chez les patients et leur famille : un cancer du sein avec des métastases au niveau du cerveau ne donne pas un cancer du cerveau ; c'est toujours le cancer du sein initial, mais qui s'est développé ailleurs. Il faut continuer à le traiter comme un cancer du sein.
L'évolution dépend du type du cancer et de sa prise en charge : certains ne font que très peu de métastases et sont très sensibles aux traitements permettant d'aboutir dans la grande majorité des cas à une rémission complète et prolongée (ce terme de rémission est spécifique de la cancérologie et diffère de guérison par l'absence de certitude quant à une récidive à court, moyen ou long terme). D'autres sont encore très difficilement maîtrisables et peuvent entraîner le décès à court terme. Une évaluation précise du type du cancer auprès d'un médecin spécialisé est donc indispensable.
De quoi meurt-on quand on « meurt d'un cancer » ?
C'est là une question fréquemment posée aux médecins par les patients ou leur famille, qui ont peine à croire qu'une petite tumeur (du moins en apparence) menace tout un organisme.
La réponse est invariable : la vie dépend de la bonne marche d'un certain nombre de fonctions, dont la respiration (au sens large, en incluant la distribution d'oxygène par la circulation sanguine), la digestion et l'excrétion (reins, foie). Selon celui des trois systèmes qui est altéré par les cellules cancéreuses, par exemple, le patient meurt — si l'on n'arrive pas à juguler la progression du mal — :
- d'insuffisance respiratoire ;
- d'hémorragie interne ;
- de dénutrition ;
- d'empoisonnement, par accumulation de substances toxiques normalement filtrées et excrétées par les reins et le foie, etc.
Causes
Épidémiologie et facteurs de risque
L'épidémiologie du cancer est rendue difficile, par le fait qu'il faut souvent plusieurs décennies pour que les symptômes se manifestent, et parce qu'il existe de nombreux facteurs prédisposant au cancer, génétiques ou environnementaux qui probablement agissent souvent en synergie : L'étude de ces facteurs dits cancérigènes, carcinogènes ou cancérogènes est celle de la cancérogenèse.
Les facteurs de risque du cancer peuvent être endogènes (provenant de l'organisme) et/ou exogènes (extérieurs à l'organisme). L'étude sur des registres de vrais jumeaux, ou des changements de taux de cancer chez les populations migrantes permettent de démontrer la part environnementale de nombreux cancers.Risques endogènes
- Risque génétique (ou risque endogène)
Dans certains cas, l'apparition d'un cancer a une composante héréditaire. C'est le cas de quelques-uns comme certains cancers du sein[10]. Certains cancers induits par certains comportements transmis de génération en génération (consommation d'alcool ou de tabac) peuvent être confondus avec un risque génétique vrai, et inversement certains gènes prédisposant au cancer pourraient n'être activés que dans certaines circonstances (obésité, alcoolisme, etc.).
Risques environnementaux
Les facteurs exogènes de risque (facteurs non-génétiques ou « environnementaux ») dépassent le seul champ de l'environnement (au sens français du terme), puisque recouvrant aussi, par exemple, les bactéries et virus inducteurs de cancers. Ils sont pour partie induits à l'environnement et pour partie aux comportements à risque qui augmentent l'exposition de l'individu à ces facteurs.
On distingue notamment (liste non limitative) :
- Tabac
- Le tabac est un facteur de risque majeur pour différents cancers (voies respiratoires, ORL, vessie)[réf. nécessaire].
- Consommation d'alcool (même à dose modérée[11])
- L'éthanol est classé dans la liste des cancérogènes du groupe 1 du CIRC ; il augmente le risque de plusieurs cancers, et ceci d'autant plus que la dose ingérée est importante [12]. Les cancers les plus favorisés par l'alcool sont :
- le cancer du foie et le cancer du pancréas [11];
- les cancers des voies aérodigestives supérieures : cancer de la bouche (langue, cavum, lèvres), cancer de l'œsophage, cancer de l'estomac [11];
- le cancer du sein ; une femme augmente son risque de cancer du sein du 10 % par 10 g d'alcool par jour (un verre).
- Radiations
- Les radiations, dont les UV du soleil, sont cancérigènes. Il est donc important d'utiliser correctement les crèmes solaires lors d'une exposition prolongée au soleil car cela augmente considérablement le risque de cancers de la peau à cause des ultraviolets [réf. nécessaire].
- Virus et bactéries
- Virus et bactéries font partie des facteurs exogènes du cancer. Certains cancers peuvent être provoqués par des virus, tels le cancer du col de l'utérus provoqué par le VPH [13].
- Obésité
- L'obésité jouerait un rôle dans près de 4 % des cancers, et pour beaucoup des cancers hormonaux-dépendants (du sein et de l’utérus et semble-t-il colorectal, de la vésicule biliaire, de la prostate, du pancréas et des reins ; à cause d'une production oestrogénique anormale et accrue dans les tissus gras).
C'est un facteur de risque en forte augmentation, lui même éventuellement induit par des perturbateurs endocriniens également facteurs de risque.- On a récemment estimé aux États-Unis qu’un indice de masse corporelle de 30 à 35 (seuil de l'obésité) augmente d'un tiers le risque de mourir du cancer [14] .
- 100 000 cas de cancer seraient ainsi causés par l'obésité chaque année pour les années 2000-2010 [14] ;
- Une étude américaine récente a conclu que 9 % des cas de cancer colorectal, 17 % des cas de cancer du sein, 21 % des cas de cancer de la vésicule biliaire, 24 % des cas de cancer du rein, 28 % des cas de cancer du pancréas, 35 % des cas de cancer de l'œsophage et une écrasante majorité de 49 % des cas de cancer de l'endomètre avaient l'obésité comme cause probable [14],[15].
- De plus les chances de survie sont moindres chez l'obèse, car leur cancer est souvent détecté plus tardivement. Aux États-Unis où l'obésité a fortement progressé (touchant 15 % des enfants et adolescents de 6 à 19 ans en 2000 [16], avec 65 % des adultes étant soit en situation d'embonpoint, soit obèses [16], soit 3 fois plus qu'en 1980), elle serait même déjà la cause de 14 % des décès par cancer chez les hommes et 20 % chez les femmes (devant le tabagisme)[17].
- Probablement pour les mêmes raisons (hormonales), l'obésité de la mère aggrave aussi le risque de cancer du testicule chez le futur enfant (on en avait déjà un indice avec un taux plus faible de cancer des testicules observé chez les hommes conçus durant la dernière guerre mondiale en Europe de l'Ouest, alors que la nourriture était rationnée).
- Pourtant, environ 40 % des gens sondés sur tous les continents ne connaissaient pas le lien entre obésité et cancer [18]. Le message de la campagne mondiale 2009 contre le cancer de l'UICC [19] était qu'environ un cancer sur trois parmi les cancers les plus communs pourrait être évité par un poids normal, entretenu par une alimentation saine et équilibrée et une activité physique suffisante.
- Une étude récente [20] a conclu que le risque de cancer du pancréas double pour ceux qui étaient obèses ou en surpoids à l'adolescence, par rapport à ceux qui n'ont jamais été obèses ou en surpoids. Sur tous les cas de cancer étudiés, 27 % ont été attribués à l'obésité (les autres facteurs de risque pour ce type de cancer sont surtout le tabagisme (25 % des cas) puis le diabète).
- Certains perturbateurs endocriniens
- Des substances proches des hormones naturelles sont fortement soupçonnées d'initier des cancers dits « dépendants des hormones » (par exemple, le cancer du sein) ; la perturbation peut se produire in utero et donner par exemple des cancers du testicule, ou d'autres types de cancers susceptibles d'être induits par des molécules telles que le distilbène.
- Éclairage artificiel
- Il est évoqué, et parfois assimilé à la catégorie pollution lumineuse (pour le cancer du sein au moins), via une perturbation endocrinienne chez les femmes exposées à une lumière artificielle la nuit.
- Alimentation
- L'alimentation joue un rôle dans la survenue de cancers. Selon le Fonds mondial de recherche contre le cancer, 30 à 40 % des cancers seraient imputables à l'alimentation [21]. La consommation régulière de fruits et légumes diminuerait le risque de survenue d'un cancer[22].
- Pollution
- Le rôle exact des polluants dans la genèse des cancers reste difficile à évaluer. Les cancérologues accusent notamment la pollution chimique (pesticides [23],[24], etc.) d'être responsable d'une grande majorité de cancer, en contradiction avec le rapport de l'académie des sciences de médecine et du centre international de recherche sur la cancer de 2007 [25]. Relèvent également de la pollution les cancers provoqués par le contact, en milieu professionnel, avec des produits cancérogènes, notamment : amiante, benzène, arsenic, formaldéhyde, gaz moutarde, iode 131, radon, etc. et des produits de « mélanges » telles les poussières de bois, le goudron de houille et la suie[26]. L'OMS estime à 10 % la proportion de cancers liés au travail, ce qui correspond à plus de 200 000 décès annuels (rôle de l'amiante par exemple dans le mésothéliome)[27].
Selon le rapport 2007 de l'Académie nationale française de médecine, le tabac reste la principale cause de cancer. Viennent ensuite l'alcool, le surpoids et l’insuffisance d’exercice physique, puis les expositions professionnelles et les traitements hormonaux de la ménopause de la femme. La moitié des origines du cancer demeurent inexpliquées[28].
Prévention
La prévention du cancer se fonde sur :
- l'évitement ou la diminution de l'exposition aux cancérogènes de l'environnement et industriels : principalement, la lutte contre le tabagisme, la consommation excessive d'alcool et de graisses animales, l'exposition excessive au soleil, les normes de construction (désamiantage), manutention de produits dangereux dans le cadre professionnel, étude REACH ;
- le rôle protecteur de certains éléments : fibres, vitamines et autres antioxydants (céréales, légumes verts, fruits[29],[30]), ainsi que le thé vert (plus que le noir) ou le chocolat et plus précisément les aliments contenant de la catéchine. Consommer une gousse d'ail par jour réduit de moitié le risque de cancer de l'estomac, du colon et du rectum[31].
On peut y ajouter le traitement des lésions précancéreuses, pour éviter les métastases, bien qu'il s'agisse aussi de traitement « curatif ».
Il convient de faire la différence entre la prévention, qui cherche à diminuer la survenue de la maladie en luttant contre ses facteurs favorisants, et le dépistage, qui cherche à mettre en évidence une maladie de manière précoce pour la traiter plus facilement.
Le Plan Cancer (2003-2007/2009-2013) prévoit : une réorganisation de la recherche médicale, le renforcement de la prévention primaire, des efforts de dépistage, une amélioration de la prise en charge des maladies, des aides à l'insertion sociale des malades et des actions pour améliorer l'environnement.
Voir les articles :
Prévention active
Le docteur André Gernez propose un protocole de prévention active qui vise à éliminer les cellules cancéreuses quand elles sont peu nombreuses. Fondé sur l'alimentation et sur un légère chimiothérapie, ce protocole permettrait d'éviter le cancer dans 93 % des cas selon une étude de l'INSERM.[réf. nécessaire]
Médecine
Dépistage
Il consiste en la détection de lésions précancéreuses ou de cancers à des stades peu avancés : on recherche, chez une personne qui ne présente pas de symptômes, à mettre en évidence la maladie de manière précoce.
Cela se fait par :
- La clinique (l'examen du patient) : palpation des seins, toucher rectal, etc.
- Des examens paracliniques : radiographies, dosages biologiques.
Le but est de trouver, dans une population donnée, des lésions que l'on peut traiter facilement : si l'on attend les symptômes, il est souvent nécessaire d'avoir recours à des traitements plus lourds pour traiter la maladie.
Les dépistages ayant prouvé leur intérêt (ils diminuent le nombre de décès par cancer) sont :
- Le frottis du col utérin, pour dépister les lésions précancéreuses et les petits cancers du col utérin
- La mammographie, pour dépister des cancers du sein à un stade précoce
Actuellement, on cherche à prouver l'intérêt de la recherche de saignements minimes dans les selles (test hémocult) pour le dépistage des polypes et des petits cancers du côlon.
Diagnostic
Même s'il existe des éléments permettant d'identifier un cancer avec une grande probabilité, le diagnostic de certitude ne se fait que sur analyse au microscope (anatomopathologie) d'un échantillon de la tumeur (éventuellement aidé par d'autres techniques). Cet échantillon vient soit d'une biopsie (simple prélèvement d'un morceau de la tumeur) qui peut être faite, suivant la localisation, suivant différentes procédures (fibroscopie, ponction à travers la peau…), soit d'une pièce opératoire (tumeur enlevée par le chirurgien).
Principes de traitement
Le traitement doit être effectué uniquement en milieu spécialisé, en règle sur une stratégie définie par une équipe médicale pluridisciplinaire (c'est-à-dire comportant des médecins de plusieurs spécialités : oncologie, radiothérapie, chirurgie, gynécologie, gastro-entérologie, etc.).
Il nécessite :
- d'avoir un diagnostic de certitude et de connaître le type du cancer ;
- d'évaluer son extension locale, régionale et la présence ou non de métastases ;
- d'évaluer l'état général du patient (âge, fonctions cardiaque et rénale, présence d'autres maladies).
Suivant les cas, il repose sur :
- l'exérèse (l'ablation) chirurgicale large de la tumeur quand cela est possible, large voulant dire que le bistouri du chirurgien passe uniquement par des tissus sains ;
- un traitement mini-invasif percutané par radiofréquence, micro-ondes ou cryothérapie en complément ou en alternative à la chirurgie;
- une chimiothérapie, prescription de médicaments s'attaquant au cancer et à ses métastases ;
- une radiothérapie, l'irradiation de la tumeur permettant de faire fondre, voire disparaître, celle-ci.
Certains cancers peuvent bénéficier également :
- d'un traitement hormonal ;
- d'un traitement à visée immunologique consistant à augmenter l'action du système immunitaire ; Une piste est notamment explorée, qui associe l'interleukine-7 (IL-7) à un vaccin viral pour inciter le système immunitaire à attaquer les tumeurs. Ces travaux ont aussi montré comment l'IL-7 casse les barrières qui freinaient la réponse immunitaire aux tumeurs[32].
- d'un traitement à base d'ultrasons, une technologie en plein développement s'appuyant sur la focalisation d'un faisceau ultrasonore très puissant sur une métastase ;
- d'un traitement par photochimiothérapie qui consiste à détruire les cellules cancéreuses (notamment dans les cancers de la peau) au moyen de substances chimiques devenant toxiques à la lumière.
Souvent, plusieurs de ces types de traitements sont nécessaires chez un même patient.
Il ne faut pas oublier :
- le traitement des conséquences de la tumeur ;
- la prise en charge des effets secondaires du traitement ;
- le traitement de la douleur.
Traitements alternatifs
Il existe beaucoup de traitements alternatifs mais l'évaluation scientifique de leur efficacité est souvent soit inexistante, soit non validée en pratique clinique (c'est-à-dire validées dans des modèles expérimentaux ou animaux mais pas chez l'homme).
C'est le cas de la supplémentation en acide ascorbique, de la médecine orthomoléculaire, dont l'idée initiale a été donnée par Irwin Stone, reprise par le double prix Nobel (Nobel de chimie, Nobel de la paix) Linus Pauling et reprise ensuite par un certain nombre d'autres scientifiques, dont Matthias Rath. Un effet favorable semble exister chez les cultures cellulaires ou chez des animaux mais aucune preuve satisfaisante n'existe chez l'être humain à titre curatif[33]; ou préventif[34]. La Société Suisse de lutte contre le cancer souligne, en particulier, les faiblesses du dossier scientifique de Matthias Rath[35].
Un autre type de traitement dit « d'accompagnement » a été mis au point par une équipe de chercheurs de Rennes, la thérapie nutritionnelle à faible teneur en polyamines. Les polyamines sont des molécules provenant en grande partie de l'alimentation et contribuent au développement des cellules cancéreuses. Les solutés sont un complément aux traitements conventionnels, ainsi d'après un essai clinique[36] ils amélioreraient l'état de santé général, diminueraient la douleur de certains malades atteints d'un cancer métastasé de la prostate hormono-résistant et permettraient une réduction des doses de chimiothérapie et de morphine[37].
Soutien psychologique
Apprendre qu'on a un cancer est très difficile à assumer, tant cette nouvelle a longtemps été considérée comme celle d'une mort imminente. Par ailleurs l'hospitalisation, l'opération chirurgicale et les traitements adjuvants changent profondément la vie du malade. Il est donc essentiel d'apporter aux malades un soutien psychologique adapté.
En France, l'association de psycho-oncologie étudie comment aider au mieux les cancéreux, ce qui passe en général par la participation à des groupes de patients qui vivent les mêmes épreuves.
Cancers en médecine vétérinaire
Quelques espèces animales (requins) semblent épargnés par les cancers. On suppose de plus que dans la nature, les animaux sauvages victimes de tumeurs sont plus rapidement éliminés par leurs prédateurs ou éliminés par sélection naturelle. Par contre, les animaux domestiques, dont chiens et chats[38] sont fréquemment victimes de cancers semblables à ceux des humains[38] (en particulier : ostéosarcomes, cancer des mamelles, mélanomes buccaux, carcinomes épidermoïdes, tumeurs nasales, carcinome du poumon, sarcomes des tissus mous, et tumeurs malignes non hodgkiniennes, etc.[38]). Ces cancers semblent également de plus en plus fréquents ; c'est même la 1re cause de mortalité des chiens dans le monde[39] (chiens dont l'espérance de vie est en moyenne de 11 ans et trois mois[39]). 27 % des chiens meurent d'un cancer, alors que 18 % meurent d'une affections cardiaques, sachant aussi que les maladies dominante des chiens adultes sont infectieuses bactériennes, virales ou parasitaires, et que 50 % des chiens seraient obèse (facteurs qui peuvent contribuer à augmenter le risque de certains cancers).
Une médication et des moyens spécifiques (incluant chimiothérapie et radiothérapie) a été développée pour les animaux, sur la base des mêmes molécules et moyens.
Les animaux de laboratoires sont utilisés comme modèle animale en cancérologie humaine, y compris en épidémiologie[40] ou pour tester de manière statistiquement significative des médicaments à grande échelle[41].
Historique
Des cancers étaient déjà décrits dans des écrits égyptiens vers -3500. C'est Hippocrate qui donna la première définition de la maladie, appelée alors « carcinome » (une variété de cancer[42]) ou « squirre » (tumeur dure et indolore se formant en quelque partie du corps[43]) : une tumeur (gonflement) dure, non-inflammatoire, ayant tendance à récidiver et se généraliser jusqu'à la mort[44].
Dans le monde
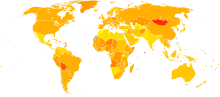 Taux de mortalité par cancer pour 100 000 habitants en 2004[45].
Taux de mortalité par cancer pour 100 000 habitants en 2004[45]. no data moins de 55 55-80 80-105 105-130 130-155 155-180 180-205 205-230 230-255 255-280 280-305 plus de 305
no data moins de 55 55-80 80-105 105-130 130-155 155-180 180-205 205-230 230-255 255-280 280-305 plus de 305En 2008, le cancer a causé la mort de 7,6 millions de personnes, surtout dans les pays en voie de développement (PVD), selon une étude du Centre international de recherche sur le cancer (CIRC, émanation de l'Organisation mondiale de la santé). En 2008, 56 % des 12,7 millions de nouveaux cas de cancer et 63 % des 7,6 millions de décès associés à un cancer dans le monde sont survenus dans les pays en développement selon une étude fondée sur 27 formes de cancer[46].
Les cancers les plus fréquemment diagnostiqués dans le monde sont ceux du poumon (12,7 %), du sein (10,9 %) et le cancer colorectal (9,7 %).
Les décès les plus fréquents sont provoqués par le cancer du poumon (18,2 %), de l'estomac (9,7 %) et le cancer du foie (9,2 %).
Les cancers du col utérin et du foie sont beaucoup plus fréquents dans les régions en développement, tandis que ceux de la prostate et du côlon-rectum sont plus fréquents dans les régions développées.
En prenant en compte le nombre d'habitants de chaque pays, ce sont les pays d'Amérique du Nord, ceux d'Europe de l'Ouest et l'Australie qui enregistrent les taux de mortalité les plus élevés.
Coûts économiques et socioéconomiques du cancer
La chimiothérapie et la chirurgie lourde, ainsi que les traitements au long cours font du cancer une des maladies financièrement les plus coûteuses pour la société. Le coût social du cancer est difficile a évaluer, mais est important et ne cesse d'augmenter[47]. Avec l'industrialisation des pays pauvres et l'évolution de leur mode de vie et de l'espérance de vie, le cancer tend à se globaliser sur la planète[48]; En 2010, plus de 50 % des nouveaux cas de cancer et près des 2/3 des décès par cancer touchent des personnes à faible revenu, à revenu inférieur à la moyenne et des pays en développement à revenu intermédiaire du monde (A titre de comparaison, en 1970, les pays en développement ne représentaient que 15 % des cancers nouvellement signalés[49]). En 2030, le monde en développement sera censé supporter 70 % du fardeau mondial du cancer[49].
En France, dans les années 2000, environ 280 000 nouveaux cas étaient détectés par an[50], avec une augmentation régulière du nombre de cas (358 000 nouveaux cas attendus en 2010 selon les modélisations de l'INVS (rendues nécessaire par le fait qu'en France, seule environ 20 % de la population est concernée par un registre du cancer)[51]) coût annuel estimé à 30 milliards d’euros pour 2004 [50]. 730 millions d’euros ont été accordés au 2nd Plan cancer (2009-2013) dont 95 millions pour la recherche et 400 millions pour les soins [50]). La recherche porte aussi sur les moyens de diminuer les coûts socio-économiques de la maladie et des soins. les 6èmes Rencontres parlementaires sur le Cancer (jeudi 21 octobre 2010) à l’Assemblée nationale ont porté sur le thème : « Cancer : quels coûts pour la société? »[50]. Certaines réflexions de la littérature internationale suggèrent « d'accepter, sans se poser de question, les stratégies thérapeutiques dont les coût marginaux pour le système de santé par année de vie gagnée demeurent inférieurs à deux fois le PNB par tête », soit moins de 50 000 euros[52]. Force est de rapprocher ce chiffre du fait que la moyenne des années de vie perdues est de 15 ans sur l'ensemble des cancers[53].
Des médecins et ONG telles le MDRGF et le réseau européen HEAL[54] protestent contre le fait que ce type d'approche ne portant que sur les coûts du soin, omettent de poser la question des causes environnementales et comportementales du cancer. Mieux les traiter permettrait selon eux d'importantes économies, plus durables, avec peut-être une forte réduction du nombre et de la gravité des cancers [55].Statistiques par pays
La comparaison des statistiques nationales est délicate, car la détection et les classifications ont varié en fonction des époques et pays. Ainsi, en France, le terme « cause environnementale » fait référence aux produits chimiques et à la pollution…, alors qu'en anglais, cela fait référence à tout ce qui entoure l'homme et, de manière générale, tous les facteurs exogènes, c'est-à-dire le soleil, l'alcool, le tabagisme, le nombre de grossesses…
En France
En 2000, environ 278 000 personnes étaient annuellement diagnostiquées comme atteintes d'un cancer, soit un Français sur deux cent cinquante[56]. Le nombre total annuel des décès par cancer en France était, en 2004, de 152 708, soit environ 241 décès pour 100 000 habitants. C'est la première cause de mortalité en France, juste avant les maladies cardio-vasculaires (147 323 décès en 2004) dont le taux a baissé de 50 % depuis les 25 dernières années alors que le taux de décès par cancer n'a que peu diminué[57]. En même temps des cancers de plus en plus divers sont dépistés de plus en plus précocement. Les 3 cancers les plus fréquents chez l’homme sont le cancer de la prostate, le cancer du poumon et le cancer du colon-rectum. Chez la femme, les 3 cancers les plus fréquents sont le cancer du sein, le cancer du colon-rectum et le cancer du poumon.
Il existe une augmentation du nombre de certains cancers. Les cancers du poumon, mésothéliomes, hémopathies malignes, tumeurs cérébrales et cancers du sein, de l'ovaire, du testicule, de la prostate et de la thyroïde sont en augmentation très significative depuis les années 1980[58],[59]. Ceci est en partie lié au vieillissement et à la croissance de la population et touche différemment l'homme et la femme. De 1980 à 2005 (en tenant compte de la démographie), le taux de cancers s'est élevé de 35 % pour les hommes et de 43 % pour les femmes[60]. En 2008, l’INSERM a conclu d'une revue de la littérature scientifique mondiale relative aux liens entre ces 9 cancers en augmentation et exposition passive à des cancérogènes, avérés ou suspectés dans l'environnement (incluant donc le tabagisme passif, mais non le tabagisme actif), que ni les améliorations du dépistage ni l’évolution de la démographie ne pouvaient expliquer cette augmentation. L’exposition aux cancérigènes de l'environnement est donc supposée, mais reste mal évaluée, bien que des liens de causalité soient déjà établis par exemple entre cancer du poumon et pollution particulaire de l’air par le trafic automobile, le chauffage et l’industrie (« Environ 1 300 à 1 900 décès par cancer du poumon pourraient être évités chaque année dans 23 villes européennes si les niveaux de PM2,5 particules fines étaient ramenés respectivement à 20 et à 15 microgrammes par millimètre cube (µg/mm3) ». Mais la norme européenne sur les PM2,5 (max de 25µg/mm3 en 2010) ne sera en vigueur qu'en 2015.
On sait que les rayons ionisants (rayons X et gamma en particulier) peuvent induire de nombreux cancers : (poumon, thyroïde, sein, cerveau, plèvre, leucémies…) et que les radiographies fréquentes augmentent le risque de cancer du sein et, peut-être d'autres cancers a conclu l’étude. Or ces examens sont de plus en plus fréquents (+ 5 à 8 % par an en France).
Plus de 900 molécules pesticides sont autorisées en France, souvent sans études toxicologique ou écotoxicologiques complètes (incluant donc les risques à long terme). L'exposition aux insecticides domestiques du fœtus lors de la grossesse ou dans l'enfance est associée à un doublement du risque de leucémie et moindrement à un risque de tumeur ou cancer du cerveau. L'AFSSET s’est en 2008 engagé à produire des avis et recommandations dans un proche avenir.Incidence (1980-2005) et mortalité (2005) par cancer en France[61] Cancer Incidence Mortalité Tous les cancers 319 380 145 762 Prostate 62 245 9 202 Sein 49 814 11 201 Côlon-rectum 37 413 16 865 Poumons 30 651 26 624 Cavité buccale et pharynx 12 270 4 000 Lymphome Malin Non Hodgkinien 10 224 4 203 Vessie 9 679 4 482 Rein 7 949 3 684 Mélanome (peau) 7 401 1 440 Pancréas 7 218 7 787 Estomac 6 794 4 756 Thyroïde 6 672 403 Foie 6 433 7 390 Utérus (corps) 5 774 1 800 Œsophage 4 721 3 850 Myélome 4 516 2 789 Ovaire 4 375 3 180 Système nerveux 4 120 3 019 Larynx 3 735 1 406 Leucémie lymphoïde chronique 3 224 1 059 Leucémies aiguës 3 082 2 733 Col de l'utérus 3 068 1 067 Testicule 2 002 82 Maladie de Hodgkin 1 544 218 Plèvre 906 1 090 Il est essentiel de bien noter la différence entre l'incidence d'un cancer (la fréquence annuelle calculée sur une durée précise) et la mortalité. Ce tableau montre bien que certains cancers très fréquents (prostate) ont une mortalité faible contrairement à des cancers plus rares (pancréas) qui ont une mortalité très élevée.
La France est parfois présentée comme étant le pays ayant la plus longue survie après cancer[62]. Mais concernant la survie à 5 ans après le diagnostic, elle serait le second en Europe derrière la Suède, avec environ 52 % de survie (63 % pour les femmes, 44 % pour les hommes)[63]. Cela cache de grandes disparités selon les cancers. On atteint des chances de survie de 95 % pour le cancer de la thyroïde; chez les hommes, on atteint 80 % de survie à 5 ans pour le cancer de la prostate, et quasiment 100 % pour les cancers des testicules, et, chez les femmes, 85 % pour le cancer du sein entre 15 et 44 ans, mais 78 % au-delà de 75 ans. En revanche, les cancers profonds sont diagnostiqués plus tardivement et sont très souvent mortels: cancer du pancréas (10 % de survie), du poumon, etc.
L'État et l'assurance maladie ont consacré un peu plus de 12 milliards d'euros à la lutte contre le cancer en 2004, 90 % de cette somme étant dédiée aux soins[64]
En France, un outil[65] en ligne l'Institut National du Cancer (INCa) donne accès aux principaux indicateurs et recherches sur le cancer (avec un rapport 2011 sur la situation en France[66])
Qualité des soins : taux de survie et surmortalité
Le taux de survie dépend aussi de l'âge. Cinq ans après le diagnostic, 70 % des 15–45 ans survivent. Alors que seuls 39,4 % des malades cancéreux âgés de 75 ans survivront plus de 5 ans ; sachant qu'étant donné le risque de métastases, on ne parle pas de guérison pour un cancer, mais de rémission (voir Évolution plus loin). En France et au Canada, le cancer est la première cause de mortalité chez les plus de 65 ans[67].
Pour estimer l'efficacité du dépistage et des soins, on utilise le taux de survie et la surmortalité à une certaine durée après le diagnostic.Taux de survie
Selon La Ligue nationale contre le cancer, en 2006, le taux de survie à cinq ans après diagnostic en France, pour des patients suivis entre 1989 et 1997 était :
Survie à cinq ans par localisation et par sexe[68] Hommes Femmes 75 % et + Lèvre 96 % Thyroïde 95 % Testicule 95 % Maladie de Hodgkin 92 % Thyroïde 88 % Mélanome de la peau 89 % Maladie de Hodgkin 85 % Lèvre 88 % Mélanome de la peau 83 % Sein 85 % Prostate 80 % Corps utérin 76 % 50 à 74 % Pénis 67 % Col utérin 70 % Rein 63 % Rein 64 % Vessie 60 % Os, articulations et cartilages articulaires 62 % Os, articulations et cartilages articulaires 59 % Larynx 59 % Côlon 56 % Rectum 58 % Rectum 55 % Côlon 57 % Larynx 54 % Vulve et vagin 52 % Lymphome malin non hodgkinien 54 % Vessie 50 % 25 à 49 % Nasopharynx 45 % Langue 45 % Intestin grêle 45 % Myélomes multiples 43 % Myélomes multiples 42 % Intestin grêle 42 % Cavité orale 38 % Ovaire 40 % Langue 33 % Fosses nasales,
sinus annexes de la face,
oreille moyenne et oreille interne37 % Hypopharynx 34 % Leucémie aiguë lymphoblastique 29 % Estomac 28 % 25 % et - Estomac 23 % Système nerveux central 19 % Système nerveux central 20 % Poumon 18 % Poumon 13 % Œsophage 14 % Œsophage 11 % Mésothéliome de la plèvre 13 % Foie 7 % Foie 9 % Mésothéliome de la plèvre 6 % Pancréas 7 % Pancréas 5 % Surmortalité
Pour un groupe de personnes chez lesquelles on a diagnostiqué un cancer, on peut distinguer celles mortes des suites de leur cancer, et celles mortes d'autre chose. La surmortalité à une durée t (par exemple de 10 ans) liée au cancer est la probabilité de mourir du seul fait du cancer durant la durée t qui suit le diagnostic.
Le problème de l'évaluation de cette mortalité est qu'il faudrait connaître les causes de tous les décès des personnes dont on a diagnostiqué un cancer, ce qui est impossible. On utilise donc une autre estimation ; pour un groupe de personnes du même sexe et du même âge, on utilise la « survie relative », c'est-à-dire le rapport entre :
- la probabilité de survie après un temps t du groupe de personnes dont on a diagnostiqué un cancer, et
- la probabilité de survie à t d'un groupe de personnes n'ayant pas de cancer, de même âge et de même sexe.
La surmortalité est alors le complément à 1 de cette survie relative.
Les études montrent une surmortalité d'environ 2 % au-delà de 10 ans après le diagnostic dans les pays développés, ce qui pointe l'irrationalité de la ségrégation que subissent les patients ayant eu un cancer de la part des assurances et des banques (surtaxes, refus de prêt, etc.).
Les résultats ci-après sont issus du document Cancers — Pronostics à long terme de l'INSERM.
L'étude Eurocare s'est penchée sur une vingtaine de pays européens pour des cas diagnostiqués durant trois périodes (les malades étudiés durant une période forment une « cohorte ») : 1978–1985, 1985–1989 et 1990–1994. Cette étude ne distingue pas le stade du diagnostic.
Étude Eurocare, surmortalité, tous cancers et tous âges confondus délais après diagnostic surmortalité deux sexes confondus femmes hommes 0–1 an 27 % 20 % 33 % 2e année 15 % 5e année 5 % 10e année 2,27 % 1,95 % 3,18 % 11–12eannée 2 % moins de 2 % un peu plus de 2 % Étude Eurocare, surmortalité, tous cancers et deux sexes confondus délais après diagnostic surmortalité par classe d'âge toutes classes
d'âge confondues15–44 ans 45–54 ans 54–65 ans 65–74 ans 0–1 an 27 % 12 % 33 % 4e année moins de 5 % 10e année 2,27 % 1,24 % 2,06 % 2,42 % 3,03 % 11–12eannée 2 % un peu plus de 1 % plus de 3 % Étude Eurocare, surmortalité à 10 ans, toutes classes d'âge et deux sexes confondus surmortalité localisation du cancer < 2 % - tumeurs germinales du testicule (0,03 %),
- corps de l'utérus (0,28 %),
- leucémies aiguës lymphoïdes (0,33 %),
- thyroïde (0,49 %),
- côlon (0,91 %),
- mélanomes cutanés (0,91 %),
- maladie de Hodgkin (1,03 %)
- col de l'utérus (1,13 %),
- rectum (1,44 %),
- ovaires (1,80 %),
2–5 % - sein (2,57 %),
- larynx (2,74 %),
- leucémies aiguës myéloïdes (2,75 %),
- oropharynx (2,76 %),
- rhinopharynx (2,96 %),
- rein (3,13),
- lymphomes malins non-hodgkiniens (4,18 %)
> 5 % - poumon (5,64 %),
- prostate (6,67 %),
- hypopharynx (9,11 %),
- leucémies lymphoïdes chroniques (9,67 %),
- leucémies myéloïdes chroniques (10,27 %)
L'étude américaine SEER s'est intéressée au stade du cancer au moment de son diagnostic, selon trois catégories :
- tumeur localisée ;
- tumeur ayant un développement régional (ganglionnaire) ;
- tumeur ayant un développement à distance (métastase).
Étude SEER, surmortalité à 5 ans, toutes classes d'âge et deux sexes confondus, pour un cancer diagnostiqué au stade de tumeur localisée surmortalité localisation du cancer < 1 % - prostate (0,00 %),
- tumeurs germinales du testicule (0,00 %),
- thyroïde (0,00 %),
- corps de l'utérus (0,50 %),
- mélanomes cutanés (0,61 %),
- ovaires (0,86 %),
- col de l'utérus (0,91 %)
1–3 % - sein (1,02 %),
- rein (1,80 %),
3–5 % larynx (2,90 %) > 5 % poumon (7,20 %) Cancer chez l'enfant
Selon une grande étude européenne [69]publiée fin 2004 et fondée sur les registres du cancer, l'analyse d'une base de données financée par l'Union européenne regroupant 80 registres de cancers et couvrant environ la moitié des enfants (jusqu'à 14 ans) et un quart des adolescents (15 à 19 ans), a montré que le taux moyen de l'incidence du cancer par classe d'âge dans les années 1990, calculé sur près de 50 000 cas, s'établit à 140 cancers par million d'enfants, contre 118 dans les années 1970 et 124 dans les années 1980. Si les cancers des enfants ne comptent que pour moins de 1 % du nombre total de cancers, et bien qu'ils soient - dans les pays dits développés - guéris dans les deux tiers des cas [70], ces cancers restent, dans les pays riches, la seconde cause de mortalité de l'enfant [71]. Dans les pays industrialisés, environ 1 enfant sur 500 déclare un cancer avant l'âge de 15 ans (presque 1500 nouveaux cas par an en France, dont 50 % avant l'âge de 6 ans).
Les cancers de l'enfant sont en forte augmentation : chez les adolescents, ce taux est de 193 par million au cours des années 1990, contre 147 dans les années 1970 et 165 dans les années 1980[69]. Dans les années 90, le taux de cancer chez l'enfant était en Europe un peu plus important à l'Est qu'à l'Ouest, à cause de cancers de la thyroïde plus fréquents (attribués aux retombées de Tchernobyl)[69].Les leucémies (450 cas nouveaux par an en France) sont les cancers les plus fréquents[72] chez l'enfant, devant (principalement) :
- des tumeurs cérébrales (300/an en France);
- des lymphomes (190/an en France, dont 56 % de lymphomes non-hodgkiniens déclarés entre 2 et 3 ans).
Les tumeurs embryonnaires sont plus fréquentes les premières années de la vie, et des sarcomes osseux et des tissus mous chez les grands enfants.
Étude Eurocare, surmortalité chez les enfants délais après diagnostic surmortalité 0–1 an > 10 % 4e année 2 % 7e année 1 % En raison d'une évaluation difficile des expositions indirectes et des effets de synergies possibles, des relations certaines de cause à effet sont difficiles à établir [73], mais les pesticides (ingérés ou inhalés par l'enfant, ou ses parents avant la naissance) semblent être l'une des causes d'augmentation, notamment pour les tumeurs du cerveau, avec 9 études sur 16 qui concluent à une relation causale possible en cas d'emploi de sprays insecticides ou d'autres pesticides par la mère (OR 1,5 ; 2,2) ou si le père a manipulé des pesticides agricoles (RR 2,0 ; 2,9 ; 3,3) [74] (Dans de mêmes conditions environnementales, les enfants sont significativement plus exposés que les adultes aux pesticides [75],[76],[77],[78],[79],[80],[81],[82], alors même qu'ils y sont a priori plus vulnérables). D'autres cancers de l'enfant semblent induits ou co-induits par des pesticides (leucémie [74], neuroblastome[74], tumeur de Wilms[74], sarcomes des tissus mous[74], sarcomes d'Ewing[74], lymphome non-Hodgkinien[74], cancer colorectal[74] et cancer des testicules[74]) [74]. Dans ce dernier cas un effet perturbateur endocrinien est probable.
Cancers hématopoïétiques de l'enfant
Une étude[83] a confirmé que l’exposition des ménages français aux pesticides domestiques augmente (doublement environ) le risque de cancers hématopoïétiques (cancer du sang) de leur enfant.
Cette étude a exploité le RNHE, le « Registre national des hémopathies malignes de l'enfant » (antérieurement dénommé « Registre national des leucémies de l'enfant »)[84] qui enregistre les cas signalés d’hémopathie maligne ou à la limite de la malignité, chez les enfants habitant en France métropolitaine ayant moins de 15 ans au moment du diagnostic.
L’étude s’est aussi appuyée sur le registre national ESCALE (Étude sur les cancers de l'enfant pour la période 2003-2004).
Les mères d’un échantillon d’enfants atteints de cancers du sang et celles d’un échantillon-témoin ont été questionnées sur l’usage éventuel de pesticides (par la mère ou par le père) dans l’habitation lors de la grossesse ; en différenciant les insecticides (bombes utilisé à la maison, traitement d’animaux de compagnie, ou traitement du jardin ou des cultures, etc.), les herbicides et les fongicides. Les chercheurs ont aussi intégré des paramètres tels que l'âge, le sexe, le degré de d’urbanisation de l’environnement et le type de logement (appartement ou maison).
Le panel retenu pour la période d’étude (2003-2004) était constitué des parents de 764 enfants ayant déclaré une leucémie aiguë, 130 enfants ayant présenté un lymphome de Hodgkin (LH), et 166 cas de lymphome non-hodgkinien (LNH). Ce groupe ayant été comparé à une population-témoin de parents de 1 681 enfants, le dépouillement des questionnaires a montré qu’utiliser des insecticides dans la maison durant la grossesse a significativement augmenté le risque que l’enfant déclare une leucémie aiguë (leucémie lymphoïde ou leucémie myéloïde) ou un lymphome non hodgkinien, surtout un Lymphome de Burkitt (près de 3 fois plus de risque : OR = 2,7 ; IC à 95 %, 1,6-4,5) ou des tumeurs mixtes à cellule de lymphome non hodgkinien (OR = 4,1 ; IC à 95 %, 1,4-11,8). Par contre l’exposition aux pesticides domestiques n’a pas augmenté le risque de lymphome hodgkinien à sclérose nodulaire (« Nodular sclerosis ou « NSHL » pour les anglosaxons »), cancer qui touche majoritairement des filles plus âgées.
L’utilisation domestique de pesticides par le père a également semblé lié à une légère augmentation moindre, mais également significative du nombre de leucémies aiguës (OR = 1,5 ; IC à 95 %, 1,2-1,8) et de lymphomes non hodgkiniens NHL (OR = 1,7 ; IC à 95 %, 1,2-2,6), mais les liens avec la leucémie aiguë ne sont plus significatifs après prise en compte de l'usage des pesticides par la mère durant la grossesse.
Cette étude confirme l'hypothèse que l'usage domestique des pesticides joue un rôle dans l'étiologie de ces cancers hématopoïétiques de l'enfance. Les auteurs concluent que la cohérence des résultats avec ceux d'études antérieures soulève à nouveau la question de l'opportunité de prévenir l'usage des pesticides dans l’environnement des femmes enceintes.
Notes et références
- Douglas Hanahan et Robert A. Weinberg, « The hallmarks of cancer », Cell, vol. 100, pp. 57-70, 2000.
- Douglas Hanahan et Robert A. Weinberg, « Hallmarks of cancer: the next generation », Cell, vol. 144, pp. 646-674, 2011.
- Anton Vos, « Comment le cancer se développe », Le Temps, mercredi 9 mars 2011, p. 14.
- Bulletin de veille scientifique Santé / Environnement / Travail, n° 13, ANSES (2011).
- * Conférence intitulée « Génome et Cancer » par Mark Lathrop, pour l'Université de tous les savoirs (vidéo de 57 min), 21 juin 2008
- http://www.has-sante.fr/portail/jcms/c_758598/depistage-du-cancer-de-la-prostate-de-nouveaux-eclairages-vont-contribuer-a-la-definition-de-la-politique-publique-a-mettre-en-place
- http://www-ulpmed.u-strasbg.fr/medecine/cours_en_ligne/e_cours/cancero/module10_item138C.pdf
- http://www.invs.sante.fr/publications/2003/rapport_cancer_2003/
- Ralph W. Moss, Galen on Cancer: How Ancient Physicians Viewed Malignant Disease, 1989, citant Michael Shimkin, Contrary to Nature, DHEW Publication No. (NIH) 79-720, Superintendent of Documents, Washington, DC, p. 35, lui-même citant Paul d’Égine, Le Livre de la chirurgie, VIIe siècle.
- en particulier si la mère, une sœur ou une fille a été diagnostiquée avant la ménopause ou s’il y a présence de mutations héréditaires de certains gènes tels BRCA1 ou BRCA2
- Conclusions du Centre international de recherche sur le cancer (CIRC).
- (fr)Communiqué du 11 décembre 2007 de l'Institut National Du Cancer
- Page intitulée Papillomavirus et cancer du col de l'utérus (Institut Pasteur)
- American Institute for Cancer Research
- Article de l'UICC intitulé « Obesity Causes 100,000 Cancer Cases Annually »
- Sondage 1999-2000 National Health and Nutrition Examination Survey
- Association Américaine pour l'avancement des sciences, février 2008.
- étude du uicc (international union against cancer)
- UICC World Cancer Campaign lancée le 4 février 2009
- étude américaine ayant porté sur 841 victimes d'un cancer du pancréas et 754 personnes-témoins n'en ayant pas, citée dans le New York Times et citée par l'UICC
- (en) Gary Gardner and Brian Halweil, Underfed and Overfed: The Global Epidemic of Malnutrition Worldwatch Institute, March 1, 2000, 68 pages, ISBN 1-878071-52-1
- Boffetta P, Couto E, Wichmann J et Als. Fruit and vegetable intake and overall cancer risk in the European Prospective Investigation Into Cancer and Nutrition (EPIC), JNCI, 2010
- Agricultural pesticide exposure and the molecular connection to lymphomagenesis, J. Agopian et al., 2009
- Occupational exposure to pesticides and lymphoid neoplasms among men: results of a French case-control study, A. Monnereau et al., 2009
- [PDF][http://www.academie-sciences.fr/publications/rapports/pdf/cancer_13_09_07.pdf Les causes du cancer en France, notamment à partir de la p33
- Liste du Centre international de recherche sur le cancer (CIRC), ref à retrouver
- Kaushal Raj Pandey. Occupational cancer kills more than 200 000 people a year. BMJ 2007;334:925
- Rapport 2007 de l'Académie nationale de Médecine sur les causes du cancer
- OIV, numéro 62, 2001.
- information hospitalière, 2004.
- Aaron T Fleischauer, Charles Poole and Lenore Arab, University of North Carolina, Garlic consumption and cancer prevention: meta-analyses of colorectal and stomach cancers 1,2,3, American Journal of Clinical Nutrition, Vol. 72, No. 4, 1047-1052, October 2000
- Nature Medicine, 27 avril 2009.
- Block KI. Koch Amanda, Mead MN,[Impact of antioxidant supplementation on chemotherapeutic efficacy: A systematic review of the evidence from randomized controlled trials ], Cancer Treatment Reviews, 2007;33:407-18
- Bjelakovic G, Nikolova D, Gluud LL, Simonetti RG, Gluud C, Antioxidant supplements for prevention of mortality in healthy participants and patients with various diseases, Cochrane Database of Systematic Reviews, 2008;2 DOI: 10.1002/14651858.CD007176
- Document de la ligue contre le cancer Suisse sur les études du Dr. RATH et la vitamine C
- Cipolla B, Guillí F, Moulinoux JP. Polyamine-reduced diet in metastatic hormone-refractory prostate cancer (HRPC) patients. Biochem Soc Trans. 2003 Apr;31(2):384-7.
- Un aliment pour accompagner le traitement du cancer. Article du 11 décembre 2007 sur http://www.lesechos.fr.
- E. Gregory MacEwen , « Spontaneous tumors in dogs and cats: Models for the study of cancer biology and treatment », Cancer and Metastasis Reviews Volume 9, Number 2, 125-136, DOI: 10.1007/BF00046339 (Résumé)
- Article de Romandie News relatif à une étude anglaise de novembre 2010 publiée par l'assureur animalier SantéVet
- Thrusfield M., Companion animal epidemiology: its contribution to human medicine Acta Vet Scand Suppl. 1988;84:57-65. (PubMed)
- Vail DM, MacEwen EG, Spontaneously occurring tumors of companion animals as models for human cancer. ; Cancer Invest. 2000;18(8):781-92. (Résumé).
- définition sur le site du Centre National de Ressources Textuelles et Lexicales.
- définition sur le site du Centre National de Ressources Textuelles et Lexicales.
- Le cancer, histoire et regards portés sur la maladie
- WHO Disease and injury country estimates, World Health Organization, 2009. Consulté le Nov. 11, 2009
- Le cancer a tué 7,6 millions personnes en 2008, swissinfo.ch, 1er juin 2010
- Breakaway: The global burden of cancer—challenges and opportunities ; Rapport rédigé par des experts en santé publique, sur le coût des cancers, et publié par le Economist Intelligence Unit du Journal The Economist 2010, (PDF, en anglais, 73 pages)
- P. Boyle, « The Globalisation of Cancer », Lancet, vol. 368, p. 629-630 (2006).
- Boyle P, Levin B (eds.) World Cancer Report 2008, Lyon : International Agency for Research on Cancer, 2008.
- colloque « Cancer, quels coûts pour la société », Assemblée Nationale, 2010/10/21 (Source EHESP, 2010)
- communiqué de presse intitulé Les chiffres 2010 du cancer disponibles sur le site de l’InVS
- Institut national du cancer, Analyse économique des coûts du cancer en France, mars 2007, page 36.
- Institut national du cancer, Analyse économique des coûts du cancer en France, mars 2007, page 28.
- Health and Environment Alliance (HEAL)
- Communiqué : Le MDRGF et le réseau européen HEAL dénoncent l’absence totale de prise en compte de l’environnement dans cette épidémie et lancent une nouvelle grande campagne sur ce sujet majeur.
- Institut national du cancer, Analyse économique des coûts du cancer en France, mars 2007, page 23.
- Numéro thématique du Bulletin épidémiologique hebdomadaire du 18 septembre 2007 / n°35-36 - Surveillance épidémiologique des causes de décès en France - publié par l'InVS
- Cancer, approche méthodologique du lien avec l'environnement, Editeur : INSERM, expertise collective 2005, 92 p. (Communiqué, consulté 2008 10 04)
- Comparaison et évolution des incidences chez l'homme et la femme (tableau Inserm, 2008)
- Belot A, Grosclaude P, Bossard N, Jougla E, Benhamou E, et coll. Cancer incidence and mortality in France over the period 1980-2005. Revue d'Épidémiologie et de Santé Publique 2008, 56 :159-175
- Institut de veille sanitaire (InVS) INSERM
- source: Le téléphone sonne, émission radiophonique de France Inter, 24 mai 2005
- étude menée par l'Institut National du Cancer [www.e-cancer.fr], rapport d'avril 2010 Survie attendue des patients atteints de cancers en France
- Institut national du cancer, Analyse économique des coûts du cancer en France, mars 2007, page 117.
- INCa Les données sur le cancer, en ligne, consulté 2011 11 09
- Rapport INCa 2011 sur Les cancers en France
- Cancer (vue d'ensemble) sur passeportsante.net.
- Belle éclaircie sur le front du cancer, Éric Favereau, Libération, 28 février 2007
- Steliarova-Foucher E et al ; Geographical patterns and time trends of cancer incidence and survival among children and adolescents in Europe since the 1970s (the ACCISproject): an epidemiological study.Lancet. 2004, 11, 364(9451):2097-105
- http://ist.inserm.fr/basisrapports/cancer-pronostic/synthese.pdf
- Walker KM, Carozza S, Cooper S, Elgethun K. ; Childhood cancer in Texas counties with moderate to intense agricultural activity. ;J Agric Saf Health. 2007 Jan;13(1):9-24. (Résumé)
- Inserm
- J L Daniels, A F Olshan, and D A Savitz ; Pesticides and childhood cancers. ; Environ Health Perspect. 1997 October; 105(10): 1068–1077. (Résumé)
- Shelia Hoar Zahm and Mary H. Ward ; Pesticides and Childhood Cancer; Environmental Health Perspectives ; Vol 106, Supplement 3 ; juin 1998
- Simcox NJ, Fenske RA, Wolz SA, Lee IC, Kalman DA. Pesticides in household dust and soil: exposure pathways for children of agricultural families. Environ Health Perspect 103:1126-1134 (1995).
- Physicians for Social Responsibility. Pesticides and Children: What the Pediatric Practitioner Should Know. Washington: Physicians for Social Responsibility, 1995; 1-8.
- National Research Council. Pesticides in the Diet of Infants and Children. Washington:National Academy Press, 1993.
- Wiles R, Davies K, Campbell C. Overexposed: Organophosphate Insecticides in Children's Food. Washington:Environmental Working Group/The Tides Center, 1998.
- Wiles R, Davies K. Pesticides in Baby Food. Washington: Environmental Working Group, 1995.
- Hill RH Jr, To T, Holler JS, Fast DM, Smith SJ, Needham LL, Binder S. Residues of chlorinated phenols and phenoxy acid herbicides in the urine of Arkansas children. Arch Environ Contam Toxicol 18:469-474 (1989).
- Leiss JK, Savitz DA. Home pesticide use and childhood cancer: a case-control study. Am J Public Health 85:249-252 (1995).
- Reeves JD. Household insecticide-associated blood dyscrasias in children. Am J Hematol Oncol 4:438-439 (1982).
- Household Exposure to Pesticides and Risk of Childhood Hematopoietic Malignancies: The ESCALE Study (SFCE) Environ Health Perspect 115:1787-1793 (2007). doi: 10.1289/ehp.10596], Jérémie Rudant et al. décembre 2007, Environmental Health Perspectives, Vol. 115 | N° 12, en ligne depuis le 25 septembre 2007
- Registre National des Hémopathies malignes de l'Enfant
Voir aussi
Articles connexes
- Liste des cancers
- Liste de cancérogènes du groupe 1 du CIRC
- Association européenne contre le cancer du col de l'utérus
- Institut Curie
- Institut national du cancer
- La Ligue nationale contre le cancer
- Institut Gustave Roussy
- Recherche en cancérologie
- Atlas of Genetics and Cytogenetics in Oncology and Haematology
- « The hallmarks of cancer »
Liens externes
- (fr) Catégorie cancer de l’annuaire dmoz
- (fr) Cancer the Open Directory Project
- (fr) Fiches par cancer et par pays sur le site de l'Observatoire européen du cancer
Catégories :- Cancérologie
- Terme médical
Wikimedia Foundation. 2010.

