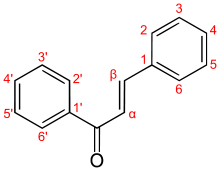
- Chalcone
-
 Cet article concerne le composé chimique. Pour le genre de papillon de la sous-famille des Hesperiinae, voir Chalcone (papillon).
Cet article concerne le composé chimique. Pour le genre de papillon de la sous-famille des Hesperiinae, voir Chalcone (papillon).Chalcone 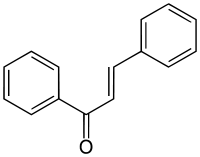
Général Nom IUPAC 1,3-diphénylprop-2-èn-1-one Synonymes benzylidènacétophénone
phénylstyrylcétoneNo CAS (mélange des stéréoisomères)
(isomère E)No EINECS (M.S.)
(E)PubChem SMILES InChI Apparence prismes jaune pâle Propriétés chimiques Formule brute C15H12O Masse molaire[1] 208,2552 ± 0,0131 g·mol-1
C 86,51 %, H 5,81 %, O 7,68 %,Propriétés physiques T° fusion 57,5 °C[2] ((M.R.)
59 °C[3] (E)T° ébullition 346,5 °C[2] (M.R.) Solubilité 92,9 mg·l-1eau, 25 °C, M.R.)[2] Masse volumique 1,071 g·cm-3 Pression de vapeur saturante 1,07×10-4 mmHg (M.R.)[2] Précautions Directive 67/548/EEC 
XnPhrases R : 22, 36/37, Phrases S : 22, 36/37/39, 45, Écotoxicologie DL50 681 mg·kg-1 (M.R., souris, i.p.)[4]
56 mg·kg-1 (M.R., souris, i.v.)[5]
1 048 mg·kg-1 (E, souris, oral)[6]LogP 3,08 (M.R)[2]
3.660 (E)[3]Unités du SI & CNTP, sauf indication contraire. La chalcone est une énone aromatique, qui est le noyau d'une classe de composé chimique au rôle important en biologie, les chalcones. Elle est constituée d'une molécule de prop-2-ènal ou acroléine liée à chaque extrémité à un groupe phényle. La chalcone existe donc sous la forme de deux stéréoisomères (Z et E) en fonction de la disposition des substituants autour de la double liaison centrale.
Sommaire
Synthèse
Biosynthèse
La chalcone est naturellement synthétisée par un grand nombre de plantes suivant la voie métabolique des phénylpropanoïdes. La phénylalanine est d'abord transformée en acide cinnamique, lui-même transformé en acide paracoumarique qui forme alors un thioester avec le coenzyme A, le 4-coumaroyl-CoA. Ce dernier réagit alors avec 3 molécules de malonyl-coenzyme A qui finissent par se cycliser et former un second groupe phényle, formant ainsi la chalcone.
acide paracoumarique + coenzyme A
 4-coumaryl-CoA
4-coumaryl-CoA4-coumaryl-CoA + 3 malonyl-CoA
 + 4 CoA + 3 CO2
+ 4 CoA + 3 CO2PAL: phénylalanine ammonia-lyase, C4H : cinnamate 4-hydroxylase, 4CL: 4-coumarate-CoA ligase, CHS : chalcone synthase.
La chalcone peut ensuite être transformée par cyclisation interne en flavonoïde.
Réaction proche
La naringinine-chalcone (phlorétine) est produite de façon similaire, à partir de 4-coumaroyl-CoA et de 3 molécules de malonyl-coenzyme A, par l'action d'une autre enzyme, la naringinine-chalcone synthase.
En laboratoire
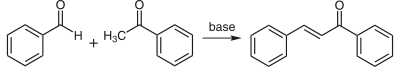
En laboratoire, la chalcone peut être préparée par crotonisation (condensation aldolique) du benzaldéhyde avec l'acétophénone, réaction catalysée par une base, en général de la soude :
Cette réaction s'est révélée marcher également sans solvant, c'est-à-dire une réaction en phase solide[7]. Cette réaction entre un benzaldéhyde substitué et l'acétophénone a servi de modèle dans le cadre de la chimie verte[8]. Cette réaction, dans ce cadre a aussi été effectuée, à partir des mêmes réactifs, dans l'eau à haute température (entre 200 et 350 °C[9]).
Dérivés
La chalcone peut être substituée en de nombreuses positions, par différents groupes. Ces dérivés sont appelés chalcones (parfois chalconoïdes).
On peut citer l'isoliquiritigénine (2',4',4-trihydroxychalcone), la butéine (3,4,4',6'-tétrahydroxychalcone), le kanakugiol (2′-hydroxy-3′,4′,5′,6′-tétraméthoxychalcone) ou encore la pédicelline (2′,3′,4′,5′,6′-pentaméthoxychalcone).
Propriétés et applications
Les chalcones ont des propriétés antibacterienne, fongicide, antitumorale et anti-inflammatoire. Il a été montré que certaines chalcones avaient la possibilité de bloquer des canaux membranaires potassiques (Voltage-gated potassium channel)[10].
La chalcone et les chalcones substituées sont aussi des intermédiaires dans la biosynthèse des flavonoïdes, des substances très répandues dans les plantes qui ont un rôle biologique important. Les chalcones sont d'ailleurs des intermédiaires réactionnels dans la production synthétique de flavones par la synthèse d'Auwers. Elles peuvent aussi être utilisées pour la synthèse de flavonols par la réaction d'Algar-Flynn-Oyamada.
La méthylhydroxychalcone (MCHP, C16H14O2), présente dans la cannelle a été considérée comme un mimétique de l'insuline, capable d'améliorer la réponse à l'insuline chez les diabétiques[11].
Notes et références
- Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
- (en) « Chalcone » sur ChemIDplus
- (en) « (E)-chalcone » sur ChemIDplus
- Indian Journal of Chemistry, Section B: Organic Chemistry, Including Medicinal Chemistry. Vol. 18, Pg. 65, 1979.
- U.S. Army Armament Research & Development Command, Chemical Systems Laboratory, NIOSH Exchange Chemicals. Vol. NX#04476
- Journal of Agricultural and Food Chemistry. Vol. 46, Pg. 1163, 1998.
- Toda, F., et al., J. Chem. Soc. Perkin Trans. I, 1990, 3207.
- Palleros, D. R., J. Chem. Educ., 81, 1345 (2004).
- Comisar, C. M. and Savage, P. E., Green Chem., 6 (2004), 227 - 231. DOI:10.1039/b314622g
- Yarishkin, O.V., et al., Bioorg. Med. Chem. Lett., 18, (2008), 137–140.
- Anderson, « A hydroxychalcone derived from cinnamon functions as a mimetic for insulin in 3T3-L1 adipocytes », dans J Am Coll Nutr., vol. 20, no 4, 1er août 2001, p. 327–36 [texte intégral, lien PMID (pages consultées le 2008-06-19)]
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Chalcone » (voir la liste des auteurs)
Voir aussi
Catégories :- Produit chimique nocif
- Chalcone
Wikimedia Foundation. 2010.