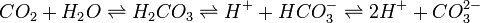- Hydrogénocarbonate
-
Bicarbonate
Le bicarbonate, ou hydrogénocarbonate, est un ion polyatomique dont la formule chimique est HCO3-. "Bicarbonate porte ce nom de part le caractère double de ses propriétés, il est à la fois acide et base appartenant à deux couples acido-basiques différents, on appelle cela une espèce amphotère. A ne pas confondre avec les ions carbonates qui portent deux charges négatives. Il s'agit de la forme intermédiaire entre la déprotonation de l'acide carbonique : ôter le premier proton (ion H+) de l'acide carbonique donne le bicarbonate ; ôter le second proton donnera la forme carbonate ionique.
Le mot s'écrit au pluriel (bicarbonates) lorsqu'il s'agit des sels de l'ion bicarbonate. Par exemple, le bicarbonate de sodium (soda à pâte) NaHCO3. Les bicarbonates qui entrent en contact avec des acides tel l'acide acétique du vinaigre se transformeront en dioxyde de carbone gazeux. Ce procédé est employé en cuisson pour permettre au pain de lever et aussi lors de la propulsion des fusées jouets. Il contribue à la digestion dans notre organisme
Dans l'eau, le dioxyde de carbone (acide carbonique), l'ion bicarbonate et l'ion carbonate sont en équilibre, en fonction du pH :
L'ajout d'un acide déplace les équilibres vers la gauche (avec, éventuellement, dégagement de dioxyde de carbone), tandis que l'ajout d'une base les déplace vers la droite (avec, éventuellement, précipitation d'un sel carbonaté). Ceci donne au bicarbonate, qui occupe la place intermédiaire, une fonction tampon.
Ce rôle de tampon existe notamment dans le sang, où il est très important pour le maintien du pH (Cf. Homéostasie).
Dans l'organisme le bicarbonate est produit par le pancréas, en réponse à la présence de sécrétine elle meme produite par l'épithélium du duodenum, et permet de faire baisser l'acidité dans ce dernier.
Voir aussi
Articles connexes
- Portail de la chimie
Catégories : Carbonate | Sel | Anion -
Wikimedia Foundation. 2010.